|
|
|
|
V Сабининские чтения 29 ноября 2016 - 29 января 2017 Диагностический ключ для определения зеленых микроводорослей порядка Protosiphonales (Chlorophyceae, Chlorophyta)
Темралеева А.Д., Москаленко С.В. Anna D. Temraleeva, Svetlana V. Moskalenko
Институт физико-химических и биологических проблем почвоведения РАН (г. Пущино)
УДК 582.263:579.8.06
В статье описана современная система зеленых микроводорослей порядка Protosiphonales (Chlorophyceae, Chlorophyta), построенная на основе морфологического, экологического и 18S рРНК-анализов. Приводится ключ для идентификации семейств и родов порядка, их описания с иллюстративным материалом. Перечислены представители таксонов. Ключевые слова: зеленые микроводоросли; диагностический ключ; морфология; экология; молекулярная филогения.
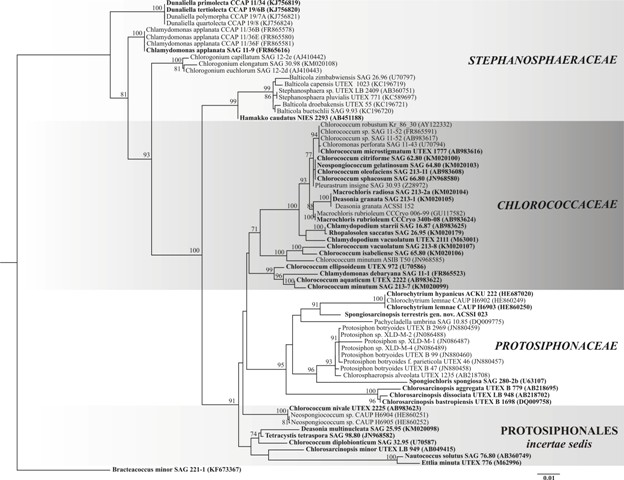
Порядок Protosiphonales Ettl et Komarek (1982) в расширенной трактовке И.Ю. Костикова с соавт. (2001) объединяет зеленые микроводоросли, преимущественно обитающие в почвах. С точки зрения современной молекулярной систематики все представители порядка объединены в кладу Stephanosphaerinia внутри класса Chlorophyceae (Nakada et al., 2008). По итогам собственного исследования, включающего изучение морфологии, экологии и 18S рРНК-филогении представителей группы, мы предлагаем выделить на дереве макроклады Stephanosphaerinia (= порядок Protosiphonales) четыре группы, три из которых могут соответствовать семействам Chlorococcaceae, Stephanosphaeraceae и Protosiphonaceae, а одна имеет неопределенный статус (рис. 1). Описание объектов и методов филогенетического анализа подробно изложено в статье Темралеевой с соавт. (2017). Ниже приводим диагностический ключ для зеленых микроводорослей порядка Protosiphonales на основе морфологических, ультраструктурных и экологических данных ряда авторов (Pocock, 1960; Archibald, 1979; Виноградова и др., 1980; Nozaki et al., 1995; Андреева, 1998; Borowitzka, Siva, 2007; Nakada, Nozaki, 2009; The Freshwater…, 2011; Костиков и др., 2012; Buchheim et al., 2013; Holzinger et al., 2014; Fučíková, 2015; Kawasaki et al., 2015), а также личных исследований.
Рис. 1. Укорененное филогенетическое дерево зеленых микроводорослей порядка Protosiphonales, построенное методом максимального правдоподобия (ML), на основе последовательностей гена 18S рРНК (1763 п.н.). Примечание. В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения < 70% не показаны. Модель нуклеотидных замен: GTR+I+G. Жирным шрифтом выделены аутентичные штаммы. Fig. 1. The rooted phylogenetic tree of green microalgal order Protosiphonales constructed by maximal likelihood method (ML) for 18S rRNA gene sequence data (1763 bp). Note. Node support of the tree is given as ML bootstrap values; values < 70% are not shown. Model of nucleotide changes is GTR+I+G. Authentic strains were marked by a bold font.
Порядок Protosiphonales Зеленые микроводоросли монадной, коккоидной, сарциноидной организации (нитчатый или сифональный типы редки, встречаются только у родов Pleurastrum Chodat и Protosiphon Klebs соответственно). Хлоропласт 1, пристенный или центральный, с 1 или несколькими пиреноидами. Ядро 1 или несколько. Бесполое размножение путем десмосхизиса (вегетативного клеточного деления), апланоспорами и двужгутиковыми изоконтными голыми или одетыми в клеточные оболочки зооспорами. У некоторых наблюдается половой процесс – изогамия. В основном ведут свободноживущий образ жизни в наземных и водных экосистемах в виде одиночных форм. Колониальные и эндофитные формы водорослей встречаются редко, характерны только для представителей рода Stephanosphaera Cohn и Chlorochytrium Cohn, соответственно. Способны к гиперсинтезу липидов и вторичных каротиноидов.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ СЕМЕЙСТВ
Семейство Stephanosphaeraceae Водоросли свободноживущие с монадной организацией таллома. Клетки одиночные или в шаровидных ценобиях (от 2 до 16 клеток). Одиночные вегетативные клетки с двумя жгутиками, стигмой и сократительными вакуолями. Клетки эллипсоидной, яйцевидной, овальной, цилиндрической, грушевидной, веретеновидной и почти шаровидной формы. Хлоропласт 1, пристенный, обычно чашевидный, с 1 или 2 пиреноидами, но может быть 4–6 и более (до 12). Ядро 1. Бесполое размножение зооспорами и апланоспорами. Зооспоры с 2 или 4 жгутиками равной длины. Половое размножение – изогамия. Обитатели морских или пресных вод. В семейство вошли зеленые водоросли родов Stephanosphaera, Chlorogonium, Hamakko, Balticola и ‘Dunaliella’[1] секция Tertiolectae Massyuk (1972). Штаммы вида Chlamydomonas applanata следует дополнительно валидизировать для уточнения правильности таксономической идентификации. [1] Здесь и далее в кавычки берется название полифилетичного рода.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ
Stephanosphaera (рис. 2, d) Колониальная водоросль, обычно по 8 клеток в шаровидных ценобиях, редко 2, 4 или 16. Клетки неправильно веретеновидной формы со множеством слизистых отростков на полюсах, 1 стигмой и 2 жгутиками. Жгутики выходят за пределы слизистой оболочки ценобия. Хлоропласт 1, пристенный чашевидный. Ядро 1. Пиреноида обычно 2, по одному у каждого полюса клетки. Размножение зооспорами и апланоспорами, половой процесс – изогамия. Способны к синтезу вторичных каротиноидов. Представители: типовой вид S. pluvialis Cohn, Stephanosphaera sp.
Chlorogonium (рис. 2, b) Клетки одиночные веретеновидные, яйцевидные или удлиненно-эллипсоидные с 2 равными жгутиками и однослойной стигмой. Оболочка гладкая. Хлоропласт 1, пристенный в виде пластинки или спирали. Ядро 1. Пиреноиды 2-4 и более (до 6-12), пронизаны трубчатыми тилакоидами. Размножение зооспорами, половой процесс – изогамия. Представители: C. capillatum Nozaki, Watanabe et Aizawa, C. elongatum (Dangeard) Francé и типовой вид C. euchlorum (Ehrenberg) Ehrenberg.
Hamakko (рис. 2, e) Клетки одиночные веретеновидные с тупым передним и острым задним концом, с 2 равными жгутиками и двухслойной стигмой. Оболочка гладкая. Хлоропласт 1, пристенный в виде пластинки или спирали. Ядро 1. Пиреноиды от 1 до 5, обычно 2, пронизаны уплощенными тилакоидами. Размножение зооспорами. Представители: типовой вид Hamakko caudatus Nakada.
Balticola (рис. 2, c) Клетки одиночные эллипсоидные, грушевидные или почти шаровидные со стигмой и 2 жгутиками. Основная часть протопласта находится на некотором расстоянии от клеточной стенки и соединяется с ней тонкими цитоплазматическими нитями. Хлоропласт 1, пристенный чашевидный. Ядро 1. Пиреноид 1 или 2. Размножение зооспорами, половой процесс – изогамия. Способны к синтезу вторичных каротиноидов. Представители: B. buetschlii (Blochmann) Droop, B. capensis (Pocock) Droop, типовой вид B. droebakensis (Wollenweber) Droop и B. zimbabwiensis (Pocock) Droop.
‘Dunaliella’ секция Tertiolectae (рис. Клетки одиночные овальные, эллипсоидные, цилиндрические, почти шаровидные, редко яйцевидные или грушевидные. Клетки с 2 равными жгутиками и стигмой, без целлюлозной клеточной стенки. Хлоропласт 1, пристенный чашевидный. Ядро 1. Пиреноид 1. Размножение зооспорами и апланоспорами. Виды секции Tertiolectae Massyuk (1972) являются морскими и эстуарными, обитают в водоемах с соленостью 2–4% NaCl (Borowitzka, Siva, 2007). Представители: D. polymorpha Butcher, D. primolecta Butcher, D. quartolecta Butcher и D. tertiolecta Butcher.
Семейство Chlorococcaceae Водоросли свободноживущие с коккоидной организацией таллома. Клетки одиночные или во временных скоплениях, эллипсоидной, яйцевидной и шаровидной формы. Оболочка гладкая, при старении может приобретать концентрическую слоистость и утолщаться до 5,0–6,5 мкм, иногда неравномерно, образуя слизистую ножку. Хлоропласт 1, пристенный полый шаровидный, мантиевидный, глубокочашевидный, массивный с выростами. Пиреноид 1 со сплошной крахмальной обверткой. Зрелые клетки одноядерные и многоядерные. Многие представители способны к гиперсинтезу липидов и вторичных каротиноидов. Бесполое размножение зооспорами и апланоспорами. Зооспоры с оболочкой и 2 жгутиками равной длины. Половое размножение – изогамия. Преимущественно обитатели почв, реже – пресных вод. В семейство вошли зеленые водоросли родов ‘Chlamydopodium’, ‘Chlorococcum’ и ‘Macrochloris’. Штаммы Deasonia granata SAG 213-1 и ACSSI 152, которые не имеют различий в гене 18S рРНК с M. radiosa, по-видимому, являются представителями рода Macrochloris. Аналогично штамм Rhopalosolen saccatus SAG 26.95 следует перенести в род Chlamydopodium, Neospongiococcum gelatinosum SAG 64.80 – в род ‘Chlorococcum’ т.к. различия в гене 18S рРНК составляют 0,1%. Штаммы нитчатой водоросли Pleurastrum insigne SAG 30.93, коккоидной водоросли C. aquaticum UTEX 2222 и монадных водорослей Chloromonas perforata SAG 11-43 и Chlamydomonas debaryana SAG 11-1 следует дополнительно валидизировать для уточнения правильности таксономической идентификации.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ
‘Chlamydopodium’ (рис. 2, h) Клетки одиночные или во временных скоплениях, молодые веретеновидные, булавовидные, обратнояйцевидные, эллипсоидные, при старении почти шаровидные с бесцветной слизистой ножкой. Оболочка тонкая. Хлоропласт 1, пристенный, в молодых клетках блюдцевидный, мантиевидный, чашевидный или слегка лопастной, в зрелых клетках глубокочашевидный, рассечен несколькими щелями. Ядро 1. Пиреноид 1 со сплошной крахмальной обверткой. Размножение зооспорами и апланоспорами, половой процесс – изогамия. Зооспоры с оболочкой, папиллой, 2 равными жгутиками, 2 передними сократительными вакуолями, желобчатым хлоропластом, передней стигмой и задним ядром Покоящаяся стадия – акинеты с утолщенной оболочкой. Представители: C. starrii (Fott) Ettl et Gärtner, C. vacuolatum (Lee et Bold) Ettl et Komárek.
‘Chlorococcum’ (рис. Клетки одиночные или во временных скоплениях, молодые шаровидные, эллипсоидные, яйцевидные, при старении шаровидные Оболочка гладкая, с возрастом культуры может утолщаться до 5–6,5 мкм и приобретать концентрическую слоистость. Хлоропласт 1, пристенный, в молодых клетках полый шаровидный с отверстием или без, в зрелых может становиться массивным глубокочашевидным, перфорированным щелями. Ядро 1. Пиреноид 1 со сплошной крахмальной обверткой. Размножение зооспорами и апланоспорами, половой процесс – изогамия. Зооспоры с оболочкой, папиллой, 2 равными жгутиками, передней стигмой, срединным или задним ядром. Способны к синтезу вторичных каротиноидов. Представители: C. robustum Ettl et Gärtner, C. microstigmatum Archibald et Bold, C. citriforme, C. oleofaciens, C. sphacosum, C. vacuolatum Starr, C. isabeliense, C. minutum Starr, C. ellipsoideum Deason et Bold.
‘Macrochloris’ (рис. Клетки одиночные или во временных скоплениях, молодые шаровидные, эллипсоидные, при старении шаровидные Оболочка утолщается до 1 мкм. Хлоропласт 1, в молодых клетках пристенный полый шаровидный с отверстием, в зрелых – массивный с выростами. Ядра многочисленные. Пиреноид 1, иногда 2–3, со сплошной крахмальной обверткой. Размножение зооспорами и апланоспорами, половой процесс – изогамия. Зооспоры с оболочкой, папиллой, 2 равными жгутиками, передней стигмой, передним или срединно-задним ядром, срединным или задним пиреноидом. Способны к синтезу вторичных каротиноидов. Представители: M. radiosa Ettl et Gärtner, M. rubrioleum Kawasaki et Nakada.
Семейство Protosiphonaceae Водоросли свободноживущие и эндофитные, с коккоидной, сарциноидной и сифональной организацией таллома. Клетки одиночные или в комплексах различной величины. Одиночные клетки – шаровидной, широкоэллипсоидной или неправильной формы, в комплексах – угловатые. Оболочка гладкая, при старении может утолщаться до 10 мкм и приобретать концентрическую слоистость. Только у рода Pachycladella оболочка образует трубчатые или конические отростки. Хлоропласт 1, в молодых клетках пристенный, полый шаровидный или чашевидный, у некоторых родов в зрелых клетках становится центральным, сетчатым или губчатым. Пиреноид от 1 до нескольких с крахмальной обверткой, способной к фрагментации в зрелых клетках. Зрелые клетки одноядерные и многоядерные. Многие представители способны к гиперсинтезу липидов и вторичных каротиноидов. Бесполое размножение зооспорами, апланоспорами и десмосхизисом. Зооспоры без оболочки с 2 жгутиками равной длины. Половой процесс – изогамия. Преимущественно обитатели почв, реже – пресных вод. В семейство вошли зеленые водоросли родов Pachycladella, ‘Chlorosarcinopsis’, Chlorochytrium, Spongiosarcinopsis gen.nov., Protosiphon, Chlorosphaeropsis и Spongiochloris.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ
Chlorochytrium (рис. Клетки одиночные, в диадах, пакетах и коротких неправильных нитях, шаровидные и удлиненно-эллипсоидные. Оболочка гладкая, с возрастом утолщается до 15 мкм и приобретает слоистость. Хлоропласт 1, в молодых клетках пристенный чашевидный, в зрелых – центральный сетчатый. Ядро 1. Пиреноид 1 или несколько с прерывистой крахмальной обверткой. Размножение десмосхизисом, зооспорами и апланоспорами, половой процесс – изогамия. Зооспоры без оболочки, с 2 равными жгутиками, передней или средней стигмой. Покоящаяся стадия – акинеты. Эндофиты водных сосудистых растений, мхов или макроскопических водорослей, 1 вид – свободноживущий (C. hypanicus). Представители: C. lemnae Cohn и C. hypanicus Kostikov, Demchenko, Boyko et Gontcharov.
Chlorosphaeropsis (рис. 2, j) Клетки одиночные или в комплексах различной величины и формы. Одиночные клетки шаровидные, перед началом десмосхизиса удлиненно-эллипсоидные. Оболочка гладкая, способна утолщаться до 1-2 мкм. Хлоропласт 1, центральный сетчатый. Ядра многочисленные. Пиреноид 1, дольчатый в стареющих клетках. Размножение десмосхизисом и зооспорами. Зооспоры без оболочки, с 2 равными жгутиками и передней стигмой. Способны к синтезу вторичных каротиноидов. Представители: C. alveolata Herndon.
‘Chlorosarcinopsis’ (рис. 2, o) Клетки одиночные или в плоских или трехмерных клеточных комплексах из 2-8 клеток. Одиночные клетки шаровидные, комплексы неправильной формы. Оболочка тонкая, без слизи. Хлоропласт 1, пристенный полый шаровидный с отверстием. Ядро 1. Пиреноид 1. Размножение десмосхизисом, зооспорами, половой процесс – изогамия. Зооспоры без оболочки, с 2 равными жгутиками и передней стигмой. Способны к синтезу вторичных каротиноидов. Представители: C. aggregata Arce et Bold, C. dissociata Herndon, С. bastropiensis Groover et Bold.
Pachycladella (рис. 2, n) Клетки одиночные шаровидные до слегка четырехугольных с четырьмя (или более) крестообразно или тетраэдрически расположенными трубчатыми или коническими отростками. Хлоропласт 1, пристенный чашевидный. Ядро 1. Пиреноид 1. Размножение зооспорами без оболочки. Представители: P. umbrina (Smith) Silva.
Protosiphon (рис. 2, i) Клетки одиночные, округлые, овальные или неправильно продолговатые, способные формировать длинные трубчатые выросты. Хлоропласт 1, центральный сетчатый. Ядра и пиреноиды многочисленные. Размножение делением, почкованием, зооспорами, половой процесс – изогамия, зигота звездообразной формы. Зооспоры без оболочки, с 2 равными жгутиками. Покоящаяся стадия – гипноспоры. Способны к синтезу вторичных каротиноидов. Представители: P. botryoides (Kützing) Klebs.
Spongiochloris (рис. 2, k) Клетки одиночные шаровидные или во временных скоплениях. Оболочка гладкая, с возрастом утолщается до 10 мкм и приобретает слоистость. Хлоропласт 1, центральный сетчатый. Ядра многочисленные. Пиреноид 1, с фрагментирующейся обверткой у зрелых клеток. Размножение зооспорами и апланоспорами. Зооспоры без оболочки, с 2 равными жгутиками и передней стигмой. Способны к синтезу вторичных каротиноидов. Представители: S. spongiosa (Vischer) Starr.
Семейство Protosiphonaceae Genus nov. (рис. Клетки одиночные, в диадах, тетрадах и более сложных комплексах, образующихся путем десмосхизиса. Одиночные клетки шаровидные и эллипсовидные. Оболочка гладкая, с возрастом утолщается до 5 мкм и приобретает слоистость. Хлоропласт 1, в молодых клетках – пристенный, в зрелых – центральный губчатый, грубеющий с возрастом культуры. Ядро 1. В молодых клетках пиреноид 1 с крахмальной обверткой из нескольких скорлупок, с возрастом фрагментируется, распадаясь на несколько (до 5) частей. Размножение десмосхизисом, зооспорами и апланоспорами. Зооспоры без оболочки, с 2 равными жгутиками и передней стигмой. Покоящаяся стадия – акинеты. Способны к синтезу вторичных каротиноидов. и двужгутиковыми зооспорами без оболочки (Temraleeva et al., unpubl.). В ближайшее время данный таксон будет описан как новый род с типовым видом, для которого предлагается название S. terrestris Temraleeva, Mincheva, Bukin, Sherbakov, Pinsky.
В настоящее время молекулярно-генетические методы обеспечивают бóльшую объективность, воспроизводимость и надежность идентификации живых объектов, благодаря чему набирают популярность и становятся обязательной частью при изучении биоразнообразия. Тем не менее, в практике большинства специалистов-альгологов микроскопия и определение водорослей на основе их морфологических характеристик является основным инструментом в работе. Поэтому разработка диагностических ключей разных групп микроводорослей на основе 18S рРНК-филогении с последующим выделением их диакритических морфологических, ультраструктурных, биохимических, экологических признаков является актуальным направлением в альгологии.
Рис. 2. Фотографии зеленых водорослей порядка Protosiphonales: (a) – Dunaliella tertiolecta CCAP 19/6B* (https://www.ccap.ac.uk/); (b) – Chlorogonium euchlorum CCAP 12/2C (Nozaki et al., 1998); (c) – Balticola zimbabwiensis UTEX 1758 (Buchheim et al., 2013); (d) – Stephanosphaera pluvialis UTEX 771 (Buchheim et al., 2013); (e) – Hamakko caudatus NIES 2293* (Nakada, Nozaki, 2009); (f) – Chlorococcum oleofaciens ACSSI 208* (http://acssi.org/); (g) – Macrochloris radiosa SAG 213-2a* (Holzinger et al., 2014); (h) – Chlamydopodium starrii ACSSI 268* (http://acssi.org/); (i) – Protosiphon botryoides UTEX B 2969 (Lewis, Trainor, 2012); (j) – Chlorosphaeropsis alveolata ACOI 2129 (http://acoi.ci.uc.pt/); (k) – Spongiochloris spongiosa SAG 280-2b* (Темралеева, неопубл.); (l) – Chlorochytrium lemnae CAUP H6903* (http://botany.natur.cuni.cz/algo/caup.html); (m) – Семейство Protosiphonaceae Genus nov. ACSSI 23* (Temraleeva et al., unpubl.); (n) – Pachycladella cf. zatoriensis (Fučíková, 2015); (o) – Chlorosarcinopsis dissociata ACSSI 211 (http://acssi.org/). Примечание. * – аутентичный штамм, b – основание жгутика, py - пиреноид, n – ядро, c – хлоропласт, черной стрелкой указан трубчатой вырост Protosiphon botryoides, белыми стрелками – ядра Macrochloris radiosa. Fig. 2. Micrographs of green microalgal strains of order Protosiphonales: (a) – Dunaliella tertiolecta CCAP 19/6B* (https://www.ccap.ac.uk/); (b) – Chlorogonium euchlorum CCAP 12/2C (Nozaki et al., 1998); (c) – Balticola zimbabwiensis UTEX 1758 (Buchheim et al., 2013); (d) – Stephanosphaera pluvialis UTEX 771 (Buchheim et al., 2013); (e) – Hamakko caudatus NIES 2293* (Nakada, Nozaki, 2009); (f) – Chlorococcum oleofaciens ACSSI 208* (http://acssi.org/); (g) – Macrochloris radiosa SAG 213-2a* (Holzinger et al., 2014); (h) – Chlamydopodium starrii ACSSI 268* (http://acssi.org/); (i) – Protosiphon botryoides UTEX B 2969 (Lewis, Trainor, 2012); (j) – Chlorosphaeropsis alveolata ACOI 2129 (http://acoi.ci.uc.pt/); (k) – Spongiochloris spongiosa SAG 280-2b* (Temraleeva, unpubl.); (l) – Chlorochytrium lemnae CAUP H6903* (http://botany.natur.cuni.cz/algo/caup.html); (m) – Семейство Protosiphonaceae Genus nov. ACSSI 23* (Temraleeva et al., unpubl.); (n) – Pachycladella cf. zatoriensis (Fučíková, 2015); (o) – Chlorosarcinopsis dissociata ACSSI 211 (http://acssi.org/). Note. * – authentic strain, b – flagellar base, py - pyrenoid, n – nucleus, c – chloroplast, black arrow is marking tubular extension of Protosiphon botryoides, white arrows – multiple nuclei of Macrochloris radiosa.
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 15-54-04002 бел_мол_а.
Список литературы 1. Андреева В.М. Почвенные и аэрофильные зеленые водоросли (Chlorophyta: Tetrasporales, Chlorococcales, Chlorosarcinales). – СПб, 1998. – 351 с. 2. Виноградова К.Л., Голлербах М.М., Зауер Л.М., Сдобникова Н.В. Определитель пресноводных водорослей СССР. 13. Зеленые, красные и бурые водоросли. - Л.: Наука, 1980. – 248 с. 3. Костиков И.Ю., Демченко Э.Н., Бойко В.Р., Гончаров А.А. Chlorochytrium hypanicus sp. nov. (Chlorophyceae) и его место в системе Protosiphonales // Альгология. 2012. Т.22, №3. С. 227–251. 4. Темралеева А.Д., Москаленко С.В., Бачура Ю.М. Морфология, экология и 18S-филогения зеленых микроводорослей порядка Protosiphonales (Chlorophyta) // Микробиология. 2017. № 2 (в печати). 5. Archibald P. Descriptions of new edaphic and aquatic species of Chlorococcum Meneghini (Chlorococcales) // British Phycological Journal. 1979. V.14, iss.4. P. 305–312. 6. Borowitzka M.J., Siva C.J. The taxonomy of the genus Dunaliella (Chlorophyta, Dunaliellales) with emphasis on the marine and halophilic species // J. Appl. Phycology. 2007. V.19, iss.5. P. 567–590. 7. Buchheim M.A., Sutherland D.M., Buchheim J.A., Wolf M. The blood alga: phylogeny of Haemotococcus (Chlorophyceae) inferred from ribosomal RNA gene sequence data // Eur. J. Phycol. 2013. V. 48, №3. P. 318–329. 8. Ettl H., Komárek J. Was versteht man unter dem Begriff «coccale Grünalgen»? // Algol. Stud. 1982. №29. P. 345–347. 9. Fučíková K. A new record of the rare alga Pachycladella P.C. Silva (Chlorophyceae) in 10. Holzinger A., Dablander A., Gärtner G. Investigating of cell morphology and reproduction in Macrochloris radiosa Ettl & Gärtner (Stephanosphaerinia, Chlorophyta) by light- and transmission electron microscopy // Algol. Stud. 2014. V.144. P. 95–104. 11. Kawasaki Y., Nakada T., Tomita M. Taxonomic revision of oil-producing green algae, Chlorococcum oleofaciens (Volvocales, Chlorophyceae) and its relatives // Journal of Phycology. 2015. V.51, iss.5. P. 1000–1016. 12. Костiков I.Ю., Романенко П.О., Демченко Е.М. Дарiенко Т.М., Михайлюк T.I., Рибчинский О.В., Солоненко А.М. Водоростi грунтiв України (iсторiя та методи дослiдження, система, конспект флори). – Kиїв, 2001. – 300 c. 13. Lewis L.A., Trainor F.R. Survival of Protosiphon botryoides (Chlorophyceae, Chlorophyta) from a Connecticut soil dried out for 43 years // Phycologia. 2012. V.51, iss.6. P. 662–665. 14. Nakada T., Misawa K., Nozaki H. Molecular systematics of Volvocales (Chlorophyceae, Chlorophyta) based on exhaustive 18S rRNA phylogenetic analyses // Mol. Phylog. Evol. 2008. V.48, iss.1. P. 281–291. 15. Nakada T., Nozaki H. Taxonomic study of two new genera of fusiform green flagellates, Tabris gen. nov. and Hamakko gen. nov. (Volvocales, Chlorophyceae) // J. Phycol. 2009. V.45, iss.2. P. 482–492. 16. Nozaki H., Ohta N., Morita E., Watanabe M.M. Toward a natural system of species in Chlorogonium (Volvocales, Chlorophyta): A combined analysis of morphological and rbcL gene sequence data // Journal of Phycology. 1998. V.34, iss.6. P. 1024–1037. 17. Nozaki H., Watanabe M.M., Aizawa K. Morphology and paedogamous sexual reproduction in Chlorogonium capillatum sp. nov. (Volvocales, Chlorophyta) // Journal of Phycology. 1995. V.31, iss.4. P. 655–663. 18. Pocock M.A. Haematococcus in southern 19. The Freshwater Algal Flora of the British Isles: An Identification Guide to Freshwater and Terrestrial Algae // John D.M., Whitton B.A., Brook A.J. (ed.) – Статья поступила в редакцию 13.12.2016
The Identification Key of Green Microalgal Order Protosiphonales (Chlorophyceae, Chlorophyta) Anna D. Temraleeva, Svetlana V. Moskalenko Modern system of green microalgal order Protosiphonales (Chlorophyceae, Chlorophyta) based on morphology, ecology and 18S rRNA-phylogeny is described in this paper. The identification key for families and genera of the order, their descriptions with illustrations are given. Species of the taxa are listed. Chlorophyta) Key words: green microalgae; identification key; morphology; ecology; molecular phylogeny.
Об авторах Темралеева Анна Дисенгалиевна - Temraleeva Anna D. кандидат биологических наук
Москаленко Светлана Валентиновна - Moskalenko Svetlana Valentinovna научный сотрудник Института физико-химических и биологических проблем почвоведения РАН, Пущино, Россия, (Institute of Physicochemical and Biological Problems in Soil Science of Russian Academy of Sciences, Russian Federation, Pushchino), лаборатория физико-химии почв
Корреспондентский адрес: Россия, 142290, Московская область, г. Пущино, ул. Институтская, д. 2, ИФХиБПП РАН; телефон: 8(4967)31-81-52.
ССЫЛКА НА СТАТЬЮ: Темралеева А.Д., Москаленко С.В. Диагностический ключ для определения зеленых микроводорослей порядка Protosiphonales (Chlorophyceae, Chlorophyta) // Вопросы современной альгологии. 2017. № 1 (13). URL: http://algology.ru/1082 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮК разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||