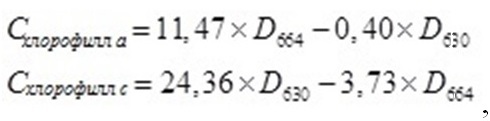|
|
|
|
V Сабининские чтения 29 ноября 2016 - 29 января 2017 Лаг-период культуры Phaeodactylum tricornutum Bohlin при переходе на гетеротрофный тип питания
Тренкеншу Р.П., Жондарева Я.Д. Rudolf P. Trenkenshu, Yana D. Zhondareva
Институт морских биологических исследований имени А.О. Ковалевского (г. Севастополь)
УДК 582.232:581.13
Исследованы кинетические характеристики роста культуры Phaeodactylum tricornutum при гетеротрофном питании на среде с глицерином в качестве углеродного и энергетического субстрата. Выявлен длительный лаг-период (4 суток) культуры к возобновлению роста в темноте после выращивания инокулята фотоавтотрофным методом. Культура достигла максимальной плотности 4 г/л на 10-е сутки выращивания со скоростью роста 0,5 г/л в сутки. Ключевые слова: Phaeodactylum tricornutum; гетеротрофное питание; глицерин; органический углерод; лаг-период.
Введение Микроводоросли являются ценным источником полиненасыщенных жирных кислот, незаменимых аминокислот, пигментов, благодаря чему спрос на их использование в качестве пищевых и кормовых добавок в промышленных странах увеличивается (Borowitzka, Borowitzka, 1988). Как и все живые организмы, они нуждаются в энергии для поддержания своей жизнедеятельности и углероде для построения своей биомассы. Увеличение потока воздуха в культуре фотосинтезирующих организмов позволяет повысить скорость роста и добиться увеличения максимальной биомассы. Это не наблюдается при ограничении культуры микроводорослей потоком углерода в клетки (Лелеков, Тренкеншу, 2007). При добавлении источника углерода в органической форме также увеличивается скорость роста и плотность культуры. Удельная скорость роста культуры микроводорослей при миксотрофном питании приблизительно равна сумме скоростей роста при фотоавтотрофных и гетеротрофных условиях (Richmond, 1992). Ceron-Garcia et al. (2006) показали положительный опыт миксотрофного культивирования Phaeodactylum tricornutum на среде с глицерином, достигнув максимальной плотности 7,04 г/л. Таким образом, несмотря на то, что большинство микроводорослей являются облигатными фотосинтезирующими организмами, в определенных условиях они способны достаточно легко переключаться на миксотрофный и гетеротрофный тип питания. Однако в предварительных экспериментах с Phaeodactylum tricornutum и Tetraselmis viridis нами была обнаружена длительная фаза перехода к возобновлению роста культуры микроводорослей при использовании органического субстрата. Переход сопровождался уменьшением плотности культуры. При этом продолжительность адаптации составляла около 4 суток (Жондарева, 2016; Жондарева, Тренкеншу, 2016). При длительной адаптации к гетеротрофному и миксотрофному типу питания у клеток микроводорослей как фотосинтезирующих организмов происходит формирование транспортных систем, необходимых для поглощения экзогенных органических веществ (Тренкеншу, Жондарева, 2016). Фаза адаптации зависит от штамма микроводорослей, конфигурации фотобиореактора и окружающих условий роста. Литературные данные свидетельствуют о том, что деление клеток Platymonas subcordiformis наблюдалось уже после 2-дневного лаг-периода при добавлении в среду глюкозы как органического источника, но при использовании этого же субстрата цианобактерией Nostoc linckia скорость роста увеличивалась только через 4 суток (Sanders et al., 1990; Xie et al., 2001). Усвоение органических веществ красной водорослью Galdieria sulphuraria происходит после адаптационного периода продолжительностью 45 суток (Gross et al., 1995). Однако существуют экспериментальные исследования по накоплению меченной радиоактивным углеродом глюкозы Neochloris oleoabundans, показывающие, что переход на гетеротрофный рост происходит за время менее одного часа (Morales-Sánchez et al., 2013). Данные, касающиеся адаптивного периода у Phaeodactylum tricornutum при переходе на гетеротрофный тип питания, не найдены. Поэтому в связи с эпизодичностью и разнородностью литературных данных и результатами собственных экспериментов по продолжительности адаптации к усвоению клетками органических источников углерода и энергии, целью работы являлось изучение длительности адаптационного лаг-периода накопительной культуры Phaeodactylum tricornutum при переходе на гетеротрофный тип питания после выращивания инокулята фотоавтотрофным методом. В этой работе мы использовали диатомовые морские микроводоросли Phaeodactylum tricornutum Bohlin в качестве представителя водорослей, используемых для производства пищевых добавок и живого корма в аквакультуре, чтобы изучить возможность использования органического источника углерода в среде для увеличения скорости роста и продуктивности в условиях темноты.
Материалы и методы В качестве объекта исследования был выбран штамм альгологически чистой культуры морской диатомовой водоросли Phaeodactylum tricornutum Bohlin, полученный из коллекции культур микроводорослей Института морских биологических исследований им. А.О. Ковалевского. Это вид представляет интерес как модельный объект с хорошо изученным фотоавтотрофным типом питания. Микроводоросли культивировали накопительным методом на питательной среде, специально разработанной для данного вида (Тренкеншу, 1984; Тренкеншу, 2005) на унифицированной установке в стеклянном фотобиореакторе плоскопараллельного типа объёмом 1 л с толщиной слоя культуры 2 см (Тренкеншу и др., 2009). Этот объем поддерживали на протяжении всего эксперимента, доливая перед отбором проб для проведения измерений дистиллированную воду до отметки 1 л, чтобы компенсировать испарение. Температуру стабилизировали на уровне 20°С. Микроводоросли культивировали при полном отсутствии как естественного, так и искусственного освещения. В процессе выращивания культуру непрерывно барботировали воздухом. В качестве органического источника углерода и энергии использовали глицерин в концентрации 5,575 г/л, рассчитанной исходя из потребностей микроводорослей в углероде. Это количество обеспечивало концентрацию около 2 г/л углерода в культуре. В процессе культивирования осуществляли ежесуточный контроль прироста культуры микроводорослей. Плотность культуры определяли объемно-весовым методом, суть которого заключалась в осаждении клеток центрифугированием при 3000 об/мин в течение 10 минут и сепарировании водорослевой биомассы от бактериальной с дальнейшей оценкой прироста плотности культуры микроводорослей. Аппроксимированием линейной фазы роста определили максимальную продуктивность культуры микроводорослей (Тренкеншу, 2005):
где B – биомасса, мг·л -1; Pm – максимальная продуктивность, мг·л -1·сут -1; t – время, сут.; B0 – биомасса в начале линейной фазы роста, т.е. при t = t0. Пигменты экстрагировали 90%-ным ацетоном. Расчет количества хлорофиллов a, с производили после спектрофотометрирования (СФ-2000) по описанным в литературе формулам (Jeffrey, Humphrey, 1975; Jeffrey, Welschmeyer, 1997):
где D – оптическая плотность пигментной вытяжки, ед. опт. пл.
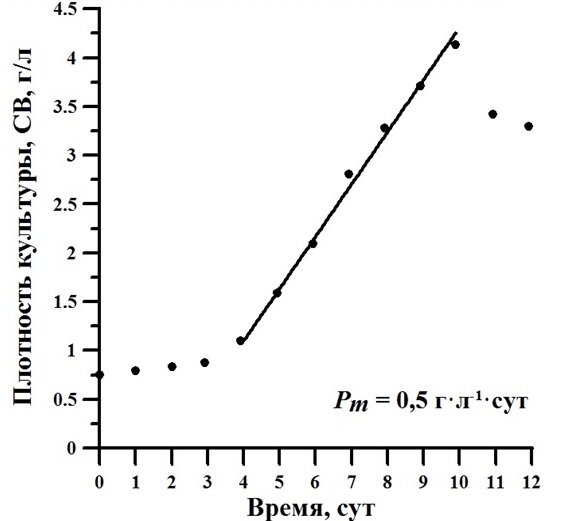
Результаты и обсуждение Несмотря на то, что имеются литературные данные (Ceron-Garcia et al., 2006; Liu et al., 2009) о том, что Phaeodactylum tricornutum не растет в гетеротрофных условиях с органическим углеродом в среде, плотность выращиваемой нами культуры P. tricornutum начала линейно расти с 4-х суток накопительного культивирования, указывая на то, что фотоавтотрофные организмы начали использовать углеродный и энергетический субстрат органического происхождения для своего роста (рис. 1).
Рис. 1. Динамика накопительного роста Phaeodactylum tricornutum при гетеротрофном культивировании с подачей глицерина как углеродного и энергетического субстрата. Fig. 1. The dynamics of the cumulative growth of Phaeodactylum tricornutum under the heterotrophic culture with feeding glycerol as a carbon and energy substrate.
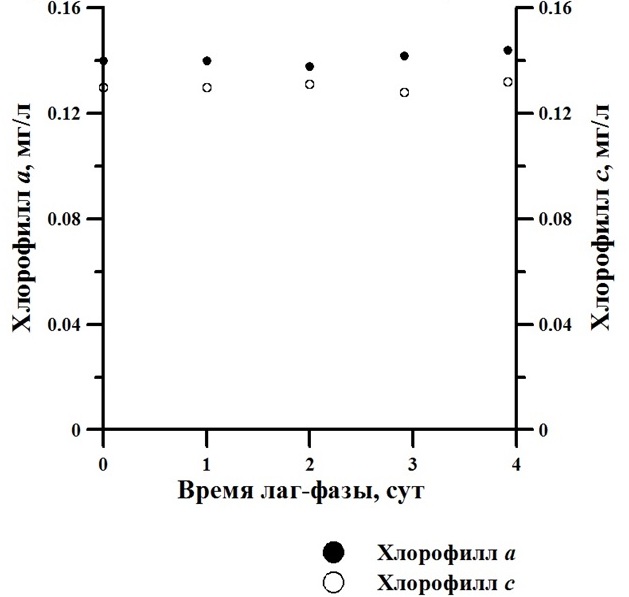
Аппроксимируя линейный участок на накопительной кривой роста, получили максимальную продуктивность культуры, которая составила 0,5 г сухого веса на 1 л в сутки с достижением максимальной плотности около 4 г/л на 10-е сутки культивирования (рис. 1). На протяжении опыта отмечалась продолжительная адаптация клеток микроводорослей к метаболизации органического вещества в условиях абсолютной темноты, составившая 4 суток. Таким образом, можно рассуждать, что этого времени (4 суток) достаточно для синтеза в клетке так называемых «белков-переносчиков», так как молекулы экзогенного органического вещества самостоятельно через мембрану не могут проходить, и создания метаболических систем для поглощения клеткой органического углерода. Согласно современным представлениям, микроводоросли используют так называемый трансмембранный симпорт глюкозы для транспортировки этого вещества в клетку. Следовательно, в период адаптации вся энергия затрачивается на создание этих транспортных систем (Тренкеншу, Жондарева, 2016). Также в течение опыта в условиях темнового культивирования наблюдалось определенное ингибирование синтеза пигментов. В темноте на протяжении 4-дневной адаптации культуры не происходило накопления пигментов (рис. 2).
Рис. 2. Динамика содержания пигментов в гетеротрофной культуре Phaeodactylum tricornutum, находящейся в фазе адаптационного периода. Fig. 2. The dynamics of the pigment content in the heterotrophic culture of Phaeodactylum tricornutum, located in the phase of an adaptation period.
На основании рис. 2 можно предположить, что отсутствие роста культуры в течение 4 суток в темновых условиях с подачей органического источника углерода и энергии при сохранении пигментной системы позволяет микроорганизмам сохранять свою жизнедеятельность, что, очевидно, является, приспособлением к новым для них условиям питания.
Заключение В ходе проведенного экспериментального исследования было показано, что нельзя отрицать способность культуры Phaeodactylum tricornutum к гетеротрофному питанию. Клеткам был необходим длительный адаптационный период для перестройки своего метаболизма при смене типов питания. В нашем случае глицерин как органический источник углерода и энергии положительно начал влиять только после 4-дневного лаг-периода, и культура достигла максимальной плотности 4 г/л на 10-е сутки выращивания с линейной скоростью роста 0,5 г/л в сутки. Полученные результаты позволили нам сделать заключение, что способность к возобновлению скорости роста при гетеротрофном питании зависит от частных особенностей метаболизма клеток и скорости формирования транспортных систем для поглощения экзогенного органического вещества. Исследованный нами вид водорослей Phaeodactylum tricornutum Bohlin способен к гетеротрофному росту с использованием углеродных и энергетических субстратов органического происхождения.
Список литературы 1. Жондарева Я.Д. Миксотрофный рост Phaeodactylum tricornutum на неорганической среде с глюкозой и глицерином в накопительной культуре // Морские биологические исследования: достижения и перспективы: в 3-х т.: сборник материалов Всероссийской научно-практической конференции с международным участием, приуроченной к 145-летию Севастопольской биологической станции (Севастополь, 19-24 сентября 2016 г.) – Т. 3. – Севастополь: ЭКОСИ-Гидрофизика, 2016. – С. 378–382. 2. Жондарева Я.Д., Тренкеншу Р.П. Фотоавтотрофный и миксотрофный рост Tetraselmis viridis в накопительной культуре // Актуальные вопросы биологической физики и химии: материалы XI Междунар. конф. (Севастополь, 2016). Т. 2. – Севастополь, 2016. – С. 106–109. 3. Лелеков А.С., Тренкеншу Р.П. Простейшие модели роста. 4. Экспоненциальная и линейная фазы роста // Экология моря. 2007. Вып.74. С. 47–49. 4. Тренкеншу Р.П. Простейшие модели роста микроводорослей. 1. Периодическая культура // Экология моря. 2005. Вып. 67. С. 89–97. 5. Тренкеншу Р.П. Ростовые и фотоэнергетические характеристики морских микроводорослей в плотной культуре: автореф. дисс. канд. биол. наук – Красноярск, 1984. – 28 с. 6. Тренкеншу Р.П., Боровков А.Б., Лелеков А.С. Унифицированная лабораторная установка для исследования низших фототрофов. – Севастополь: Изд-во ИнБЮМ НАНУ, 2009. – 40 с. 7. Тренкеншу Р.П., Жондарева Я.Д. Кинетика симпорта органических форм биогенов у микроводорослей // Морские биологические исследования: достижения и перспективы :в 3-х т.: сборник материалов Всероссийской научно-практической конференции с международным участием, приуроченной к 145-летию Севастопольской биологической станции (Севастополь, 19-24 сентября 2016 г.). . Т. 3. – Севастополь: ЭКОСИ-Гидрофизика, 2016. – С. 452–455. 8. Borowitzka M.A., Borowitzka L.J. Vitamins and fine chemicals from micro-algae // Microalgal biotechnology. 1988. P. 153-196. 9. Ceron-García M.C., García-Camacho F.G, Miron A.S., Sevilla J.M.F., Chisti Y., Grima E.M. Mixotrophic production of marine microalga Phaeodactylum tricornutum on various carbon sources // J. Microbiol. Biotechnol. 2006. 16(5). Р. 689–694. – https://www.researchgate.net/ publication/275407674_Mixotrophic_ production_of_marine_microalga_Phaeodactylum_tricornutum_ on_various_carbon_sources 10. Gross W., Schnarrenberger C. Heterotrophic Growth of Two Strains of the Acidothermophilic Red Alga Galdieria sulphuraria // Plant Cell Physiol. 1995. V.36. P. 633–638. 11. Jeffrey S.W., Humphrey, G.F. New spectrophotometric equations for determining chlorophylla, b, c 1 and c 2 in higher plants, algae and natural phytoplankton. // Biochem. Physiol. Pflanz. 1975. 167. P. 191–194. 12. Jeffrey S.W., Welschmeyer N.A. Spectrophotometric and fluorometric equations in common use in oceanography // Jeffrey, S.W., Mantoura, R.F.C., Wright, S.W. (eds.). Phytoplankton Pigments in Oceanography: Guidelines to Modern Methods. – 1997. – P. 597–621. 13. Liu X., Duan Sh., Li A., Xu N., Cai Zh., Hu Zh. Effects of organic carbon sources on growth, photosynthesis, and respiration of Phaeodactylum tricornutum // J. Appl. Phycol. 2009. 21. P. 239–246. 14. Morales-Sanchez D, Tinoco-Valencia R, Kyndt J, Martinez A. Heterotrophic growth of Neochloris oleoabundans using glucose as a carbon source // Biotechnol Biofuels. 2013. 6(1). P. 100. 15. Richmond A. Mass culture of cyanobacterium // Man N.H. & Carr N.G. (eds). Photosynthetic Prokaryotes. – London: Plenum Press, 1992. – 275 pp. 16. Sanders R.W., Porter K. G., Caron D.A. Relationship between phototrophy and phagotrophy in the mixotrophic chrysophyte Poterioochromonas malhamensis // Microb. Ecol. 1990. V.19. P. 97–109. 17. Xie J., Zhang Y., Li Y., Wang Y. Mixotrophic cultivation of Platymonas subcordiformis // J. Appl. Phycol. 2001. Vol.13. P. 343–347. Статья поступила в редакцию 21.12.2016
Lag-period of Phaeodactylum tricornutum Bohlin Rudolf P. Trenkenshu, Yana D. Zhondareva We studied the kinetic characteristics of Phaeodactylum tricornutum growth in the heterotrophic culture using the nutritional medium with the glycerol as the organic carbon and energy source. We revealed a long lag period (4 days) after the growth began in the dark conditions in the culture previously established by photoautotrophic method. The culture maximum density was 4 g/l on the 10th day of cultivation and growth rate was 0,5 g/l per day. Key words: Phaeodactylum tricornutum; heterotrophic nutrition; glycerol; organic carbon; lag period.
Об авторах Тренкеншу Рудольф Павлович – Trenkenshu Rudolf P. кандидат биологических наук r.trenkenshu@rambler.ru Жондарева Яна Дмитриевна – Zhondareva Yana D. младший научный сотрудник, Институт морских биологических исследований им. А.О.Ковалевского РАН (ФГБУН ИМБИ), г. Севастополь, Россия (Federal State Institution of Science «The A. O. Kovalevsky Institute of Marine Biological Research of RAS» IMBR, Sevastopol, Russia), Отдел биотехнологий и фиторесурсов. yana.zhondareva@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (8692)-54-41-10.
ССЫЛКА НА СТАТЬЮ: Тренкеншу Р.П., Жондарева Я.Д. Лаг-период культуры Phaeodactylum tricornutum Bohlin при переходе на гетеротрофный тип питания // Вопросы современной альгологии. 2017. № 1 (13). URL: http://algology.ru/1141 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||