|
|
|
Влияние условий культивирования на морфологию зеленых водорослей родов Tetracystis и Spongiococcum (на примере аутентичных штаммов коллекции ACSSI)
Москаленко С.В., Темралеева А.Д., Пинский Д.Л. Svetlana V. Moskalenko, Anna D. Temraleeva, David L. Pinsky
Институт физико-химических и биологических проблем почвоведения РАН (г. Пущино)
УДК 582.263+58.018
Для зеленых водорослей родов Tetracystis и Spongiococcum установлено влияние состава, плотности среды и длительности культивирования на тип хлоропласта и устойчивость клеточных комплексов. На основе наблюдения за морфологией S. tetrasporum и T. aplanospora высказано предположение об их близком родстве. По результатам исследования сделан вывод о необходимости разработки единого протокола культивирования во избежание ошибок в идентификации указанных таксонов зеленых водорослей. Дополнены диагнозы некоторых видов. Ключевые слова: зеленые водоросли; Tetracystis; Spongiococcum; морфологическая изменчивость; условия культивирования; ACSSI.
Введение Традиционная классификация семейства Tetracystidaceae (Chlorosarcinales, Chlorophyta) была основана на морфологических различиях в строении клеточных пакетов, хлоропласта, пиреноида и зооспор (Андреева, 1998). Диакритическими признаками рода Tetracystis являются способность формировать тетраэдрические комплексы клеток, наличие одного пристенного хлоропласта и двух изоконтных жгутиков. Внутри рода виды различаются по размеру вегетативных клеток и зооспор, толщине слизистой оболочки, особенностям хлоропласта, устойчивости клеточных комплексов и др. Род Spongiococcum, в отличие от Tetracystis, имеет центральный тип хлоропласта (Андреева, 1998). Однако фенотипические признаки могут быть нестабильными и весьма изменчивыми в зависимости от параметров окружающей среды и условий культивирования, как было показано для ряда зеленых (Margalef, 1955; Trainor, 1991; Trainor, Egan 1991; Luo et al., 2006, 2010; George et al., 2014), желто-зеленых (Гайсина, 2000; Сафиуллин, Бакиева, 2011), эустигматофитовых (Сафиуллина, 2009; 2011; Сафиуллина и др., 2009) и диатомовых (Айздайчер, 2013) водорослей, а также цианобактерий (Flechtner et al., 2002; Зарипова, 2009; Богачева, 2011; Темралеева, 2013). Тем не менее, морфологическая изменчивость зеленых водорослей не только в естественных местообитаниях, но и в условиях лабораторного эксперимента остается все еще слабо изученной, что создает значительные трудности при их таксономической идентификации и приводит к ошибочным диагнозам. Целью работы стало изучение влияния условий культивирования (состава и плотности питательной среды, длительности культивирования) на некоторые морфологические характеристики штаммов зеленых водорослей родов Tetracystis и Spongiococcum.
Материалы и методы Объектами исследования стали 6 штаммов зеленых водорослей рода Tetracystis [T. aplanospora (Arce et Bold) Brown et Bold ACSSI 225 (= SAG 91.80), T. illinoisensis Brown et Bold ACSSI 227 (= SAG 93.80), T. intermedia (Deason et Bold) Brown et Bold ACSSI 228 (= SAG 94.80), T. isobilateralis Brown et Bold ACSSI 229 (= SAG 95.80), T. pampae Brown et Bold ACSSI 230 (= SAG 96.80), T. vinatzeri Ettl et Gärtner ACSSI 233 (= SAG 22.95)) и 1 штамм рода Spongiococcum (S. tetrasporum Deason ACSSI 222 (= SAG 29.95)]. Все исследованные штаммы были получены из альгологической коллекции ACSSI (http://acssi.org) и являются аутентичными. Культуральные методы. Штаммы зеленых водорослей культивировали на твердых питательных средах Bristol и Bold 3N с содержанием агара 1 и 2% (Темралеева и др., 2014) при температуре +25°С, освещенности 2000 Лк и 12-часовом световом режиме. Микроскопия. Изучение морфологии культур проводили методами световой микроскопии (светлое поле) с помощью микроскопа Leica DM750 (Германия) через 3–4, 6–7 и 10 недель роста. Результаты наблюдений документированы фотографиями, снятыми с помощью цифровой камеры «Видеозавр» (Россия). Для таксономической идентификации проводили прижизненную цитохимическую реакцию на крахмал с помощью окрашивания раствором Люголя. При микроскопировании особое внимание обращали на структуру пакетов (диады, тетрады, многоклеточные пакеты), тип хлоропласта, наличие вторичных каротиноидов и запасных питательных веществ. Собственные наблюдения за морфологией штаммов сравнивали с описаниями тех же штаммов/видов у других авторов (Arce, Bold, 1958; Deason, 1959; Anderson, Nichols, 1968; Андреева, 1998; Massalski et al., 2001). Из литературы известно, что S. tetrasporum, T. aplanospora, T. pampae при первоописании и в дальнейших исследованиях культивировали на среде Bristol (Arce, Bold, 1958; Deason, 1959; Massalski et al., 2001).
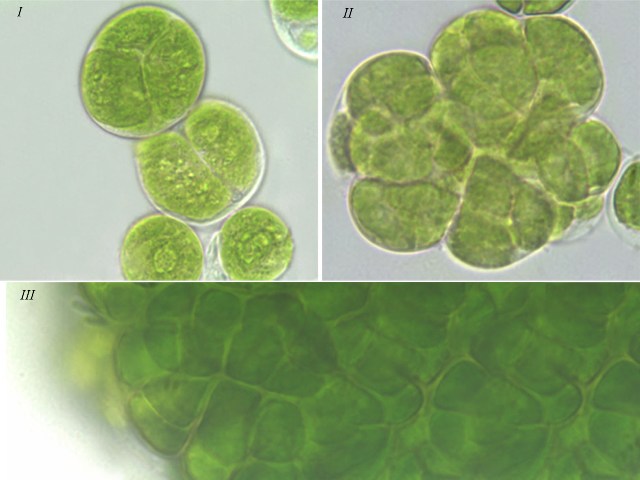
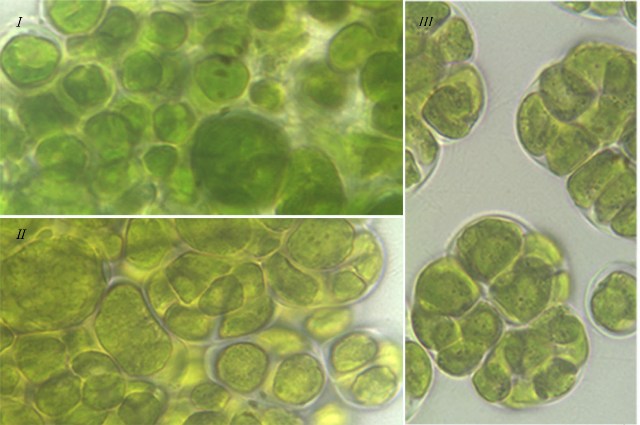
Результаты Клеточные комплексы. Согласно литературным данным, изученные виды зеленых водорослей характеризуются способностью к особому типу вегетативного деления – десмосхизису, в результате которого образуются различные клеточные комплексы: диады, тетрады, октады у T. aplanospora, T. illinoisensis, T. intermedia, а также сложные комплексы у T. isobilateralis, T. pampae, T. vinatzeri (Андреева, 1998). По нашим наблюдениям клеточные комплексы у изученных штаммов можно разделить на следующие типы (рис. 1): – одиночные клетки и малоклеточные пакеты (диады, тетрады, октады), которые отмечались у всех штаммов (рис. 1 I); – сложные комплексы, состоящие из нескольких тетрад, которые формировались у T. illinoisensis, T. intermedia (рис. 1 II), T. isobilateralis, T. pampae, T. vinatzeri; – многоклеточные пакеты, состоящие из множества нераспавшихся клеток, которые наблюдались у T. intermedia, T. isobilateralis, T. pampae, T. vinatzeri (рис. 1 III).
Рис. 1. Фотографии зеленых водорослей с различными клеточными комплексами: Fig 1. Micrographs of green algae with different cell complexes: I – single cell, few-celled packets (dyad, tetrad) of T. aplanospora ACSSI 222; II – complex comprised of tetrad of T. intermedia ACSSI 228; III – many-celled packets of T. vinatzeri ACSSI 233.
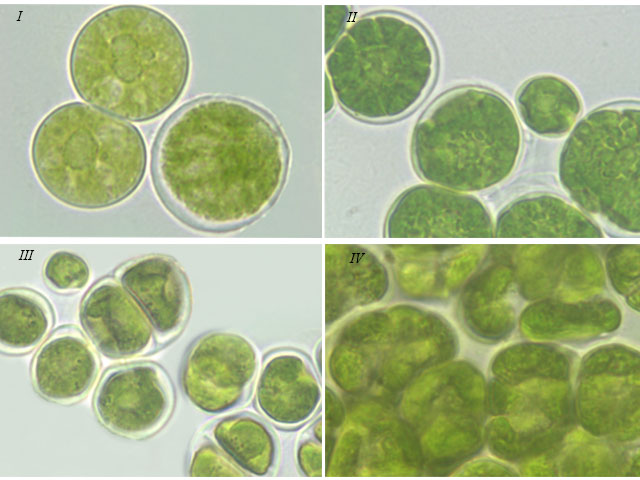
Тип хлоропласта. При исследовании морфологии штаммов мы наблюдали 2 типа хлоропластов: центральный, без полости, и пристенный, с полостью внутри. Среди первого типа выделяли следующие формы: – губчатый хлоропласт, который занимал всю полость клетки за исключением нескольких лакун – у штаммов S. tetrasporum (рис. 2 I) и T. aplanospora; – звездчатый хлоропласт с рассеченной поверхностью у штаммов S. tetrasporum (рис. 2 II), T. aplanospora, T. vinatzeri. – массивный, похожий на центральный хлоропласт – у T. pampae. Среди второго типа выделяли две формы хлоропласта: – полый шаровидный, с крупным или щелевидным отверстием, часто рассеченный с поверхности – у T. illinoisensis (рис. 2 III), T. intermedia, T. isobilateralis, T. pampae, T. vinatzeri; – чашевидный у T. isobilateralis и T. vinatzeri (рис. 2 IV). Зооспоры и молодые вегетативные клетки исследованных штаммов всегда имели пристенный тип хлоропласта.
Рис. 2. Фотографии зеленых водорослей с различными типами хлоропластов: Fig 2. Micrographs of green algae with different chloroplast types: I – central sponge-like chloroplast of S. tetrasporum ACSSI 222; II – central asterial chloroplast of S. tetrasporum ACSSI 222; III – parietal spherical chloroplast with opening of T. illinoisensi ACSSI 227; IV – parietal cup-shaped chloroplast of T. vinatzeri ACSSI 233.
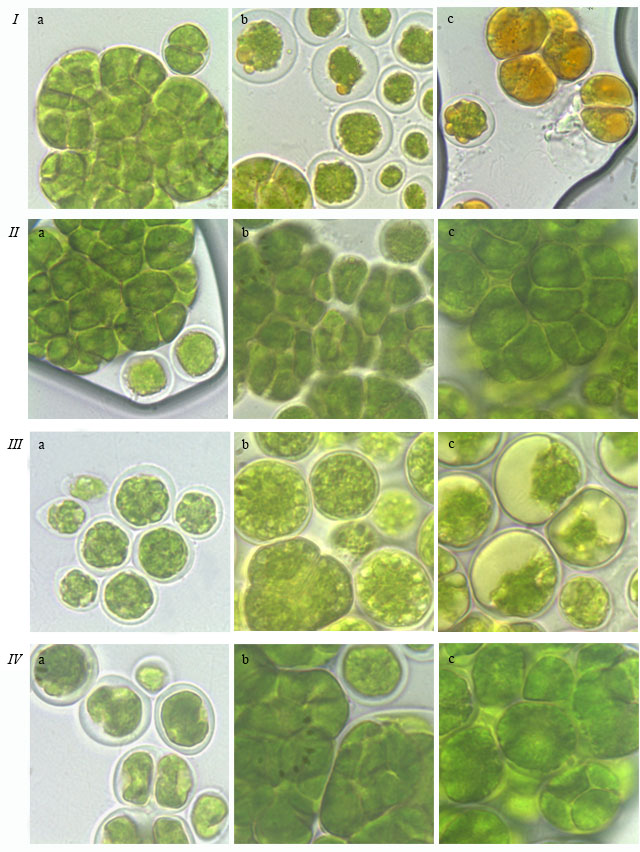
Наличие вторичных каротиноидов, липидов и крахмала. Вторичный каротиногенез – это адаптивная реакция одноклеточных экстремофильных и эврибионтных микроводорослей на действие неблагоприятных факторов внешней среды (дефицит питания, высокая освещенность, температура, соленость), заключающаяся в инициировании биосинтеза и массивном накоплении в липидных включениях цитоплазмы и хромопластов кетокаротиноидов группы астаксантина (Челебиева, 2014). Визуально наличие вторичных каротиноидов было отмечено по изменению цвета культуры с зеленого на оранжевый (рис. 3 Ic). Согласно первоописаниям этой способностью отличается водоросль T. intermedia, которая в трехмесячном возрасте приобретает светло-оранжевый цвет (Андреева, 1998). Изменение цвета данного штамма подтвердилось и в нашем исследовании – T. intermedia приобрел бурый оттенок уже к 6 неделе роста на среде Bristol (1%-ный агар). Кроме того, T. illinoisensis к 10 неделе роста на той же среде стал светло-коричневым, что не было отмечено ранее.
Рис. 3. Фотографии зеленых водорослей: T. intermedia ACSSI 228 (I, II) и T. pampae ACSSI 230 (III, IV), растущих на средах Bristol с 1%-ным агаром (I, III) и Bold 3N с 2%-ным агаром (II, IV), выполненные на 3–4 (a), 6–7 (b) и 10 (c) неделях культивирования. Fig. 3. Micrographs of green algae: T. intermedia ACSSI 228 (I, II) и T. pampae ACSSI 230 (III, IV), growing at Bristol media with 1% agar (I, III), growing at Bold 3N media with 2% agar (II, IV). Photos were taken at 3–4(a), 6–7 (b), 10 (c) week of culturation.
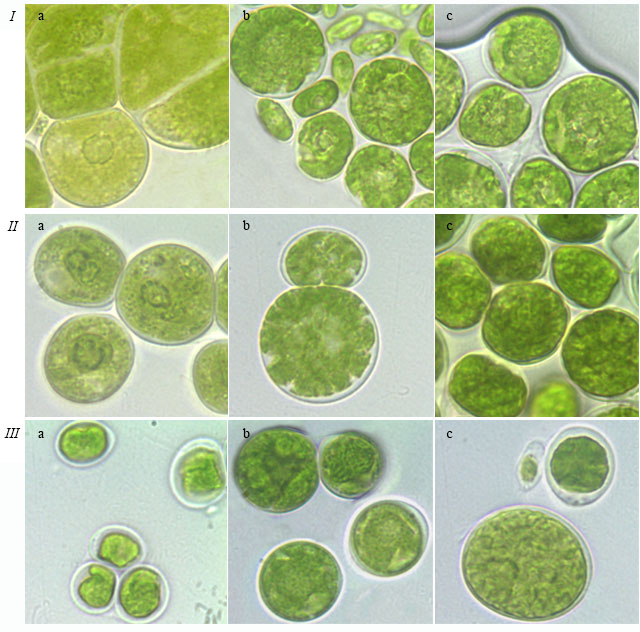
Обсуждение В ходе эксперимента было выявлено, что условия культивирования (состав и плотность питательной среды, продолжительность культивирования) влияют на все перечисленные выше морфологические признаки. Состав питательной среды. В эксперименте были использованы традиционные среды для выращивания зеленых водорослей Bristol и Bold 3N. Среда Bold 3N является более богатой питательной средой по сравнению со средой Bristol, т.к. в ней содержится тройная концентрация азота, раствор витамина B12 и почвенная вытяжка (Темралеева и др., 2014). На более богатой питательной среде Bold 3N наблюдалось образование сложных комплексов и многоклеточных пакетов у T. isobilateralis на 10 неделе роста и T. intermedia в течение всего периода роста, в то время как на среде Bristol у этих же штаммов отмечались одиночные клетки и малоклеточные пакеты (табл. 1). Ранее в литературе была описана способность данных штаммов образовывать комплексы, состоящие из нескольких тетрад (реже октад) (Андреева, 1998). В трех-четырехнедельном возрасте клетки штаммов T. pampae и T. vinatzeri, растущих на питательной среде Bold 3N с разной плотностью, а также на 2%-ной среде Bristol, имели пристенный шаровидный хлоропласт с щелевидным отверстием или без него, в то время как на 1%-ной среде Bristol центральный, звездчатый хлоропласт был отмечен у T. vinatzeri и массивный, похожий на центральный – у T. pampae (табл. 2). Таким образом, морфотип хлоропласта зависит от состава и плотность культуральной среды. В литературе хлоропласт данных штаммов описывается как массивный, а для T. vinatzeri – массивный от сплошного с очень толстым основанием до звездчато-рассеченного (Андреева, 1998). Кроме того, было установлено, что разрушение хлоропласта, запасание крахмала и липидов, лизис клеток у T. illinoisensis, T. intermedia и T. pampae происходит быстрее на более бедной 1%-ной среде Bristol, чем на Bold 3N (табл. 3, рис. 3). Напротив, T. vinatzeri стареет быстрее на среде Bold 3N, чем на Bristol. Таким образом, на скорость старения культур влияет как и состав, так и плотность питательной среды (табл. 2). Уже на 3–4 неделе культивирования у T. illinoisensis и T. intermedia на 1%-ной среде Bristol отмечается накопление липидов. К 6–7 неделе роста полость клеток T. intermedia заполняют крупные окрашенные липидные включения (рис. 3 Ib), а у T. illinoisensis в возрасте 10 недель, что придает «штриху» на чашке Петри коричневатый цвет. Несколько иначе происходит старение T. pampae (рис. 3 III): в возрасте 3–4 недель хлоропласт у штамма массивный/центральный, бугристый; к 6–7 неделе приобретает неровную, сильно бугристую поверхность; к 10 неделе культивирования хлоропласт разрушается и всю полость клетки занимают крупные бесцветные липидные капли. У T. vinatzeri на более питательной среде Bold 3N (с 1%-ным и 2%-ным содержанием агара) отмечено быстрое старение: к 6–7 неделе тип хлоропласта было сложно определить из-за большого количества крахмальных зерен и липидных капель желтоватого цвета. Плотность питательной среды. По результатам эксперимента было установлено влияние плотности питательной среды на структуру пакетов изученных штаммов зеленых водорослей. Так, у штамма T. intermedia на более плотной питательной среде Bristol после 3–4 недель культивирования наблюдалось образование массивных многоклеточных пакетов, а к 6–7 неделе происходило их разрушение на более простые комплексы, состоящие из тетрад (табл. 1). От плотности среды зависела и морфология хлоропласта. Вегетативные клетки штамма T. vinatzeri в возрасте 3–7 недель имели центральный хлоропласт на менее агаризованной среде Bristol, в то время как на той же среде, но с 2%-ным содержанием агара в возрасте 3–4 недель – пристенный шаровидный, а в 6–7 недель – пристенный шаровидный или чашевидный, рассеченный с поверхности (табл. 2). Хлоропласт штамма T. pampae на более плотных средах Bristol и Bold 3N при продолжительности культивирования до 7 недель характеризовался как пристенный шаровидный с щелевидным отверстием или без, рассеченный с поверхности, в то время как на 1%-ной среде Bristol – хлоропласт занимал всю полость клетки, выглядел массивным и был похож на центральный (рис. 3 Ia). В литературе хлоропласт данного штамма описывается как массивный с несколькими щелями (Андреева, 1998) или одинокий с радиальными «звездообразными» расширениями, содержащими зерна крахмала и широкие периферические выпячивания (Massalski et al., 2001). Длительность культивирования. Все изученные штаммы зеленых водорослей по ответной реакции формирования клеточных комплексов на длительность культивирования можно разделить на две группы: 1. Штаммы, у которых происходит распад многоклеточных пакетов или сложных комплексов с возрастом культуры: – T. intermedia на среде Bristol с разным содержанием агара; – T. vinatzeri на обеих средах с разным содержанием агара. При этом на 1%-ной среде Bristol уже на 6–7 неделе роста в культуре встречаются одиночные клетки и малоклеточные пакеты. 2. Штаммы, у которых по мере старения формируются сложные клеточные комплексы и многоклеточные пакеты: – T. isobilateralis на среде Bold 3N с разным содержанием агара; – T. pampae на среде Bristol с разным содержанием агара. Кроме того, установлено изменение морфологии хлоропласта в зависимости от возраста штаммов зеленых водорослей. Так, на 3–4 неделе культивирования хлоропласт зрелых клеток S. tetrasporum и T. aplanospora относился к центральному губчатому. По мере старения клеток (к 6–7 неделе) происходило постепенное заполнение всех полостей внутри хлоропласта и сильное растрескивание его поверхности, в результате чего образовывался центральный звездчатый хлоропласт (табл. 2, рис. 4 I, II). Еще одним примером является культура T. pampae на среде Bold 3N с разным содержанием агара и 2%-ной среде Bristol: изначально пристенный хлоропласт у молодых вегетативных клеток заполняет всю полость клетки, к 10 неделе становится массивным и похожим на центральный (табл. 2, рис. 4 III). Для членов рода Tetracystis центральный хлоропласт является нетипичным и, вероятно, может служить основанием для переоценки таксономического веса данного признака при разделении родов Tetracystis и Spongiococcum, а также для переклассификации видов.
Рис. 4. Фотографии зеленых водорослей: (I) S. tetrasporum ACSSI 222 на среде Bristol, (II) T. aplanospora ACSSI 225 на среде Bristol и (III) T. pampae ACSSI 230 на среде Bold 3N, выполненные на: a – 3–4 неделе; b – 6–7 неделе; c – 10 неделе культивирования Fig. 4. Micrographs of green algae: (I) S. tetrasporum ACSSI 222 growing at Bristol medium, (II) T. aplanospora ACSSI 225 growing at Bristol medium, (III) T. pampae ACSSI 230 growing at Bold 3N medium. Micrographs were taken at 3–4(a), 6–7 (b), 10 (c) week of culturation
Дополнения к первоначальным диагнозам. В результате исследования были отмечены некоторые дополнения или расхождения с морфологическими диагнозами в первоописаниях. Так, по нашим наблюдениям, у штамма T. isobilateralis возможно образование многоклеточных пакетов на среде Bold 3N (рис. 5 I). Штамм T. pampae уже в возрасте 3–4 недель имеет как одиночные клетки, так и малоклеточные комплексы и многоклеточные пакеты (рис. 5 II). В то же время из литературы известно, для молодой культуры T. pampae характерны только одиночные клетки, стареющая культура представлена также диадами, тетрадами и более сложными комплексами из тетрад (Андреева, 1998). У штамма T. illinoisensis во весь период культивирования помимо малоклеточных комплексов присутствовали сложные клеточные комплексы, состоящие из тетрад (рис. 5 III), что ранее не отмечалось (Андреева, 1998). У T. isobilateralis может быть не только массивный сплошной хлоропласт (Андреева, 1998), но и пристенный шаровидный с отверстием и рассеченной поверхностью, а также в части клеток хлоропласт напоминает чашевидный. Только на 1%-ной среде Bristol отмечалось изменение цвета культур на чашках Петри. Коричневатый оттенок приобрели T. intermedia (6–7 недель роста) и T. illinoisensis (10 неделя роста).
Рис. 5. Фотографии зеленых водорослей: I – многоклеточные пакеты у T. isobilateralis ACSSI 229; II – многоклеточные пакеты у T. pampae ACSSI 230; III – сложные комплексы из тетрад у T. illinoisensis ACSSI 227. Fig. 5. Micrographs of green algae: I – many-celled packets of T. isobilateralis ACSSI 229; II – many-celled packets of T. pampae ACSSI 230; III – complexes comprised of tetrad of T. illinoisensis ACSSI 227.
Таким образом, была установлена значительная изменчивость важных морфологических признаков, на основании которых происходит определение изученных таксонов зеленых водорослей, в зависимости от культуральных условий. Поэтому необходимость использования молекулярно-генетического анализа для их идентификации не вызывает сомнения.
Заключение 1. Длительность культивирования и свойства питательной среды (состав и плотность) влияют на такие диакритические морфологические признаки зеленых водорослей родов Tetracystis и Spongiococcum, как тип хлоропласта, устойчивость клеточных комплексов, накопление крахмала, липидов и вторичных каротиноидов. Данный факт требует разработки единого протокола культивирования зеленых водорослей (выбор одной среды с определенной плотностью, четких сроков наблюдений) во избежание ошибок в их идентификации. 2. Центральный тип хлоропласта является нетипичным для водорослей рода Tetracystis, поэтому необходима переклассификация его представителей и переоценка таксономического веса этого морфологического признака, основываясь не только на данных фенотипа, но и генотипа. 3. S. tetrasporum и T. aplanospora имеют сходную морфологию и адаптивный ответ на изменение культуральных условия, что, возможно, связано с их близким родством. Данное предположение требует дальнейшего подтверждения с помощью молекулярно-генетического анализа, который планируется в дальнейшей работе.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №16-43-00797 мол_а.
Список литературы 1. Айздайчер Н.А. Соленостные адаптации одноклеточной водоросли Attheya ussurensis (Bacillariophyta) // Известия ТИНРО. 2013. Т.173. С. 223–229. 2. Андреева В.М. Почвенные и аэрофильные зеленые водоросли (Chlorophyta: Tetrasporales, Chlorococcales, Chlorosarcinalis). – СПБ: Наука, 1998. – 351 с. 3. Богачева А.С. Чувствительность цианобактерий к токсическому действию солей тяжёлых металлов: дис. … канд. биол. наук. – Санкт-Петербург, 2011. – 139 с. 4. Гайсина Л.А. Биология и экология Xanthonema exile (Klebs) Silva (Xanthophyceae, Chrysophyta): дис. … канд. биол. наук. – Уфа, 2000. – 130 с. 5. Зарипова Л.Х. Биология и экология почвенной цианобактерии Cylindrospermum michailovskoënse (Cyanoprokaryota): дис. … канд. биол. наук. – Уфа, 2009. – 194 с. 6. Сайт Альгологической коллекции ИФХиБПП РАН – Algal Collection of Soil Science Institute (ACSSI). URL: http://acssi.org (дата обращения: 28.09.2016). 7. Сафиуллина Л.М. Морфологическая изменчивость почвенной водоросли Eustigmatos magnus (B. Petersen) Hibberd (Eustigmatophyta) под влиянием экологических факторов: дис. … канд. биол. наук. – Уфа, 2009. – 153 с. 8. Сафиуллина С.Ю., Бакиева Г.Р., Фазлутдинова А.И. Толерантность почвенных водорослей Eustigmatos magnus (B. Petersen) Hibberd (Eustigmatophyta) и Hantzschia amphioxys (Ehrenberg) Grunow in cleve et Grunow (Bacillariophyta) к воздействию тяжелых металлов // Вестник ОГУ. 2009. №6. С. 609–610. 9. Сафиуллина Л.М. Устойчивость почвенной водоросли Eustigmatos magnus (B. Petersen) Hibberd (Eustigmatophyta) к действию высоких температур // Известия Самарского научного центра РАН. 2011. №5-2. С. 212–215. 10. Сафиуллин С.Ю., Бакиева Г.Р. Толерантность штамма ACKU 506-06* Bracteacoccus minor (Chodat) Petrovб к воздействию высоких температур // Вестник ОГУ. 2011. №16. С. 204–205. 11. Соловченко А.Е. Физиология и адаптивное значение вторичного каротиногенеза у зеленых микроводорослей // Физиология растений. 2013. Т.60, №1. С. 3–16. 12. Темралеева А.Д., Минчева Е.В., Букин Ю.С., Андреева А.М. Современные методы выделения, культивирования и идентификации зеленых водорослей (Chlorophyta). – Кострома: Костромской печатный дом, 2014. – 215 с. URL: http://www.ibiw.ru/upload/112480.pdf (дата обращения: 17.09.2016). 13. Темралеева А.Д. Влияние соединений свинца на альго-цианобактериальное сообщество серой лесной почвы: автореф. дис. канд. биол. наук. – Пущино, 2013. – 171 с. 14. Челебиева Э.С. Особенности вторичного каротиногенеза у зеленых микроводорослей: дис. … канд. биол. наук. – Севастополь, 2014. – 154 с. 15. Anderson D.J., Nichols H.W. Chlorophycean Algae from Limestone Springs // American J. of Botany. 1968. V.55, №2. P. 205–213. 16. Arce G., Bold H.C. Some Chlorophyceae from Cuban Soils // American Journal of Botany. 1958. V.45, № 6. P. 492–503. 17. Deason T.R. Three Chlorophyceae from Alabama Soil // American Journal of Botany. 1959. V.46, №8. P. 572–578. 18. Flechtner V.R., Boyer S.L., Johansen J.R., DeNoble M.L. Spirirestis rafaelensis gen. et sp. nov. (Cyanophyceae), a new cyanobacterial genus from arid soils // Nova Hedwigia. 2002. V.74. P. 1–24. 19. George B., Pancha I., Desai C. et al. Effects of different media composition, light intensity and photoperiod on morphology and physiology of freshwater microalgae Ankistrodesmus falcatus // Journal of Applied Phycology. 2014. V.171, iss.5. P. 2087–2095. 20. Guiry M.D., Guiry G.M. 2016. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. URL: http://www.algaebase.org (дата обращения: 17.09.2016). 21. Luo W., Pflugmacher S., Pröschold T. et al. Genotype versus phenotype variability in Chlorella and Micractinium (Chlorophyta, Trebouxiophyceae) // Protist. 2006. V.157, iss.3. P. 315–333. 22. Luo W., Pröschold T., Bock C., Krienitz L. Generic concept in Chlorella-related coccoid green algae (Chlorophyta, Trebouxiophyceae) // Plant Biol. 2010. V.12, iss.3. P. 545–553. 23. Margalef R. Temperature and morphology in freshwater organisms // International association of theoretical and applied limnology, Proc. vol. XII. – Stuttgart, 1955. – P. 507–514. 24. Massalski A., Mroziiiska T., Olech M. Ultrastructural observations on five pioneer soil algae from ice denuded areas (King George Island, West Antarctica) // Polar Biosci. 2001. V.14. P. 61–70. 25. Trainor F.R. The format for a Scenedesmus monograph // Algol. Stud. 1991. V.61. P. 47–53. 26. Trainor F.R., Egan P.F. Discovering the various ecomorphs of Scenedesmus. The end of a taxonomic era // Arch. Protistenk. 1991. V.139, №1–4. P. 125–132. Статья поступила в редакцию 17.11.2016
The influence of cultivation conditions on the morphology of green algae of the genera Tetracystis and Spongiococcum: the case of authentic strains from ACSSI collection Svetlana V. Moskalenko, Anna D. Temraleeva, David L. Pinsky Institute of Physicochemical and Biological Problems in Soil Science of RAS (Pushchino, Russia) The influence of medium composition and density, duration of cultivation of green algae of genera Tetracystis and Spongiococcum on the chloroplast type and stability of cellular complexes is found. Based on the observations of the morphological features of S. tetrasporum and T. aplanospora we suggested their close relationship. The conclusion drawn from the study is that there is a need to develop a common protocol of cultivation in order to avoid misidentification of these green algae. Morphological diagnoses of some species were supplemented. Key words: green algae; Tetracystis; Spongiococcum; morphological variability; culture conditions; ACSSI.
Об авторах Москаленко Светлана Валентиновна - Moskalenko Svetlana Valentinovna научный сотрудник Института физико-химических и биологических проблем почвоведения РАН, Пущино, Россия, (Institute of Physicochemical and Biological Problems in Soil Science of Russian Academy of Sciences, Russian Federation, Pushchino), лаборатория физико-химии почв
Темралеева Анна Дисенгалиевна - Temraleeva Anna Disengalievna кандидат биологических наук
Пинский Давид Лазаревич - Pinsky David Lazarevich доктор биологических наук
Корреспондентский адрес: Россия, 142290, Московская область, г. Пущино, ул. Институтская, д. 2, ИФХиБПП РАН; телефон: 8(4967)31-81-70.
ССЫЛКА НА СТАТЬЮ: Москаленко С. В., Темралеева А. Д., Пинский Д. Л. Влияние условий культивирования на морфологию зеленых водорослей родов Tetracystis и Spongiococcum (на примере аутентичных штаммов коллекции ACSSI) // Вопросы современной альгологии. 2017. № 2 (14). URL: http://algology.ru/1172 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮ
|
|||
|
| ||