|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Годовая динамика содержания растворимых флоротаннинов в клетках Fucus vesiculosus L. и возможное их участие в процессах репарации тканей
Рыжик И.В.1,2, Фисак Е.М.3 Inna V. Ryzhik, Elena M. Fisak
1Мурманский морской биологический институт КНЦ РАН (Мурманск, Россия)
УДК 577.1:582.272(265.1)
Установлено наличие годовой динамики содержания флоротаннинов в клетках Fucus vesiculosus L.: максимальное их количество наблюдается весной и осенью, минимальное – летом и зимой. Экспериментально показано накопление растворимых флоротанинов в ответ на механическое повреждение тканей. Обсуждается возможная роль флоротаннинов в процессах репарации поврежденных тканей. Ключевые слова: бурые водоросли; Fucus vesiculosus; физоды; содержание флоротаннинов; годовая динамика; процессы репарации.
Введение Обитающие в приливно-отливной зоне живые организмы, в том числе фукоиды, постоянно испытывают на себе различные типы воздействий, такие как периодическое осушение, колебания температуры и солености, изменение освещенности и т.д. Кроме этого имеются разнообразные типы механического воздействия: прибойные волны, повреждение тканей ледовым покровом, хищниками (для животных) или травоядными животными (для растений). В результате механических повреждений образуется раневая поверхность, которая является воротами для проникновения болезнетворных микроорганизмов и вирусов, что может привести к замедлению роста или гибели организма. Одним из механизмов защиты является накопление и выделение в среду веществ, обладающих противомикробной активностью, участвующих в восстановлении поврежденных структур, обладающих антиоксидантными свойствами. К такой группе веществ относятся флоротаннины. Флоротаннины – вторичные метаболиты разных групп водорослей (Mezghani et al., 2016), которые выполняют широкий спектр функций в растительном организме. Они участвуют в формировании клеточных стенок, осуществляют защитную функцию от избытка УФ-радиации, могут выступать в качестве резервных питательных веществ, которые используются в период недостатка в среде соединений азота (Steinberg, 1988; Targett, Arnold, 1998; Arnold, Targett, 2000; Pavia, Toth, 2000), участвуют в формировании защитных механизмов от травоядных животных (Dubois, Iken, 2012). В клетках флоротаннины бывают в связанном виде (входят в состав клеточных стенок) и растворимые, которые содержатся в цитоплазме и у бурых водорослей накапливаются в физодах, специализированных структурах клеток, которые образуются из пузырьков аппарата Гольджи и в талломе локализуются как правило в коровом и промежуточном слоях клеток. Содержание растворимых флоротаннинов в клетках определенных видов водорослей не является стабильным показателем. Оно зависит от общей физиологической активности растений и определяется балансом между скоростью их синтеза и вовлечением в различные процессы жизнедеятельности водоросли (Koivikko et al., 2005). Несмотря на большое количество работ в данной области (Ragan, 1976; Van Alstyne , 1988; Lüder, Clayton, 2004; Dubois, Iken, 2012; Haavisto et al., 2017), роль флоротаннинов остается до конца не изученной. Цель данной работы – определить содержание растворимых флоротаннинов в клетках бурых водорослей Fucus vesiculosus в течение года и показать их участие в процессах регенерации поврежденных тканей.
Материалы и методы Растительный материал. Отбор водорослей осуществляли в районе пос. Абрам-мыс Кольского залива (68°97´с.ш., 33°08´з.д.). Талломы Fucus vesiculosus L. собирали раз в месяц, в первую половину дня, на отливе. Исследование проводили в течение 2011–2012 и 2015–2016 гг. Определение содержания растворимых флоротаннинов. Определение содержания флоротаннинов проводили по стандартной методике Фолина–Дениса (Сиренко, 1979). Расчет производили по калибровочной кривой, которая имеет линейную зависимость между оптической плотностью растворов при 725 нм и концентрацией фенольных соединений в пределах 1–50 мкг. Калибровочную кривую строили по флороглюцину. Экспериментальные исследования участия растворимых флоротаннинов в процессах регенерации тканей. Исследования проводили в лабораторных условиях, водоросли содержали в термостатируемом комплексе с фотопериодом: 12свет/12темнота, температурой +4°–+6°С, освещенностью ФАР 100 Вт/м2, при постоянном перемешивании воды. Вода в сосудах менялась 1 раз в 10 дней. Апикальные участки талломов длиной 1,5 см, отрезанные от растений, помещали в сосуды емкостью 1 л заполненные морской водой. Параллельно для контроля в этих же условиях содержали целые неповрежденные талломы. Содержание флоротаннинов в апексах измеряли на 1-е, 2-е, 3-е, 4-е, 10-е сутки. У контрольных растений измеряли на 0, 10 сутки эксперимента. Микрофотографии тканей в процессе заживления раневой поверхности делали ежедневно. Использовали методы световой и люминесцентной микроскопии на микроскопе Carl Zeiss Axio Imager. D4 Поскольку флоротаннины способны к автосвечению, оценивали состояние клеток, наполненных физодами, по автофлуоресценции (Schoenwaelder, Clayton, 1998; Lichtenthaler, Schweiger, 1998). Обработка результатов исследования была произведена с помощью программного пакета статистических методов Excel 2007 (рассчитывали стандартное отклонение, доверительный интервал, достоверность изменений определяли по критерию Стьюдента при Р=0,05)
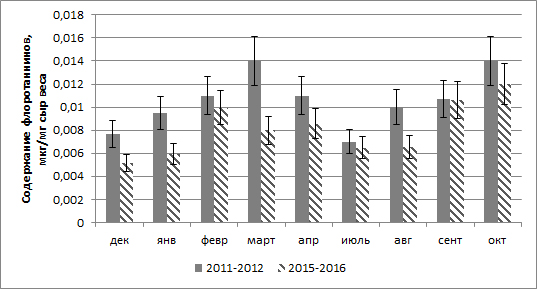
Результаты 1. Сезонное изменение флоротаннинов в апикальных частях талломов Fucus vesiculosus. В течение года содержание растворимых флоротаннинов в клетках апикальных участков таллома достоверно изменяется: минимальное их количество отмечается в декабре и июле, максимальное – в марте и сентябре. В целом содержание флоротаннинов в период 2011–2012 гг. было выше, чем в 2015–2016 гг. (рис. 1).
Рис. 1. Содержание растворимых флоротаннинов в клетках апикальных участков таллома F. vesiculosus в течение года Fig. 1. The content of soluble phlorotannins in the cells of the apical thallus of F. vesiculosus in the course of the year
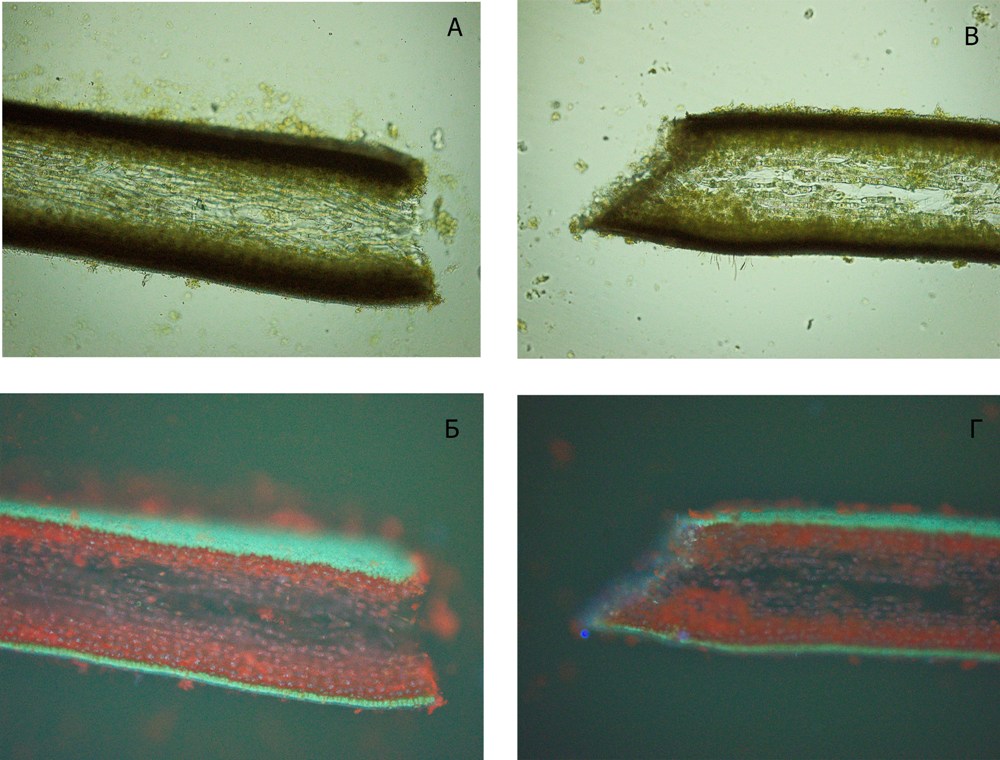
2. Участие флоротаннинов в регенерации поврежденной поверхности. Микроскопическое исследование раневой поверхности показало, что в процессе регенерации тканей происходит выделение на поврежденную поверхность веществ, возможно, полисахаридной природы; активная пролиферация клеток, прилегающих к месту ранения, изменение размеров и формы клеток, что приводит к формированию так называемой пробки (рис. 2).
Рис. 2. Процесс регенерации раневой поверхности Fucus vesiculosus: А, Б – свежая рана, В, Г – через 15 дней (Б, Г – люминесцентная микроскопия) Fig. 2. The process of regeneration of the wound surface Fucus vesiculosus: А, Б – fresh wound,
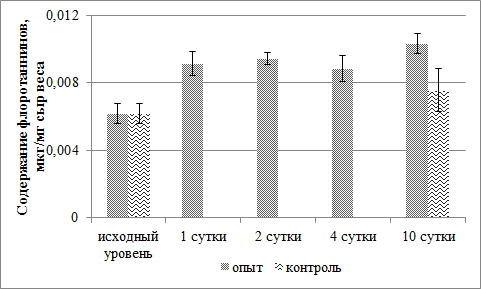
При наличии повреждения происходит активный синтез флоротаннинов в течение первых суток, в дальнейшем их количество не меняется. У неповрежденных водорослей к концу эксперимента содержание флоротаннинов достоверно не изменилось (рис. 3).
Рис. 3. Динамика содержания флоротаннинов в период регенерации поврежденных тканей F. vesiculosus Fig. 3. Dynamics of the content of phlorotannins during regeneration of damaged tissues of F. vesiculosus
Обсуждение Исследованиям флоротаннинов посвящено большое количество работ, которые показывают, что на их содержание оказывают влияние как эндогенные процессы (особенности жизненного цикла, стадии развития), так внешние факторы (интенсивность ФАР, УФ, доступность биогенов, повреждение травоядными животными) (Ragan, 1976; Steinberg, 1995; Jennings, Steinberg, 1997; Van Alstyne et al., 1999; Lüder, Clayton, 2004; Koivikko et al., 2005; Dubois, Iken, 2012; Haavisto еt al., 2017). Данное исследование показало, что содержание флоротаннинов у Fucus vesiculosus Баренцева моря изменяется в течение года: минимум отмечается в зимний и летний периоды, а максимум – весенний и осенний. В работах, также выполненных на фукусовых водорослях Баренцева моря, описано повышение концентрации в феврале–марте, а для Ascophyllum nodosum – в октябре (Ткач, Облучинская, 2017). На примере балтийских фукоидов F. vesiculosus показано снижение количества полифенолов в весенний и летний периоды и увеличение в зимний (Rönnberg, Ruokolahti, 1986). У водорослей Северного моря максимум накопления отмечается в июле (Parys et al, 2009). Для нескольких видов саргассовых водорослей Японского моря зафиксировано повышение содержания полифенолов в летний период, снижение зимой и накопление к апрелю (Kamiya et al., 2010). Причины подобных различий могут заключаться как в особенностях жизненного цикла растений, так и быть связанными с комплексом абиотических факторов, характерных для мест обитания водорослей. Для Fucus vesiculosus Баренцева моря показан годовой ритм физиологической активности с несколькими пиками, который имеет сходство с динамикой содержания флоротаннинов. Первый максимум приходится на весенний период, который совпадает с интенсификацией ростовых процессов. В этот период накопление флоротаннинов может происходить в связи с их участием в построении клеточных стенок (Schoenwaelder, Clayton, 1999). В ряде работ для растущих частей таллома водорослей также отмечено большее содержание растворимых флоротаннинов, чем в зрелых частях (Jennings, Steinberg, 1997; Van Alstyne et al., 1999; Lüder, Clayton, 2004; Kamiya et al., 2010). Однако у ламинариевых водорослей Западной Британии отмечена обратная зависимость (Connan et al., 2006), а у фукоидов показано равномерное распределение флоротаннинов по таллому (Connan et al., 2006, 2007). Также на увеличение концентрации флоротаннинов может оказать влияние и увеличение численности и активизация в весенний период литоральных моллюсков Littorina (Павлова, 2002), которые используют в пищу фукоиды. Связанное с увеличением количества травоядных животных повышение содержания флоротаннином описано для Ecklonia radiata (Steinberg, 1988; Lüder, Clayton, 2004), F. vesiculosus, Ascophyllum nodosum (Yates, Peckol, 1993; Pavia, Toth, 2000;), F. distichus (Van Alstyne, 1988). Однако, в экспериментах на F. vesiculosus показано (Hemmi et al., 2004), что накопление флоротаннинов в ответ на повреждения травоядными животными носит локальный и кратковременный характер, то есть можно предположить, что вещества накапливаются не для защиты от травоядных, а для восстановления поврежденной поверхности. На примере Ascophyllum nodosum было показано, что в ответ на воздействие травоядными животными флоротаннины накапливаются в течение 3 суток (Pavia, Toth; 2000). В ряде работ показана зависимость антиоксидантной активности от концентрации флоротаннинов в растении. В весенний период на Мурманском побережья наблюдается высокий уровень освещения и УФ радиации, а также быстрое увеличение длины светового дня после окончания полярной ночи, повышение температуры. Большие дозы освещения могут вызывать оксидативный стресс, в связи с чем увеличенное содержание флоротаннинов может служить для поддержания повышенного уровня антиоксидантных процессов в клетках растений (Connan et al., 2007; Gómez, Huovinen, 2010). В летний период содержание растворимых флоротаннинов снижается, что может быть связано с замедлением ростовых процессов и переключением метаболизма с роста на накопление запасных питательных веществ. Возможно, флоротаннины будут использоваться как альтернативные источники азота: были показаны корреляции между содержанием в среде азота и количеством таннинов в клетках (Ilvessalo, Tuomi, 1989; Pavia , Toth, 2002). В осенний период содержание флоротаннинов вновь увеличивается. Возможно, что это связано с накоплением запасных веществ в период подготовки растений к полярной ночи. Также осенью происходит закладка органов размножения фукуса пузырчатого, и накопившиеся в осенний период флоротаннины могут использоваться для строительства клеточных стенок. Кроме этого, осенью происходит смена погодных условий и наблюдается высокое количество штормов, обрывающих и повреждающих растения литоральной зоны. С наступлением зимы общая физиологическая активность растений снижается, уменьшается и концентрация растворимых флоротаннинов, которые, по-видимому, расходуются как запасные вещества на построение и поддержание целостности клеточных стенок.
Исследование показало, что содержание флоротаннинов в клетках бурой водоросли F. vesiculosus Баренцева моря зависит от сезона и, возможно, определяется уровнем физиологической активности организма и комплексом внешних факторов, таких как интенсивность ФАР и УФ, активность травоядных животных, механическое повреждение прибойными волнами. Активный синтез веществ происходит в течение первых суток после травмы. При этом флоротаннины могут выступать не только как компоненты клеточных стенок, но и как вещества, обладающие бактерицидным или бактериостатическим свойствами и препятствующие размножению бактерий на поврежденных тканях.
Список литературы 1. Павлова Л.В. Сезонная динамика качественного и количественного состава литорального зообентоса губы Хлебная (Баренцево море, Кольский залив) // Материалы XX юбилейной конференции молодых ученых Мурманского морского биологического института. – Мурманск, 2002. – С. 123–131. 2. Сиренко Л.А. Методы физиолого-биохимического исследования водорослей в гидробиологической практике. – Киев: Наукова думка, 1975. – 63 с. 3. Ткач А.В., Облучинская Е.Д. Стерины и полифенолы фукоидов мурманского побережья Баренцева моря // Вестник Мурманского государственного технического университета. 2017. Т. 20, № 2. С. 326–335. 4. Arnold T.M., Targett N.M. Evidence for metabolic turnover of polyphenolics in tropical brown algae // J. Chem. Ecol. 2000. V.26. Р. 1393–1410. 5. Connan S., Delisle F., Deslandes E., Ar Gall E. Intra-thallus phlorotannin content and antioxidant activity in Phaeophyceae of temperate waters // Bot Mar. 2006. V.49. Р. 39–46. 6. Connan E., Deslandes E., Ar Gall Е. Influence of day–night and tidal cycles on phenol content and antioxidant capacity in three temperate intertidal brown seaweeds // Journal of Experimental Marine Biology and Ecology. 2007. V.349, №2. Р. 360–365. 7. Dubois A., Iken K. Seasonal variation in kelp phlorotannins in relation to grazer abundance and environmental variables in the Alaskan sublittoral zone //Algae. 2012. V.27, №1. P. 9–19. DOI: 10.4490/algae.2012.27.1.009. 8. Gómez I., Huovinen P. Induction of phlorotannins during UV exposure mitigates inhibition of photosynthesis and DNA damage in the kelp Lessonia nigrescens // Photochemistry and Photobiology. 2010. V.86. P. 1056–1063. doi:10.1111/j.1751-1097.2010.00786.x. 9. Haavisto F., Koivikko R., Jormalainen V. Defensive role of macroalgal phlorotannins: benefits and trade-offs under natural herbivory // Mar Ecol Prog Ser. 2017. V.566. P. 79–90. doi.org/10.3354/meps12004. 10. Hemmi A., Honkanen T., Jormalainen V. Inducible resistance to herbivory in Fucus vesiculosus – duration, spreading and variation with nutrient availability // Marine ecology progress series. 2004. V. 273. P. 109–120. 11. Ilvessalo H., Tuomi J. Nutrient availability and accumulation of phenolic compounds in the brown alga Fucus vesiculosus // Marine Biology. 1989. V.101. P. 115–119. 12. Jennings J.G., Steinberg P.D. Phlorotannins versus other factors affecting epiphyte abundance on the kelp Ecklonia radiata // Oecologia. 1997. V.109, №3. Р. 461–473 13. Kamiya M., Nishio T., Yokoyama A., Yatsuya K., Nishigaki T., Yoshikawa S., Ohki K. Seasonal variation of phlorotannin in Sargassacean species from the coast of the Sea of Japan // Phycological Research. 2010. V.58. P. 53–61. DOI: 10.1111/j.1440-1835.2009.00558.x 14. Koivikko R., Loponen J., Honkanen T., Jormalainen V. Contents of soluble, cell-wall-bound and exuded phlorotannins in the brown alga Fucus vesiculosus, with implications on their ecological functions // Journal of Chemical Ecology. 2005. V.31, №1. P. 195–212. DOI: 10.1007/s10886-005-0984-2 15. Lichtenthaler H.K., Schweiger J. Cell wall bound ferulic acid, the major substance of the blue-green fluorescence emission of plants //Journal of Plant Physiology. 1998. V.152, №2–3. P. 272–282 16. Lüder U.H., Clayton M.N. Induction of phlorotannins in the brown macroalga Ecklonia radiata (Laminariales, Phaeophyta) in response to simulated herbivory—the first microscopic study // Planta. 2004. V.218, №6. P. 928–937. 17. Mezghani S., Csupor D., Bourguiba I., Hohmann J., Amri M., Bouaziz M. Characterization of Phenolic Compounds of Ulva rigida (Chlorophycae) and Its Antioxidant Activity // European Journal of Medicinal Plants. 2016. V.12, №1. P. 1–9. 18. Parys S., Kehraus S., Pete R., Küpper F.C., Glombitza K.-W., König G.M. Seasonal variation of polyphenolics in Ascophyllum nodosum (Phaeophyceae) // Eur. J. Phycol. 2009. V.44, №3. P. 331–338. dx.doi.org/10.1080/09670260802578542 19. Pavia H., Toth G.B. Inducible chemical resistance to herbivory in the brown seaweed Ascophyllum nodosum // Ecology. 2000. V.81, №11. P. 3212–3225. DOI: 10.1890/0012-9658(2000)081. 20. Pavia H., Toth G.B. Influence of light and nitrogen on the phlorotannin content of the brown seaweeds Ascophyllum nodosum and Fucus vesiculosus // Developments in Hydrobiology. 2002. V.152. P. 299–305. 21. Ragan M.A. Physodes and the phenolic compounds of brown algae. Composition and significance of physodes in vivo // Botanika Mar. 1976. V.9. P. 145–154. 22. Rönnberg O., Ruokolahti C. Seasonal variation of algal epiphytes and phenolic content of Fucus vesiculosus in a northern Baltic archipelago // Annales Botanici Fennici. 1986. V.23, №.4. Р. 317–323. 23. Schoenwaelder M.E.A., Clayton M.N. Secretion of phenolic substances into the zygote wall and cell plate in embryos of Hormosira and Acrocarpia (Fucales, Phaeophyceae) // J. Phycol. 1998. V.34. P. 969–980. 24. Schoenwaelder M.E.A., Clayton M.N. The presence of phenolic compounds in isolated cell walls of brown algae // Phycologia. 1999. V.38, №.3. Р. 161–166. doi.org/10.2216/i0031-8884-38-3-161.1. 25. Steinberg P.D. The effects of quantitative and qualitative variation in phenolic compounds on feeding in three species of marine invertebrate herbivores // J. Exp. Mar. Biol. Ecol. 1988. V.120. P. 221–382. 26. Steinberg P.D. Seasonal variation in the relationship between growth rate and phlorotannin production in the kelp Ecklonia radiata // Oecologia. 1995. V.102. P. 169–173. 27. Targett N.M., Arnold T.M. Quantifying in situ rates of phlorotannin synthesis and polymerization in marine brown algae // J. Chem. Ecol. 1998. №24. Р. 577–595. 28. Van Alstyne K.L. Herbivore grazing increases polyphenolic defenses in the intertidal brown alga Fucus distichus // Ecology. 1988. V.69. P. 655–663. 29. Van Alstyne K.L., McCarthy J.J., Hustead C.L., Duggins D.O. Geographic variation in polyphenolic levels of Northeastern Pacific kelps and rockweeds // Marine Biology. 1999. V.133, №2. Р. 371–379. 30. Yates J.L., Peckol P. Effects of nutrient availability and herbivory on polyphenolics in the seaweed Fucus versiculosus // Ecology. 1993. V.74, №6. P. 1757–1766. doi:10.2307/1939934. Статья поступила в редакцию 23.11.2017
The annual dynamics of the content of soluble phlorotannins in the cells of Fucus vesiculosus L. and their possible role in the repair processes of damaged tissue Inna V. Ryzhik , Elena M. Fisak 1Murmansk Marine Biological Institute KSC RAS (Murmansk, Russia) The presence of the annual dynamics of the content of phlorotannins in the cells of Fucus vesiculosus L. had been established. Their maximum number observed in spring and autumn, minimum – in summer and winter. The accumulation of soluble phlorotannins in response to mechanical tissue damage was experimentally shown. The possible role of phlorotannins in the repair processes of damaged tissues is discussed. Key words: brown algae; Fucus vesiculosus; physode; content of phlorotannins; annual dynamics; repair processes.
Об авторах Рыжик Инна Валериевна – Ryzhik Inna V. кандидат биологических наук alaria@yandex.ru Фисак Елена Максимовна – Fisak Elena M. магистр black-and-white16@yandex.ru Корреспондентский адрес: Россия, 183010, Мурманск, ул. Владимирская, 17, ММБИ КНЦ РАН; тел. 8-8152-250696, факс 8-8152-253994.
ССЫЛКА НА СТАТЬЮ: Рыжик И.В., Фисак Е.М. Годовая динамика содержания растворимых флоротаннинов в клетках Fucus vesiculosus L. и возможное их участие в процессах репарации тканей // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1248 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||