|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Методика выделения Arthrospira (Spirulina) platensis (Nordstedt) Gomont в альгологически чистую культуру
Геворгиз Р.Г., Меметшаева О.А., Романова Д.Ю. Ruslan G. Gevorgiz, Olga A. Memetshaeva, Daria Yu. Romanova
Институт морских биологических исследований имени А.О. Ковалевского (Севастополь, Россия)
УДК 582.232
В настоящем учебно-методическом пособии представлена подробная инструкция по выделению Arthrospira (Spirulina) platensis в альгологически чистую культуру. Даны практические рекомендации по выделению спирулины в альгологически чистую культуру в неспециализированных лабораториях. Пособие адресовано биологам, альгологам, технологам, а также аспирантам и студентам всех специальностей. Ключевые слова: Arthrospira (Spirulina) platensis; альгологически чистая культура.
Введение Неотъемлемой частью создания и поддержания любой коллекции живых культур микроводорослей являются работы по выделению микроводорослей из природных популяций в альгологически чистые культуры. Для этих целей альгологами разработаны специальные приемы, например, изъятие с помощью капилляра клеток определенного вида из смешанной культуры и пересеве их в стерильные питательные среды (Владимирова, Семененко, 1962; Методы, 1975; Гайсина и др., 2008; Орлова и др., 2011; Темралеева и др., 2014). Такие методы, как правило, достаточно трудоемки, требуют высокой квалификации, навыка и значительных затрат времени. Цель работы – разработать простую методику выделения S. (A.) platensis (Брянцева и др., 2006) в альгологически чистую культуру в условиях неспециализированной лаборатории, например, на предприятиях по производству биомассы спирулины в промышленных масштабах.
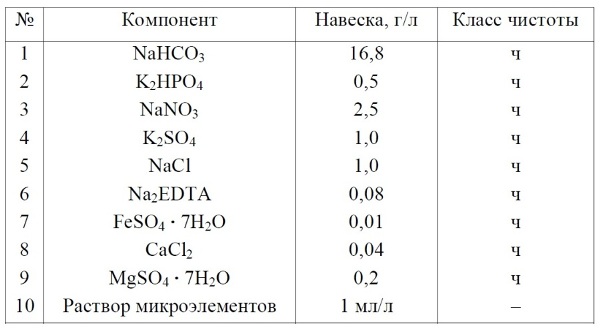
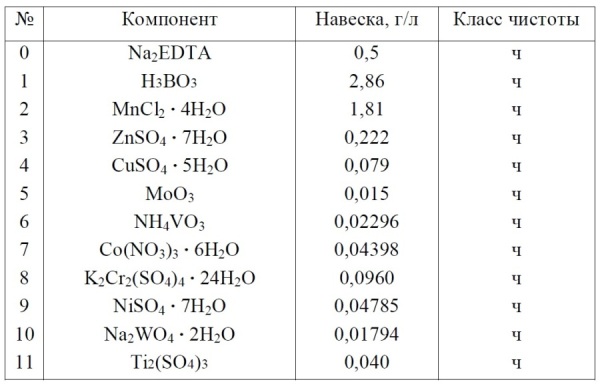
Материалы и методы Приборы: оптический микроскоп с кратностью увеличения ×200–×800; набор предметных и покровных стекол; сушильный шкаф с максимумом температурного режима 150–200оС; стандартная микробиологическая петля; спиртовая горелка для прокаливания микробиологической петли. Посуда: колбы конические, плоскодонные объемом 250 мл; колбы плоскодонные объемом 500–1000 мл для приготовления питательной среды Заррук; стеклянная палочка. Материалы: крафт-пакеты для стерилизации заклеивающиеся или со скрепами; фильтровальная бумага любой плотности; фольга или пленка Parafilm для закрытия колб во время культивирования. Реактивы: в нижеследующих таблицах (Таблица 1 и Таблица 2) приведен перечень реактивов, необходимых для приготовления стандартной питательной среды Заррук (Zarrouk, 1966). Питательную среду Заррук готовят на дистиллированной воде.
Таблица 1. Раствор А. Перечень макроэлементов
Таблица 2. Раствор В. Перечень микроэлементов
Ход работы 1. Всю посуду стерилизуют в сушильном шкафу при температуре не ниже 120оС в течение 2–3 часов. 2. Непосредственно перед началом процедур, связанных с выделением спирулины в альгологически чистую культуру, готовят питательную среду Заррук. 3. Перед очисткой культуры спирулины необходимо убедиться в том, что клетки спирулины адаптированы к среде Заррук и активно вегетируют. Для этого смешанную культуру помещают в благоприятные для роста условия (20–25оС, диапазон рН 8,4–9,5, постоянное освещение 500–100 Лк) и культивируют в накопительном или квазинепрерывном режиме. Посредством микроскопирования периодически (каждые 2–4 дня) проверяют, удлиняются ли нити спирулины. 4. После накопления биомассы смешанную культуру спирулины разливают в несколько стерильных колб. Высота слоя культуры 2–3 см. Освещенность увеличивают до 3–5 кЛк. Суспензию в колбах не перемешивают. Через 2–3 дня на стенках колб появляются характерные спирулиновые тяжи (Рис. 1), обусловленные подвижностью и реакцией на свет нитей спирулины. 5. Прокаливают микробиологическую петлю на спиртовой горелке; аккуратно, не перемешивая культуру, отбирают петлей нити с верхней части спирулиновых тяжей и переносят их в колбу со свежей питательной средой Заррук. Пересев делают параллельно в 3–4 колбы. 6. Колбы с пересеянной культурой помещают в благоприятные для роста условия. 7. По мере нарастания биомассы спирулины посредством микроскопирования проверяют наличие сопутствующих клеток других видов фототрофов. 8. По истечении некоторого времени (2–3 недели) колбы, в которых не обнаружены клетки сопутствующих фототрофов пересевают повторно. Альгологическую культуру спирулины помещают в коллекцию и присваивают ей новое кодовое имя.
Рис. 1. Фото культуры A. (S.) platensis с характерными длинными тяжами на стенках стеклянного сосуда Fig. 1. Photo of culture A. (S.) platensis with characteristic long strands on the walls of the glass vessel
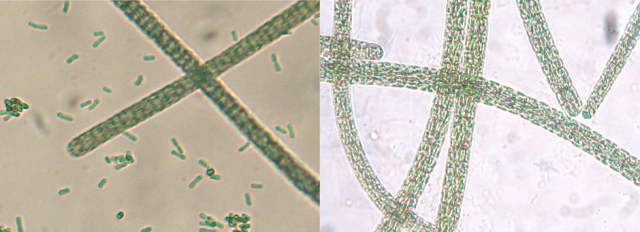
На рисунке 2 представлены фотографии культуры спирулины до и после процедуры очистки.
Рис. 2. Слева – культура A. (S.) platensis до очистки. В культуре присутствуют клетки Synechococcus sp. Справа – культура A. (S.) platensis после процедуры очистки Fig. 2. Left – Culture of A. (S.) platensis before purification. In the culture there are Synechococcus sp. сells. Right – Culture of A. (S.) platensis after the purification procedure
Заключение Разработанная методика применима для выделения в альгологически чистую культуру спирулины из проб, полученных как из естественных, так и из искусственных водоемов, например из промышленных культиваторов открытого типа. Методика проста в освоении, не требует высокой альгологической квалификации и специального оборудования. Доступна к использованию в неспециализированных лабораториях.
Работа выполнена в рамках госзадания ФГБУН ИМБИ, тема № АААА-А18-118021350003-6.
Список литературы 1. Брянцева Ю.В., Дробецкая И.В., Харчук И.А. Характеристика цианобактерии Spirulina (Arthrospira) platensis // Экология моря. 2006. Вып. 70. С. 24–27. 2. Владимирова М.Г., Семененко В.Е. Интенсивная культура одноклеточных водорослей (инструкция по первичным испытаниям, выделяемых из природы и селекционируемых форм фотоавтотрофных одноклеточных водорослей) – М.: АН СССР, 1962. – 60 с. 3. Гайсина Л.А., Фазлутдинова А.И., Кабиров Р.Р. Современные методы выделения и культивирования водорослей: учебное пособие. – Уфа: Изд-во БГПУ, 2008. – 152 с. 4. Методы физиолого-биохимического исследования водорослей в гидробиологической практике. – Киев: Наук. думка, 1975. – 247 с. 5. Орлова Т.Ю., Айздайчер Н.А., Стоник И.В. Лабораторное культивирование морских микроводорослей, включая продуцентов фитотоксинов: научно-методическое пособие. – Владивосток: Дальнаука, 2011. – 88 с. 6. Темралеева А.Д., Минчева Е.В., Букин Ю.С., Андреева А.М. Современные методы выделения, культивирования и идентификации зеленых водорослей (Chlorophyta). – Кострома: Костромской печатный дом, 2014. – 215 с. 7. Zarrouk C. Contribution à l’étude d’une cyanophycée. Influence de divers facteurs physiques et chimiques sur la croissance et la photosynthèse de Spirulina maxima (Setch et Gardner) Geitler: Ph. D thèse. – Paris, 1966. – 114 p. – (A la faculté des sciences de l’université de Paris). Статья поступила в редакцию 15.12.2017
The technique for isolating of Arthrospira (Spirulina) platensis (Nordstedt) Gomont Ruslan G. Gevorgiz, Olga A. Memetshaeva, Daria Yu. Romanova Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) This training aid provides detailed instructions on the isolation of Arthrospira (Spirulina) platensis in an algologically pure culture. In this work have been given practical recommendations for isolation of spirulina‘s cells into algologically pure culture in nonspecialized laboratories. The training aid is addressed to biologists, algologists, technologists, as well as students and postgraduates of all specialties. Key words: Arthrospira (Spirulina) platensis; algologically pure culture.
Об авторах Геворгиз Руслан Георгиевич – Gevorgiz Ruslan G. кандидат биологических наук r.gevorgiz@yandex.ru Меметшаева Ольга Александровна - Memetshaeva Olga A. ведущий инженер (аспирант), Институт морских биологических исследований им. А.О. Ковалевского РАН, Севастополь, Россия (Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia), Отдел биотехнологий и фиторесурсов olga.memetshaeva@mail.ru Романова Дарья Юрьевна – Romanova Darya Yu. ведущий инженер (аспирант), Институт морских биологических исследований им. А.О. Ковалевского РАН, Севастополь, Россия (Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia), Отдел экологии бентоса riaromanova@yandex.ru
ССЫЛКА НА СТАТЬЮ: Геворгиз Р.Г., Меметшаева О.А., Романова Д.Ю. Методика выделения Arthrospira (Spirulina) platensis (Nordstedt) Gomont в альгологически чистую культуру // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1259 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||