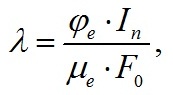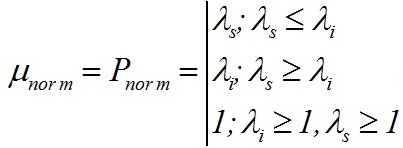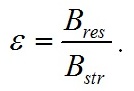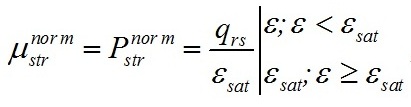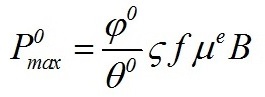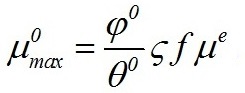|
|
|
Фундаментальные принципы моделирования фотобиосинтеза микроводорослей
Лелеков А.С., Тренкеншу Р.П. Alexander S. Lelekov, Rudolf P. Trenkenshu
Институт морских биологических исследований им. А.О.Ковалевского РАН
УДК 579.017.8:57.036
В работе перечислены классические и современные представления о росте микроводорослей в культуре, которые составляют новую парадигму моделирования фотобиосинтетических процессов. Микроводоросли рассматриваются как низшие облигатные фотоавтотрофы, способные к оксигенному фотосинтезу, характеризующиеся разделением фотохимических и ферментативных процессов. Предложена обобщенная блок-схема сопряжения световых и темновых реакций у микроводорослей. Процесс биосинтеза биохимических структур клетки из минеральных веществ осуществляется за счет энергии высокопотенциальных форм макроэргов (НАДФ·Н, АТФ). Показано, что рост микроводорослей можно рассматривать как совокупность энергообменных реакций. Предложена концепция отсутствия лимитирования роста микроводорослей факторами внешней среды. Скорость синтеза биомассы определяется приведённой плотностью потока лимитирующего энергетического либо пластического субстрата на ключевой фермент-регулятор энергообмена. Также, для удобства в практическом плане, продуктивность может быть выражена через биохимически измеряемое соотношение структурной и резервной форм биомассы. В любом случае, зависимость скорости синтеза биомассы от величины приведённой плотности потока описывается линейными сплайнами, что позволяет четко задать точку переключения лимитирующего фактора и получить простые математические решения. Ключевые слова: культура микроводорослей; скорость синтеза биомассы; лимитированный рост; приведённая плотность потока субстрата; метод линейных сплайнов; плотностат; хемостат.
Введение Рост любых организмов является сложным и многоступенчатым процессом, включающим тысячи биохимических реакций. При моделировании вклад каждой реакции учесть не представляется возможным. Поэтому в теоретических и практических исследованиях ограничиваются лишь небольшим числом параметров, которые, по мнению исследователя, наиболее полно характеризуют моделируемый объект или явление. Например, при моделировании роста микроорганизмов в культуре среди множества параметров наиболее широко используются такие количественные характеристики как плотность культуры, скорость роста, удельная скорость, экономический коэффициент и пр. На сегодняшний день спектр культивируемых гидробионтов обусловлен как требованиями практики, например, аквакультуры, так и фундаментальными научными проблемами. В последнем случае исследования проводят с объектами, удобными для решения конкретных научных задач. Наиболее успешным примером в этом отношении можно назвать микроводоросли. Достаточно сказать, что основные достижения в изучении первичных процессов фотосинтеза получены в экспериментах именно на культурах микроводорослей. Кроме того, работы с культурами микроводорослей незаменимы при оценке первичной продукции водоемов. Накопленные к настоящему моменту знания о росте и фотосинтезе микроводорослей, особенно в области управляемого фотобиосинтеза, вместе с уже устоявшимися представлениями и принципами биологии и биофизики, позволяют вплотную подойти к решению проблем, связанных с созданием теории роста микроводорослей. Цель данной работы – анализ и обобщение классических и современных подходов, которые применяются при разработке математических моделей роста и биосинтеза микроводорослей.
Культура низших фотоавтотрофов Низшие фотоавтотрофные организмы являются одними из древнейших обитателей Земли. Они появились гораздо раньше высших растений, их значимость для нормального протекания энергетических процессов в биосфере огромна (Билич, Крыжановский, 2002). В современной систематике к категории низших фотоавтотрофов относят одноклеточные водоросли и цианобактерии, которые способны к оксигенному фотосинтезу, характеризуются разделением фотохимических и ферментативных процессов. В противоположность фотосинтезирующим бактериям, данные микроскопические организмы являются облигатными фотоавтотрофами и практически не способны (за исключением некоторых видов) усваивать экзогенные органические соединения. Помимо синтеза углеводов из неорганического углерода, некоторые цианобактерии являются азотфиксаторами, что позволяет считать их абсолютными первичными продуцентами органического вещества на планете (Камнев, 2013). Культуры микроводорослей являются модельными объектами при исследовании закономерностей влияния экологических факторов среды на скорость роста и продукцию биохимических компонентов клеток. Под микроводорослями здесь и далее будем понимать всех низших оксигенных облигатных фотоавтотрофов. Широкое распространение культуры микроводорослей получили еще в начале двадцатого века при исследовании фотосинтеза, при этом многие открытия в этой области сделаны именно на микроводорослях. Основным достоинством использования культур является возможность получения воспроизводимых результатов. Это позволяет дать количественную оценку влияния того или иного фактора на скорость фотобиосинтеза, где под фотобиосинтезом понимаем согласованный синтез всех клеточных структур, т.е. биологический синтез живой структуры. Кроме того, к достоинствам культур микроводорослей при проведении гидробиологических исследований отнесем малые, часто правильные геометрические размеры и высокую скорость размножения. Удельная скорость роста как пресноводных, так и морских одноклеточных водорослей может достигать 0,3–0,4 ч-1, т.е. время генерации составляет часы (Белянин, 1984; Белянин, Сидько, Тренкеншу, 1980; Финенко, Ланская, 1971), а микроскопические размеры клеток позволяют работать с популяциями численностью намного выше млн/мл (Finenko et al., 2003). Эксперименты с такими объектами можно провести в течение нескольких дней, что невозможно с крупными особями, время генерации которых составляет годы.
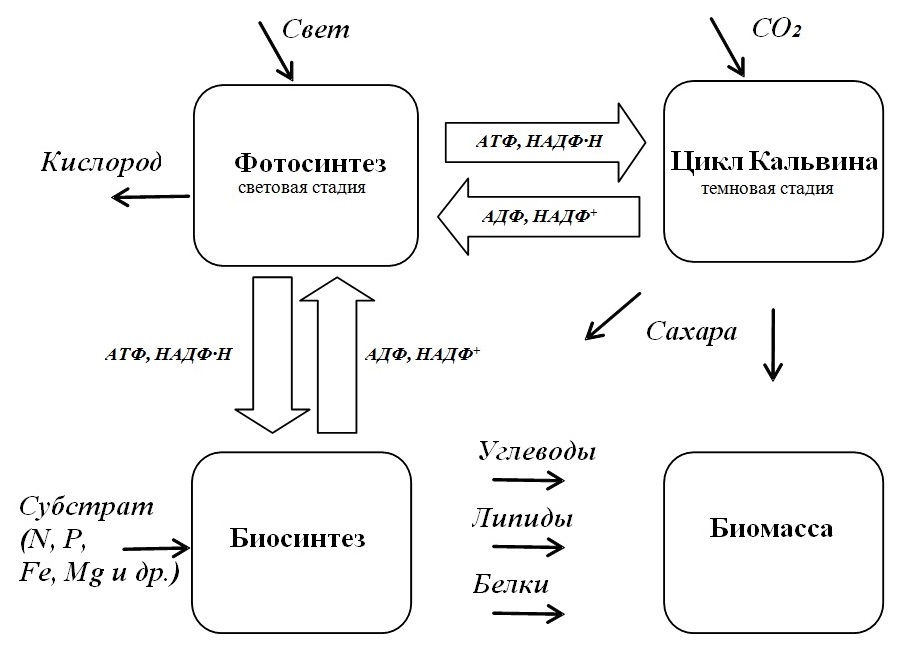
Разделение процессов массо- и энергообмена В основе роста микроводорослей лежит фотосинтез. Процесс фотосинтеза протекает в хлоропластах, либо, в случае их отсутствия у цианобактерий, в расположенных параллельными слоями ламеллярных мембранах, пронизывающих всю цитоплазму (Холл, Рао, 1983). Микроводоросли характеризуются пространственным разделением фотохимических (световая стадия) и ферментативных (темновая стадия) процессов синтеза первичных углеводов за счет энергии восстановленных макроэргов. Процесс образования макроэнергетических соединений (НАДФ·Н и АТФ) осуществляется в результате нециклического транспорта электрона по цепи переносчиков и моделируется общепринятой Z-схемой (Зитте и др., 2008; Мокроносов и др., 2006). В результате циклического переноса электронов происходит синтез добавочного количества АТФ, необходимого для нормальной работы цикла Кальвина и протекания последующих биосинтетических процессов. Основным продуктом цикла Кальвина являются фосфорилированные гексозы. Промежуточное соединение цикла – С3-фосфоглицериновая кислота – при недостатке НАДФ·Н может превращаться в пировиноградную кислоту и далее в аланин. Наряду с аминокислотами, при определенных условиях, продуктами цикла Кальвина могут являться органические кислоты, жиры, липиды (Физиология растений, 2005). Обобщенная блок-схема энерго- и массообмена микроводорослей представлена на рис. 1.
Рис. 1. Схема сопряжения световых (фотосинтез) и темновых (биосинтез) реакций у микроводорослей Fig. 1. The scheme of agreement between light (photosynthesis) and dark (biosynthesis) reactions of microalgae
Необходимо отметить, что предлагаемая схема является упрощенной, в ней не показано участие в реакциях обмена фосфора, электронов, протонов и других участников энергообмена. Кроме того, не показано участие в биосинтетических реакциях компонентов электрон-транспортной цепи, например ферредоксина, который может играть существенную (возможно, ключевую) роль не только в регуляции циклического и нециклического фотофосфорилирования, но и в образовании аминокислот, т.е. в реакциях превращения минеральных форм азота и серы в органическую форму (Рубин, Кренделева, 2003). Учет этих и других факторов приведет к громоздкости математических построений и сложностям в редуцировании систем уравнений и, как правило, к бессмысленности моделирования в целом (Дроздов-Тихомиров, Дороднов, 1991).
Внутриклеточное ограничение скорости роста микроводорослей Разделение внешних потоков энергетического и минерального питания у микроводорослей упрощает задачи моделирования, однако сразу приводит к вопросу о месте их сопряжения. В схеме фотобиосинтеза таким местом являются реакции обмена, обеспечивающие согласование скоростей: АТФ ↔ АДФ, НАДФ·Н ↔ НАДФ+ Вероятно, ключевым макроэргом, определяющим энергообмен, является НАДФ·Н. Это подтверждается тем, что высокоэнергетическая форма образуется только в результате нециклического транспорта электронов, в отличие от АТФ, который может образовываться как при нециклическом, так и при циклическом фотофосфорилировании. Таким образом, рост микроводорослей можно представить как процесс биосинтеза химических структур клетки из минеральных веществ за счет энергии высокопотенциальных форм макроэргов. Т.е. рост микроводорослей можно рассматривать как совокупность энергообменных реакций. Влияние того или иного фактора среды на продуктивность можно выразить через изменения внутриклеточной концентрации макроэргов. Например, при недостатке СО2 в клетках будут накапливаться восстановленные формы НАДФ·Н и АТФ, так как не будет происходить их отток на синтез фосфолирированных сахаров и других продуктов цикла Кальвина. При нехватке азота будет остановлен синтез аминокислот, полипептидов, биосинтез будет направлен в сторону образования углеводов и липидов за счет энергии макроэргов. В случае отсутствия света, макроэрги будут находиться в окисленных формах НАДФ+ и АДФ, поступление энергии для биосинтеза возможно только за счет внутриклеточных запасных веществ, к которым, в первую очередь, относятся углеводы. Экспериментально обнаружено, что за ночь содержание углеводов в органической массе спирулины уменьшалось почти вдвое, с 34 до 19%, а содержание белка увеличивалось с 57 до 71% при незначительном уменьшении доли липидов (Torzillo et al., 1991). В течение дня пропорции биохимических компонентов клеток возвращались к исходным величинам. Аналогичные данные были получены и для планктонных водорослей, причем авторы наблюдали прямую корреляцию между уменьшением углеводов и скоростью дыхания (Markager, Sand-Jensen, 1989).
Количественные характеристики роста культуры микроводорослей Количественная оценка экспериментальных результатов подразумевает расчет или определение конкретных параметров роста микроводорослей. К основным ростовым параметрам можно отнести продуктивность культуры или скорость роста (валовая, средняя, максимальная), темп деления или удельная скорость роста, максимальная биомасса при накопительном культивировании, удельная скорость поддержания (эндогенного расхода), экономический коэффициент или потребность клеток в субстрате. Среди встречающихся в литературе биохимических параметров отметим концентрацию, содержание, продукцию (скорость синтеза) какого-либо компонента биомассы. К энергетическим параметрам отнесем эффективность преобразования световой энергии клетками (КПД фотобиосинтеза), интегральный коэффициент поглощения энергии и пр. Величина КПД фотобиосинтеза – ключевой параметр роста культуры микроводорослей, который определяется количеством поглощенной клетками энергии, т.е. спектральными характеристиками культуры микроводорослей, а также приростом биомассы с учетом её калорийности. Несмотря на то, что исследования зависимости КПД фотобиосинтеза микроводорослей начаты еще со второй половины прошлого века, до сих пор нет четкого ответа на вопрос, где теряется большая часть запасенной при фотосинтезе энергии. Согласно литературным данным КПД достигает 15% и имеет сложный характер зависимости от поверхностной облученности культуры (Белянин, 1984).
Классические подходы к моделированию роста микроводорослей Одним из главных принципов, определяющих подход к разработке теоретических основ роста, является положение о том, что синтез органического вещества (а, соответственно, и рост организма) происходит за счет биохимических реакций с участием ферментов, каждый из которых контролируется отдельным геном. Это положение впервые четко сформулировано Дж. Бидлом и Э. Татумом в виде гипотезы и считается одним из основных обобщений биологии (Вилли, Детье, 1975). Из схемы «один ген – один фермент – одна биохимическая реакция» вытекает, что кинетическая теория роста микроводорослей должна обязательно включать элементы теории управления и кинетики ферментативного катализа. С другой стороны, современные достижения в области генетической инженерии позволяют заблокировать транскрипцию заданного гена, что приведет к «отключению» того или оного фермента, а, следовательно, биосинтез может быть направлен в нужную сторону. Другой основной принцип, являющийся одним из фундаментальных законов экологии, это принцип минимума, или принцип лимитирующих факторов (принцип Либиха, «бочка» Либиха) (Liebig, 1847). Принцип был открыт для сельскохозяйственных растений: Ю. Либих показал, что величина урожая определяется тем питательным веществом, содержание которого в почве минимально. Применительно к микроводорослям, принцип наглядно демонстрируется при работе с накопительной (периодической) культурой. Например, если питательная среда с учетом экономического коэффициента рассчитана по углероду на 4 г, по азоту на 3 г, а по фосфору на 2 г биомассы, то максимальная плотность накопительной культуры не может превышать 2 г/л. В середине двадцатого века в микробиологии Моно ввел понятие «узкого места» метаболизма (Monod, 1949). Это позволяет выделить главный фактор, в целом определяющий рост микроводорослей. Вместе с принципом смены лимитирующих факторов (принципом Блэкмана) (Blackman, 1905), принцип «узкого места» дает возможность не только формально описать рост микроводорослей (в тех или иных внешних условиях среды), но и позволяет использовать редукцию системы уравнений, т.е. сделать это с помощью минимального числа относительно простых уравнений. Применительно к ферментативной кинетике этот принцип формулируется как определяющее звено в цепи ферментативных реакций (Романовский и др., 1975). Развитие концепции «узкого места» метаболизма было предложено в работе Р.П. Тренкеншу (Тренкеншу, 2005). В данной работе рассматриваются наиболее простые представления об организации «узкого места» метаболизма. Задачи биокинетики сформулированы в терминах теории массового обслуживания. В качестве примера, иллюстрирующего возможности такого подхода, рассмотрим зависимость скорости синтеза лимитирующей составляющей биомассы от величины потока элементов питания, поступающего в клетку из внешней среды. При лимитировании роста светом продуктивность будет ниже максимальной и будет определяться величиной приведённой плотности потока квантов в клетку λ. По определению, эта величина показывает количество единиц элементов питания, поступающих на каждую единицу лимитирующего звена, за время, равное времени оборота лимитирующего звена. Заметим, что приведённая плотность потока питания является безразмерной величиной. Учитывая, что время оборота представляет собой величину, обратную активности этой единицы (в нашем случае, μе), для приведённой плотности потока можно записать:
где In – плотность потока квантов фотосинтетически активной радиации (ФАР), квант/(м2·с); В случае светового лимитирования нормированные скорости роста определяются приведённой плотностью потока энергетического субстрата λ:
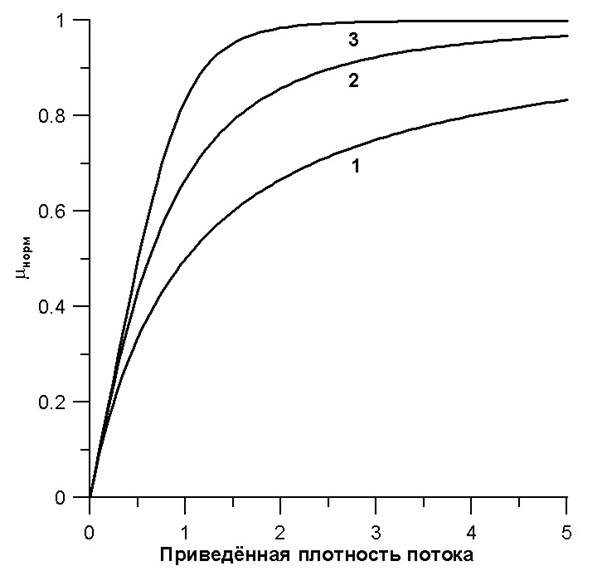
На рис. 2 приведены кривые зависимости удельной скорости роста (μнорм) от приведённой плотности потока квантов ФАР, представленные в нормированном виде, для различных емкостей субстратного депо. Под субстратным депо понимается некоторая область, в которой молекула субстрата может «ожидать» освобождения фермента, если последний в момент её появления был занят. Представление кинетических зависимостей в нормированном виде позволяет сделать оценку организации лимитирующего звена по характеру кривых. В частности, характер кривых определяется емкостью депо элементов питания или промежуточных продуктов в метаболической цепи перед лимитирующим звеном. На рис. 2 видно, что клетки с лучшей организацией метаболических систем (емкость депо выше) при равных потоках питания растут быстрее, и с большей эффективностью используют этот поток.
Рис. 2. Типичные формы зависимости удельной скорости роста от приведённой плотности потока квантов ФАР (1, 2, 3 – емкость субстратного депо) Fig. 2. Typical patterns of growth rate dependence on reduced density of photons flux
Метод линейных сплайнов (метод касательных) Внутренняя организация «узкого места» метаболизма определяет характер зависимости скорости процесса от приведённой плотности потока: чем лучше организована система, тем ближе эта зависимость к ломаной. Самой низкопродуктивной организации соответствует гиперболическая зависимость, выражаемая уравнением Михаэлиса-Ментен. Идеализированная модель взаимосвязи скорости (удельной скорости) синтеза биомассы с λ для светового или минерального ограничения будет иметь вид: Достоинством предлагаемого подхода является четкое определение точки смены лимитирующего фактора или звена, если рассмотреть поток субстрата внутри клетки. В окрестностях этой точки возможны отклонения экспериментальных данных от идеализированной ломаной. Для повышения точности описания экспериментальных данных возможно разбить кривую на большее количество участков, каждый из которых опишем линейным сплайном. Метод линейных сплайнов, или метод касательных, широко применяется во многих науках, позволяя описать сложные процессы простыми уравнениями. Общее уравнение (1) может быть записано как для внешних потоков, так и для потоков лимитирующего субстрата на ключевой фермент внутри клетки (Тренкеншу, Лелеков, 2018). Вычленим в общей биомассе (B) клетки две основные макромолекулярные формы – структурную (Bstr) и резервную (Bres):
Скорость синтеза структуры определяется количеством ресурсной биомассы, а также активностью ключевого фермента. Скорость образования ресурсных составляющих определяется приведённой плотностью потока внешнего субстрата. Если скорость синтеза некоторых промежуточных соединений (интермедиатов) выше скорости образования структуры, то в клетке будут накапливаться резервные соединения, в противном случае количество интермедиатов будет уменьшаться. Обозначим через ε величину соотношения структурной и резервной биомассы:
Таким образом, если соотношение ε больше либо равно некоторому насыщающему значению ε ≥ εsat, скорость синтеза структуры будет максимальна, при ε < εsat, скорость будет линейно зависеть от ε: где qrs – экономический коэффициент преобразования резервной биомассы в структурную. Скорость образования резервной составляющей биомассы будет определяться приведённой плотностью потока субстрата λ согласно (1). Отметим, что уравнения (1) и (2) эквивалентны, однако (1) отражает суть лимитированного роста, в то время как (2) – удобная в практическом плане форма записи через определяемую биохимически величину ε.
Экспоненциальная фаза роста. Плотностат В случае нелимитированного роста, когда приведённые плотности потока минерального и светового субстрата больше либо равны единице, будут реализованы максимальные скорости синтеза биомассы. Максимальные скорости могут реализоваться только при всех благоприятных физико-химических условиях среды (температура, рН, полное минеральное и световое обеспечение и т.д.). Максимальная скорость синтеза биомассы пропорциональна общему количеству ключевого фермента (или переносчика), т.е. самой биомассе: где φ0 – максимальная эффективность преобразования энергии макроэргов в химическую энергию биомассы; Величина максимальной скорости синтеза биомассы не может являться независимым параметром для характеристики роста, т.к. зависит от количества биомассы. Подобного недостатка лишена максимальная удельная скорость роста: Из (4) видно, что максимальная удельная скорость роста определяется содержанием ключевого фермента или переносчика в клетке, участвующего в реакциях энергообмена. В кинетическом смысле данная характеристика количественно отражает понятие, называемое в биокинетике лимитирующим звеном или «узким местом» метаболизма. Для реализации максимальной удельной скорости величина f должна быть максимальной и постоянной, из чего можно сделать вывод о неизменности биохимического состава клеток. Максимальные скорости синтеза биомассы, строго говоря, не могут быть реализованы в условиях накопительной культуры вследствие постоянно изменяющегося светового обеспечения. Даже для небольших плотностей, когда клетки микроводорослей не затеняют друг друга, может происходить изменение биохимического состава из-за адаптации культуры к новым физико-химическим условиям. Собственно экспоненциальный рост начинается с момента окончания адаптации клеток к новым условиям. Устойчивый экспоненциальный рост клеток микроводорослей без светового и минерального лимитирования возможен только в плотностате. Наличие системы контроля плотности культуры позволяет подобрать такой режим выращивания микроводорослей, при котором плотность культуры до и после разбавления будут практически одинаковы. Таким образом, возможно получить непрерывный стационарный динамический процесс, который позволяет исследовать влияние главного фактора среды – световых условий.
Линейная фаза роста. Хемостат Многочисленными экспериментальными исследованиями показано, что рост микроводорослей в накопительной культуре характеризуется наличием линейного участка (линейная фаза роста). Этот участок имеет относительно большую протяженность во времени, а плотность культуры иногда увеличивается в десятки раз. Такой рост связан с постоянством скорости продукции биомассы. Ранее показано (Тренкеншу и др., 2018), что изменяющиеся световые условия по-разному воздействуют на скорости синтеза тех или иных биохимических составляющих клеток, приводя в итоге к постоянству скорости роста. При этом удельная скорость роста определяется количеством поглощенной биомассой энергии. Отметим, что подобное явление характерно только при выращивании микроводорослей в плоскопараллельных культиваторах. Также возможен вариант, когда наличие линейной фазы свидетельствует о лимитировании роста углекислым газом, причем скорость синтеза биомассы определяется приведённой плотностью потока углекислого газа на рибулозобисфосфаткарбоксилазу – ключевой фермент цикла Кальвина. Постоянство скорости роста культуры позволяет значительно упростить математическую обработку экспериментальных данных. В области линейного роста возможно исследовать влияние того или иного фактора среды на фотобиосинтетические процессы клеток. Для этого обычно применяется хемостатный метод культивирования, когда в фотобиореактор непрерывно подается питательная среда и отбирается культура. Скорости подачи среды и отбора культуры должны быть равны, что обеспечивает постоянство объема суспензии. В таких условиях с течением времени устанавливается стационарное динамическое равновесие, при котором плотность культуры не изменяется. В фотореакторе остаются те клетки, которые наиболее приспособлены к данным условиям, остальные будут удалены вместе с протоком. Важным свойством стационарного состояния является равенство удельных скоростей синтеза всех клеточных компонентов и удельной скорости протока.
Заключение Перечисленные в данной работе фундаментальные принципы являются парадигмой, которая лежит в основе разработки кинетической теории роста микроводорослей. Оперируя данным инструментарием, возможно математически описать световые и темновые реакции фотобиосинтеза, что позволит определить видоспецифические коэффициенты моделей, выявить ключевые закономерности их взаимосвязи, а значит получить новые знания о росте микроводорослей. При этом математическая строгость теории должна быть дополнена конкретными примерами возможности её упрощения для практического использования в анализе экспериментальных данных и построения прогностических моделей роста микроводорослей при заданных начальных условиях культуры и внешней среды.
Работа выполнена в рамках госзадания ФГБУН ИМБИ по теме «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации АААА-А18-118021350003-6).
Список литературы
Статья поступила в редакцию 17.10.2018
Basic principles of modeling microalgae's photobiosynthesis Alexander S. Lelekov, Rudolf P. Trenkenshu Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) The paper lists the classic and modern views on the microalgae's culture growth, which constitute a new paradigm of modeling photobiosynthesis. Microalgae are considered as lower obligate photoautotrophs capable of oxygenic photosynthesis, characterized by the separation of photochemical and enzymatic processes. A model scheme of the light and dark reactions conjugation in microalgae is proposed. The process of biosynthesis of cell biochemical structures from minerals is carried out due to the energy of high-potential forms of high-energy compounds (NADP·H, ATP). It is shown that the microalgae's growth can be considered as a set of energy-exchange reactions. The concept of the absence of limiting microalgae's growth by environmental factors is proposed. The rate of biomass synthesis is determined by the reduced flow density of the energy or plastic substrate to the key enzyme. Also, for convenience in practical terms, productivity can be expressed through the biochemical measured ratio of structural and reserve forms of biomass. In any case, the dependence of the rate of biomass synthesis on the value of the reduced flux density is described by linear splines, which allows you to clearly set the switching point of the limiting factor and obtain simple mathematical solutions. Key words: microalgae's culture; the rate of biomass synthesis; limited growth; reduced flow density of the substrate flux; a method of linear splines; turbidostat; chemostat.
Об авторах Лелеков Александр Сергеевич – Lelekov Alexander S. кандидат биологических наук a.lelekov@yandex.ru Тренкеншу Рудольф Павлович – Trenkenshu Rudolf P. кандидат биологических наук r.trenkenshu@rambler.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ: Лелеков А.С., Тренкеншу Р.П. Фундаментальные принципы моделирования фотобиосинтеза микроводорослей // Вопросы современной альгологии. 2018. № 3 (18). URL: http://algology.ru/1368 DOI - https://doi.org/10.33624/2311-0147-2018-3(18)-1-10 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||