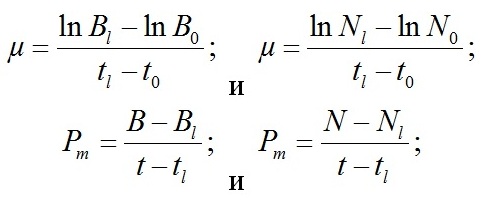|
|
|
Репродуктивная активность клеток Dunaliella viridis Teod. при разном углеродном обеспечении в накопительной культуре
Меметшаева О.А. Olga A. Memetshaeva
Институт морских биологических исследований им. А.О. Ковалевского РАН
УДК 582.263:581.4
Исследована репродуктивная активность клеток микроводорослей Dunaliella viridis при накопительном культивировании. Установлено, что средняя доля делящихся клеток при дополнительном углеродном обеспечении была выше, чем при его отсутствии (в среднем в 1,7 раза), и менялась в зависимости от фазы роста культуры. При этом доля мертвых клеток преобладала в условиях углеродного лимитирования и по окончании эксперимента оказалась в 2,9 раз выше по сравнению с контрольным вариантом. Ключевые слова: Dunaliella viridis; углеродное лимитирование; численность клеток; деление; накопительная культура.
Введение Dunaliella viridis Teod. – широко распространенный, легко культивируемый вид, обитающий в морях и соленых озерах (Боровков, 2005). Как и другие представители рода, является природным источником каротиноидов, глицерина, липидов и многих других биологически активных соединений (Teodoresco, 1905; Масюк, 1973; Ben-Amotz et al., 1989; Oren, 2005). Для Dunaliella характерны вегетативный, бесполый и половой тип размножения, первый является преобладающим (Лось и др., 1990; Масюк и др., 2007). Отсутствие целлюлозной и пектиновой оболочки и наличие тонкой бесцветной протоплазматической мембраны позволяет рассмотреть органеллы клетки и зафиксировать размножение на ранней стадии. Для обеспечения активного роста культуры и деления клеток Dunaliella viridis, как и любых других фототрофов, необходим достаточный уровень элементов минерального питания в среде – биогенных элементов (Антоненко и др., 2010; Preetha et al., 2012). Одним из основных элементов, оказывающим влияние на функциональное состояние, характер метаболизма, активность фотосинтетических процессов, рост и развитие микроводорослей, является углерод (Минюк и др., 2016; Garnier et al., 2016). В связи с этим целью данной работы являлось исследование влияния углеродного лимитирования на репродуктивную активность и физиологическое состояние клеток Dunaliella viridis Teod. при накопительном культивировании.
Материал и методы В исследовании использовали альгологически чистую культуру водоросли Dunaliella viridis var. palmelloides Teod. – штамм IMBR-5 из ЦКП «Коллекция гидробионтов Мирового океана» ФГБУН «Институт морских биологических исследований имени А.О. Ковалевского РАН». Культивирование осуществляли в накопительном режиме на питательной среде Тренкеншу (Тренкеншу, 1984). Выращивание микроводорослей проводили на лабораторной установке для культивирования низших автотрофов (Тренкеншу и др., 2017) в стеклянных фитобиореакторах плоскопараллельного типа объемом 1 л с толщиной слоя культуры 2 см при круглосуточном искусственном освещении. Освещенность рабочей поверхности культиваторов была одинаковой и составила 10 кЛк. Температуру поддерживали на уровне 26±1,5ºС. В процессе выращивания культуры непрерывно барботировали воздухом с помощью компрессорной установки. В опытном варианте, в отличие от контрольного, из баллона производилась дополнительная подача 3% СО2 от объема подаваемого воздуха. Перед проведением измерений в фотобиореакторы добавляли дистиллированную воду с целью компенсации испарения воды. Отбор проб проводился ежедневно, в двух повторностях по 5 мл. Биомассу (абсолютно сухой вес – АСВ) вычисляли, используя коэффициент перехода от оптической плотности k = 0,8 г/л ед. опт. пл., АСВ = k × D750 (Боровков, 2008). Оптическую плотность рассчитывали по формуле: D = -lg(T), где Т – величина пропускания, определяемая на фотоэлектроколориметре КФК-2 при длине волны 750 нм, погрешность измерения величины пропускания не превышала 1%. Численность клеток (N∙106 кл/мл) подсчитывали в камере Горяева БКГ-4 (Сиренко, 1975), определение живых и мертвых клеток зеленых водорослей проводили по методике окрашивания красителем метиленовым синим (Сиренко, 1975). Удельную скорость роста (µ) и максимальную продуктивность (Pm) культуры микроводорослей рассчитывали с учетом АСВ и N:
где Bl и B0 – значения абсолютно сухого веса, Nl и N0 – значения численности клеток, tl и t0 – соответствующее время роста. Статистическую обработку данных выполняли с помощью стандартных программных пакетов Microsot Excel. Рассчитывали средние арифметические (x̅), стандартные отклонения (S), ошибку средней, доверительные интервалы для средних (Δ x̅). Все расчеты проводили для уровня значимости α = 0,05. В тексте и графиках представлены средние значения и рассчитанные доверительные интервалы (x̅ ±Δ x̅) (Лакин, 1990).
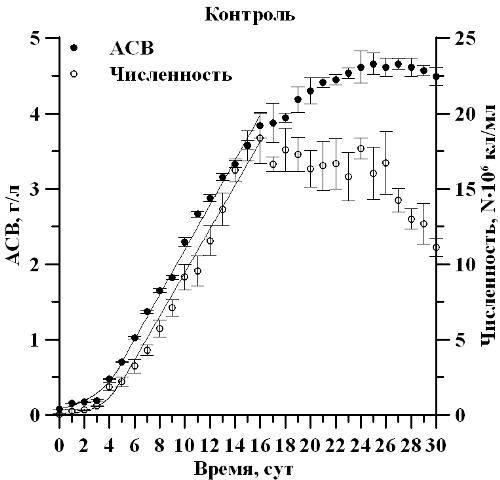
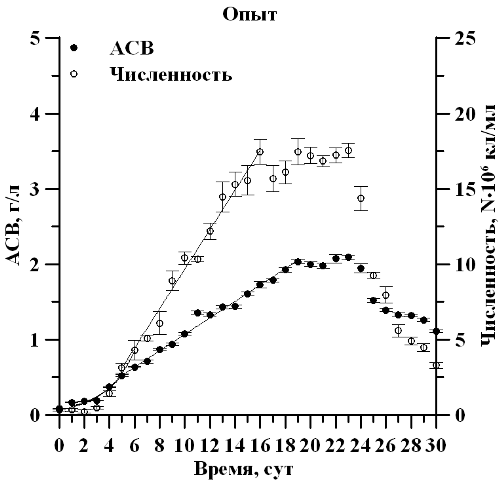
Результаты и обсуждение В ходе накопительного культивирования продолжительность экспоненциальной фазы роста по биомассе и репродуктивной активности культуры наблюдалась с 1 по 5 сутки эксперимента в двух вариантах опыта (рис. 1). Удельная скорость роста µ по АСВ, составила 0,43 сутки-1 при дополнительном углеродном обеспечении и 0,37 сутки-1 при его недостатке, при этом µ по численности клеток составила 0,74 сутки-1 и 0,42 сутки-1 соответственно, что в 1,8 раза выше. Показано, что линейная фаза роста продолжалась с 5 по 16 сутки эксперимента, а в опытном варианте по АСВ до 19 суток. При этом максимальная продуктивность Pm в контрольном варианте составила 0,3 г∙л∙сутки-1, что в 3 раза выше, чем в опытном варианте. В ходе эксперимента определено, что максимальная биомасса Mm составила 4,6 г/л в контрольном и 2 г/л АСВ в опытном варианте, что 2,3 раза выше, при этом максимальная численность клеток существенным образом не отличалась и составила 18,4∙106 кл/мл и 17,6∙106 кл/мл соответственно. Из полученных данных видно, что недостаток углерода снижает накопление биомассы в культуре и при этом не оказывает лимитирующего действия на численность клеток.
Рис. 1. Динамика биомассы и численности клеток D. viridis в накопительной культуре при полном углеродном обеспечении (контроль) и его недостатке (опыт) Fig. 1. The dynamics of biomass and the number of D. viridis cells in a batch culture with complete provision of carbon (control) and its deficiency (experience)
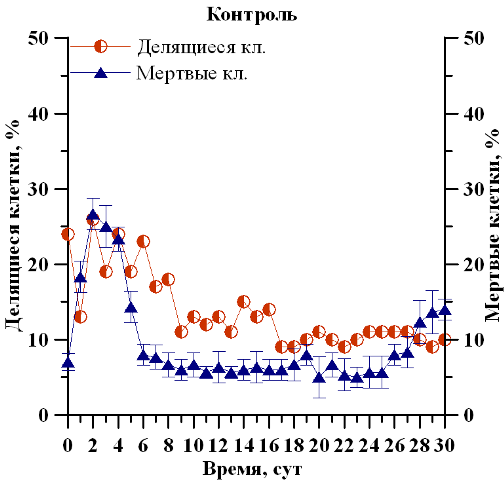
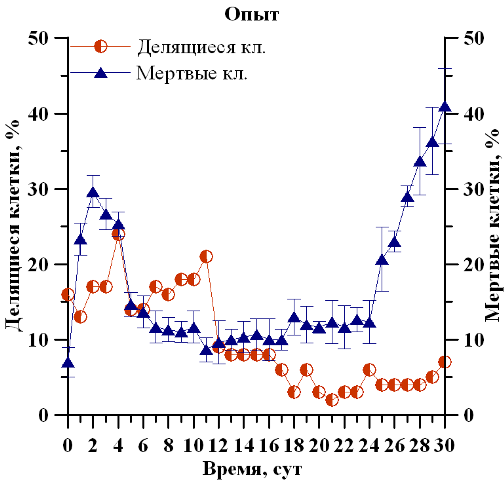
Отмечено изменение физиологического состояния популяции D. viridis, сопровождающееся отслаиванием протопласта от клеточной оболочки, потерей жгутиков и способности к активному движению. Так, средняя доля клеток в репродуктивном состоянии при дополнительном углеродном обеспечении в экспоненциальной фазе роста (с 1 по 5 сутки) составила 21%, что в 1,3 раза выше, чем при его недостатке (16%), а на линейном участке (с 5 по 16 сутки) – 15 и 13% соответственно. С наступлением стационарной фазы и по окончании эксперимента средняя доля делящихся клеток составила 10% в контрольном и 6% в опытном вариантах, что, соответственно, в 2,1 и 2,7 раза ниже по сравнению с экспоненциальным участком (рис. 2). Из полученных данных видно, что снижение доли делящихся клеток приходится на середину линейного участка роста культуры в обоих вариантах исследования, что, вероятно, является следствием лимитирования субстрата и ингибирования метаболитами. Данная закономерность соответствует предыдущим исследованиям (Меметшаева, Боровков, 2018) и согласуется с данными о зависимости удельной скорости роста от плотности культуры и концентрации хлорофилла а (Тренкеншу и др., 2018). Средняя доля мертвых клеток в экспоненциальной фазе роста составила 20% в двух вариантах и на протяжении линейной фазы сократилась до 7% и 10% в контрольном и опытном вариантах соответственно. По окончании эксперимента, вследствие истощения питательной среды, в опытном варианте доля мертвых клеток достигла 41±5%, что в 2,9 раз выше, чем в контрольном варианте – 14±1,4%.
Рис. 2. Динамика доли делящихся и мертвых клеток D. viridis в накопительной культуре при полном углеродном обеспечении (контроль) и его недостатке (опыт) Fig. 2. Dynamics of the percentage of dividing and dead D. viridis cells in a batch culture with complete provision of carbon (control) and its deficiency (experience)
Можно отметить, что снижение доли делящихся и преобладание доли мертвых клеток при углеродном лимитировании связаны со значительными изменениями в физиологии D. viridis, так как без углерода невозможен синтез хлорофилла, а также нуклеиновых кислот. Поэтому в условиях недостатка углерода уменьшается рост и скорость деления микроводорослей.
Заключение В ходе исследования D. viridis при углеродном лимитировании в условиях накопительного культивирования установлено, что продуктивность и максимальная биомасса при дополнительном углеродом обеспечении выше, чем при его отсутствии, в 2,7 и 2 раза соответственно. В то же время недостаток углерода не оказал значительного влияния на численность клеток. Определено, что средняя доля делящихся клеток в контрольном варианте была выше (в среднем в 1,7 раза) на протяжении всего накопительного культивирования по сравнению с опытным вариантом. При этом доля мертвых клеток, наоборот, преобладала в опытном варианте, и по окончании эксперимента оказалась в 2,9 раз выше, чем в контрольном варианте.
Работа подготовлена по теме государственного задания ФГБУН ИМБИ «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса», номер гос. регистрации АААА-А18-118021350003-6».
Список литературы
Статья поступила в редакцию 31.10.2018
Reproductive activity the cells of Dunaliella viridis Teod. with different carbon provision in a batch culture Olga A. Memetshaeva Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) The reproductive activity the cells of microalgae Dunaliella viridis during batch culture were studied. It was established that the mean proportion of dividing cells with additional provision of carbon it was higher on mean 1.7 times than in its lack and varied depending on the growth phase of the culture. At the same time, the proportion of dead cells prevailed under the conditions of carbon limiting and at the end of the experiment was 2.9 times higher compared to the control option. Key words: Dunaliella viridis; limited of carbon; number; density; division; batch culture.
Об авторах Меметшаева Ольга Александровна - Memetshaeva Olga A. ведущий инженер (аспирант), Институт морских биологических исследований им. А.О.Ковалевского РАН, Севастополь, Россия (Kovalevsky Institute of Marine Biological Research of RAS, Russia, Sevastopol), Отдел биотехнологий и фиторесурсов olga.memetshaeva@mail.ru
ССЫЛКА НА СТАТЬЮ: Меметшаева О.А. Репродуктивная активность клеток Dunaliella viridis Teod. при разном углеродном обеспечении в накопительной культуре // Вопросы современной альгологии. 2018. № 3 (18). URL: http://algology.ru/1369 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||||||
|
| ||||||