|
|
|
Влияние скорости разбавления и уровня поверхностной освещенности на продукционные характеристики культуры Porphyridium purpureum (Bory) Ross.
Боровков А.Б., Гудвилович И.Н. Andrey B. Borovkov, Irina N. Gudvilovich
Институт морских биологических исследований имени А.О. Ковалевского РАН
УДК 579:582.26/.27:639.64
Определен характер изменения продукционных характеристик полупроточной культуры P. purpureum при варьировании удельной скорости протока среды и уровня поверхностной освещенности. Экспериментально показано, что количество биогенных элементов, поступающих в культуру P. purpureum при удельной скорости протока среды 0,2 сут-1, а также поверхностной освещенности 50 Вт/м2, достаточно для обеспечения более высокой продуктивности по В-фикоэритрину, которая составляет 52 мг·л-1·сут-1, что на 30% выше, чем для других вариантов эксперимента. Дальнейшее повышение концентрации элементов минерального питания в культуре P. purpureum (увеличение скорости обмена среды) малоэффективно, т.к. фактором, определявшим продукционные характеристики исследованной культуры в эксперименте, являлся световой, что подтверждается полученными экспериментальными данными. Ключевые слова: Porphyridium purpureum; полупроточная культура; плотность культуры; фикобилипротеины; В-фикоэритрин; продуктивность.
Введение Свет является одним из основных факторов, определяющих продукционные свойства культур микроводорослей. Оптимизация процесса получения плотных культур микроводорослей, то есть таких, где единственным фактором, ограничивающим скорость роста, является световой, весьма актуальна для промышленного выращивания биотехнологически ценных видов микроводорослей (Минюк и др., 2008; Цоглин, Пронина, 2013; Тренкеншу, 2017). Красная микроводоросль Porphyridium purpureum (Bory) Ross. (синоним Porphyridium cruentum Näg.) является одним из немногих одноклеточных представителей этой группы, введенных в культуру. С практической точки зрения данный вид может служить источником ряда ценных физиологически активных веществ, в частности пигментов, относящихся к группе фикобилипротеинов (ФБП) (Стадничук, 1990; Borowitzka, 1995; Fabregas et al., 1998; Судьїна и др., 2007). В последнее время P. purpureum все чаще рассматривают как объект для получения биомассы, обогащенной ценными веществами и являющейся сырьем для их выделения. Относительное содержание и продукция этих веществ варьирует в достаточно широком диапазоне в зависимости от условий культивирования P. purpureum (Fabregas et al., 1998; Kathiresan et al., 2006; Гудвилович, Боровков, 2014; Fuentes-Grunewald et al., 2015). Известно, что использование различных методов выращивания (накопительного, непропорционально-проточного, квазинепрерывного/полупроточного), а также варьирование параметров культивирования (скорость разбавления культуры, освещенность, состав питательной среды) значительно меняет скорость роста и направленность биосинтетических процессов в культуре P. purpureum (Упитис и др., 1989; Fabregas et al., 1998; Гудвилович, Боровков, 2014; Fuentes-Grunewald et al., 2015). Важнейшими факторами, определяющими содержание ФБП в клетках порфиридиума, признаны световой фактор и обеспеченность элементами минерального питания, в первую очередь азотом. В ряде работ показано, что концентрация фикоэритрина в клетках P. purpureum непосредственно контролируется наличием азота в культуральной среде. Поэтому культивирование микроводоросли P. purpureum для получения биомассы, обогащенной ФБП, целесообразно осуществлять в полупроточном режиме, т.к. при накопительном выращивании после исчерпания элементов минерального питания в среде содержание этих пигментов в клетках порфиридиума резко снижается (Fabregas et al., 1998; Гудвилович, Боровков, 2014; Fuentes-Grunewald et al., 2015). Следует отметить, что специфический состав пигментов P. purpureum обусловлен морской средой обитания этого вида, так как зеленый свет, преимущественно пропускаемый водой, поглощается В-фикоэритрином, входящим в состав светособирающего комплекса хлоропластов. Основными функциями фикобилипротеинов являются поглощение и передача энергии света хлорофиллу, а их содержание в пластидах регулируется интенсивностью светового потока (Jahn et al., 1984; Стадничук, 1990; Algarra, Ruediger, 1993). Изучению влияния условий культивирования на рост данной микроводоросли, а также особенностей накопления фикобилипротеинов в клетках посвящен ряд исследований, однако данные по продуктивности P. purpureum при высокой рабочей плотности культуры не очень многочисленны. Поэтому целью работы являлось изучение влияния поверхностной освещенности на накопление В-фикоэритрина и его продукцию в полупроточной культуре P. purpureum при различной скорости роста.
Материалы и методы Работы выполняли на базе отдела Биотехнологий и фиторесурсов ФГБУН ИМБИ, г. Севастополь. Объект исследования – красная микроводоросль Porphyridium purpureum (Bory) Ross (синоним Porphyridium cruentum Näg.) штамм IMBR-70 из ЦКП «Коллекция гидробионтов Мирового океана» ФГБУН ИМБИ, её выращивание осуществляли на питательной среде по (Тренкеншу и др, 1981). Культуру P. purpureum выращивали в установке, которая состояла из 4 фотобиореакторов, системы подачи газо-воздушной смеси, термостабилизирующей системы и системы освещения. Каждый фотобиореактор представлял собой емкость из стекла размером 5×25×50 см (плоскопараллельный тип) с рабочей толщиной 5 см. В газораспределительную систему с помощью системы дозирования (ротаметр) подавался углекислый газ из баллона; процентное содержание углекислоты в смеси составляло 2–3% (v/v). Полученная газовоздушная смесь поступала в фотобиореактор, таким образом осуществлялось перемешивание культуры, средняя скорость продувки газовоздушной смеси составляла 0,5 л·мин-1·л-1 культуры. На протяжении всего эксперимента рН среды поддерживался на уровне 8–9 ед, температура – 26–28°С. В качестве осветителя использовали лампы ДРЛ-700; средняя поверхностная освещенность составляла для двух культиваторов 50 Вт/м2 и 150 Вт/м2 для двух других.
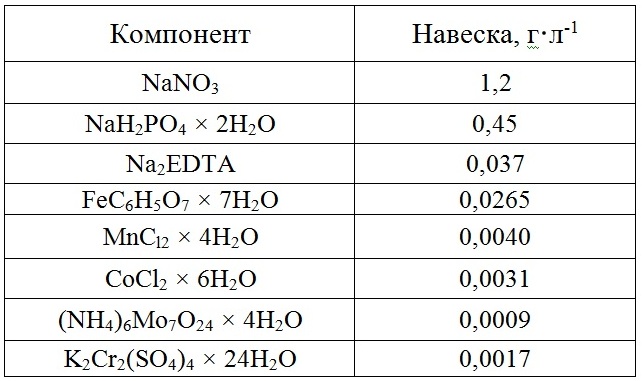
Таблица 1. Среда по (Тренкеншу и др., 1981), используемая для культивирования P. purpureum Table 1. The nutrient medium by (Trenkenshu et al., 1981) for P. purpureum cultivation
Культуру P. purpureum выращивали методом полупроточного (квазинепрерывного) культивирования, удельная скорость протока среды в экспериментальных культиваторах составляла 0,2 и 0,4 сут-1. Квазинепрерывную (полупроточную) культуру получали путем периодической замены части суспензии микроводоросли равноценным объемом свежеприготовленной среды. Каждые 24 часа из культиваторов отбирали 20 или 40% культуры по объему (ω = 0,2 и 0,4 сут-1 соответственно) и заменяли его равноценным объемом свежей среды. Инокулят вносили в культиваторы с таким расчетом, чтобы начальная плотность во всех вариантах опыта была одинаковой. Содержание сухого вещества в культуре (СВ) определяли объемно-весовым (Тренкеншу, Белянин, 1979) и весовым методами (Методы … , 1975). Пробы для определения содержания пигментов и белка отбирали при достижении культурой стационарного динамического равновесия. Содержание В-фикоэритрина (В-ФЭ) определяли спектрофотометрическим методом (Стадничук, 1990), а белка по (Lowry et al., 1951). Для количественного определения В-ФЭ в биомассе P. purpureum проводили ее экстракцию фосфатным буфером (0,05 М; рН=7–7,5). Спектры экстрактов пигментов промеряли на регистрирующем спектрофотометре СФ-2000 в диапазоне длин волн 400–800 нм с шагом 0,1 нм. Регистрировали оптическую плотность полученных экстрактов в области характеристических максимумов поглощения В-фикоэритрина (545 нм), R-фикоцианина (615 нм) и аллофикоцианина (650 нм), а также при 750 нм (для учета неспецифического поглощения раствора). Концентрацию пигментов в водном экстракте рассчитывали по (Стадничук, 1990), используя значения оптической плотности для соответствующих длин волн. Рассчитывали средние арифметические
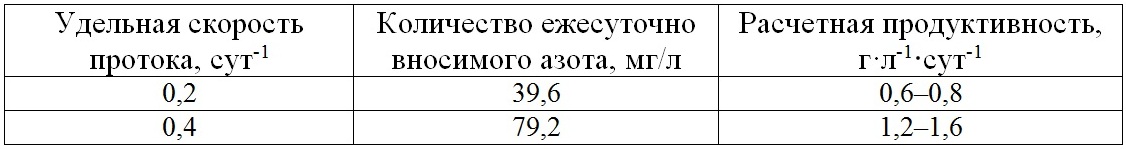
Результаты и их обсуждение Оптимизация режима получения высокопродуктивных культур микроводорослей достигается за счет повышения эффективности использования культурой биогенных элементов и световой энергии. Используемая в опыте питательная среда по содержанию азота расcчитана на получение 3–4 г биомассы микроводоросли P. purpureum с 1 л культуры (Тренкеншу и др, 1981; Упитис и др., 1989). С повышением удельной скорости протока среды от 0,2 до 0,4 сут-1 происходило пропорциональное увеличение (в 2 раза) количества биогенных элементов, поступающих ежесуточно в культуру P. purpureum, и, соответственно, увеличивалось расчетное значение продуктивности (табл. 2).
Таблица 2. Расчетная продуктивность для полупроточного культивирования P. purpureum Table 2. The calculated productivity for P. purpureum semicontinuous cultivation
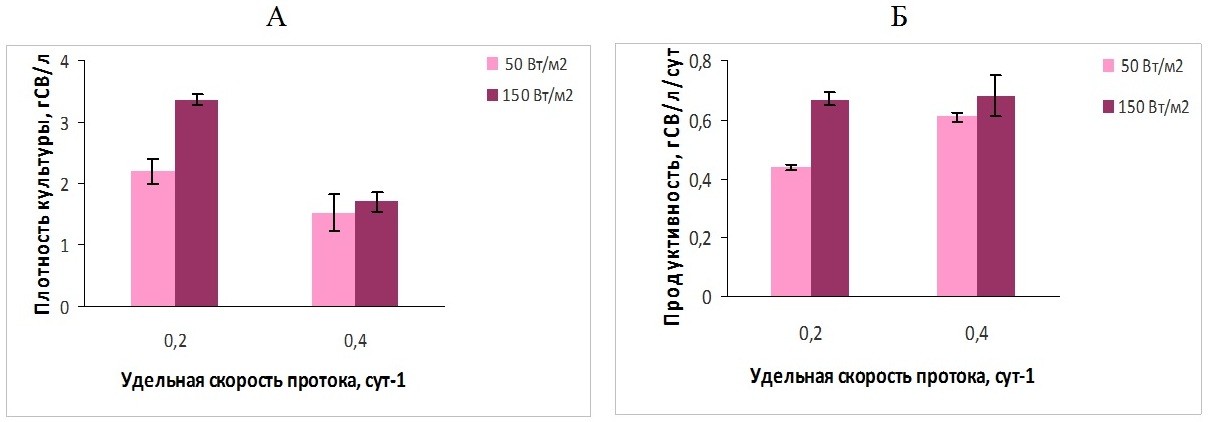
При полупроточном выращивании культуры P. purpureum стационарное динамическое равновесие устанавливалось на 3–4 сутки. Плотность культуры уменьшалась по сравнению с первоначальной и стабилизировалась в соответствии с заданными параметрами освещенности и ежесуточного обмена среды; выход биомассы P. purpureum (продуктивность) складывался из ежедневных отборов культуры (20 и 40% от объема культиватора соответственно) (рис. 1).
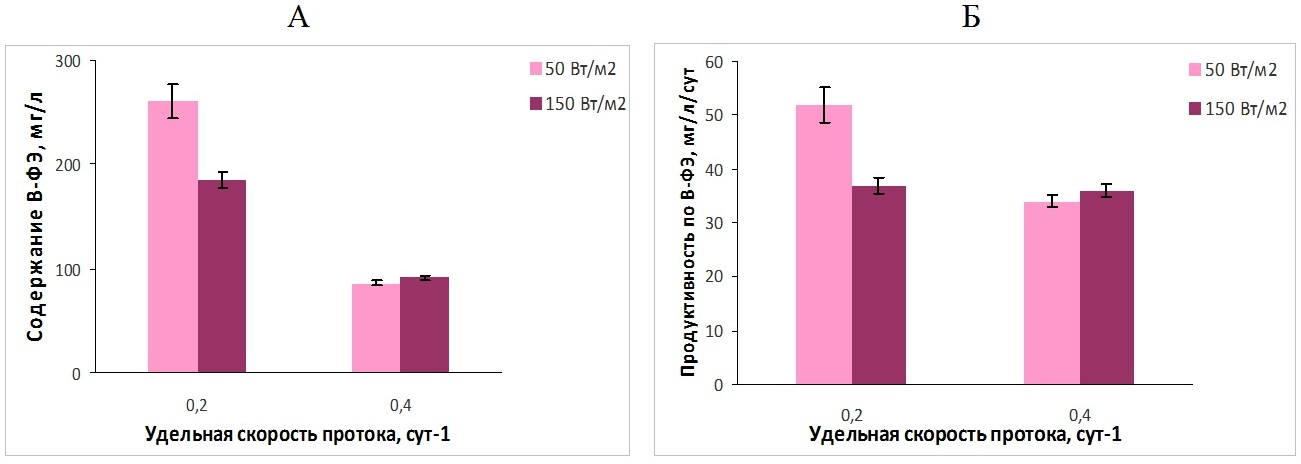
Рис. 1. Плотность (А) и продуктивность полупроточной культуры P. purpureum (Б) при различной освещенности Так, при увеличении скорости протока в 2 раза (от 0,2 до 0,4 сут-1) плотность культуры P. purpureum снижалась в 1,5 и 2 раза соответственно для освещенности 50 и 150 Вт/м2. При ежесуточном обмене 20% плотность культуры увеличивалась (с ростом поверхностной освещенности) в 1,5 раза, а при 40% – наблюдалась некоторая тенденция к увеличению (рис. 1А). Что касается продуктивности культуры P. purpureum, то она увеличивалась с ростом поверхностной освещенности от 50 до 150 Вт/м2, однако если при удельной скорости протока 0,2 сут -1 продуктивность выросла в 1,5 раза, то при скорости протока 0,4 сут-1 её прирост был менее значителен (13%) (рис. 1Б). При скорости протока среды ω=0,2 сут-1 наблюдаемая продуктивность культуры при 150 Вт/м2 соответствовала расчетным значениям получения биомассы с 1 л культуры в сутки, а при более низкой освещенности была ниже расчетных значений в 1,4–1,8 раза (см. табл. 2, рис. 1Б). При постоянном ежесуточном обмене продуктивность культуры P. purpureum может определяться уровнем освещенности клеток культуры, вызывающим либо увеличение скорости роста культуры, либо его ингибирование (Упитис и др., 1989). В эксперименте при увеличении скорости протока среды от 0,2 до 0,4 сут-1 плотность культуры снижалась для двух вариантов поверхностной освещенности, поэтому удельная освещенность клеток должна была увеличиться. Для варианта эксперимента с низкой освещенностью это привело к повышению продуктивности в 1,4 раза, следовательно, при 20% обмене и освещении 50 Вт/м2 рост культуры лимитировался световыми условиями. В случае более высокой поверхностной освещенности повышение удельной освещенности клеток культуры при переходе от 20 к 40% обмену не привело к заметным изменениям продуктивности, что, по-видимому, свидетельствует о негативном влиянии высокой освещенности на физиологическое состояние клеток порфиридиума, либо о влиянии генетических особенностей данного вида, как представителя морской флоры. Это подтверждается полученными ранее данными по культивированию P. purpureum в диапазоне скоростей протока 0,1–0,4 сут-1 при постоянном уровне поверхностной освещенности: в этих условиях увеличение количества элементов минерального питания, поступающих в культуру, приводило к значительному повышению продуктивности P. purpureum (1,9 раза) при повышении скорости протока от 0,1 до 0,2 сут-1, дальнейшее повышение скорости протока не оказывало значительного влияния на продуктивность культуры. Таким образом, количество биогенных элементов, поступающее в культуру при 20% обмене среды, достаточно для поддержания высоких скоростей роста P. purpureum, а ограничивающим фактором является уровень освещенности клеток культуры, при дальнейшем повышении доли обмениваемой среды увеличения продуктивности не выявлено (Гудвилович, Боровков, 2014). Кроме стабилизации плотности культуры при полупроточном выращивании микроводоросли наблюдалась стабилизация содержания В-ФЭ в культуре P. purpureum (рис. 2А), т.к. условия по минеральному обеспечению и освещенности не меняются, когда культура достигает состояния стационарного динамического равновесия (Тренкеншу, 2017). При выявлении оптимальных условий для накопления ценных веществ важнейшим показателем является продуктивность культуры по целевому компоненту. Полученные экспериментальные данные позволили рассчитать продуктивность полупроточной культуры P. purpureum по В-ФЭ при различной поверхностной освещенности культиваторов (рис. 2).
Рис. 2. Содержание В-фикоэритрина (А) и продуктивность полупроточной культуры P. purpureum по В-фикоэритрину (Б) при различной освещенности Fig. 2. B-phycoerythrin content (А) and productivity of P. purpureum semicontinuous culture
При квазинепрерывном режиме выращивания происходит систематическое внесение биогенных элементов в культуру, и с увеличением удельной скорости протока количество азота и фосфора, вносимого в культуру, пропорционально увеличивается, обеспечивая поддержание клеток в культуре в вегетативном состоянии. Известно, что продукция ФБП зависит как от скорости роста культуры, так и от содержания данных пигментов в клетках микроводоросли (Fabregas et al., 1998; Гудвилович, Боровков, 2014). Наибольшая продуктивность по В-ФЭ полупроточной культуры P. purpureum зарегистрирована для варианта эксперимента с поверхностной освещенностью 50 Вт/м-2 (0,2 сут-1). Показано, что повышение поверхностной освещенности в 3 раза (от 50 до 150 Вт/м2) при ежесуточном обмене 20% приводит к снижению как содержания В-ФЭ в культуре P. purpureum, так и продуктивности по данному пигменту на 30%, что объясняется ответом фотосинтетического аппарата данного вида на изменение световых условий в культуре. Аналогичное повышение поверхностной освещенности при увеличенной в 2 раза удельной скорости протока среды не приводит к заметному изменению продуктивности порфиридиума по В-ФЭ, что свидетельствует о некотором угнетении как роста культуры, так и биосинтеза ФБП уровнем освещенности клеток. Изменение световых условий отражалось не только на содержании и продукции В-ФЭ, но и на доле пигмента в общем содержании белка в культуре P. purpureum (рис. 3).
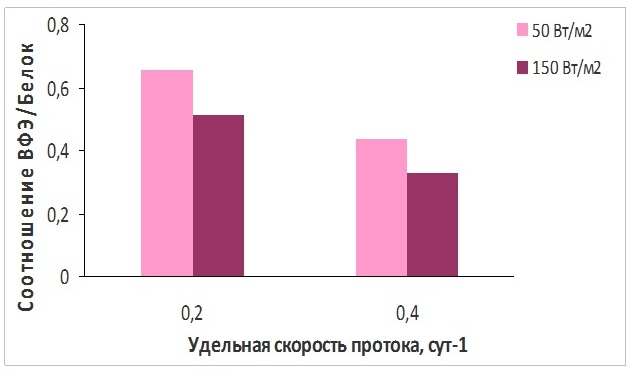
Рис. 3. Соотношение В-фикоэритрин/белок полупроточной культуры P. purpureum при различной освещенности Fig. 3. B-phycoerythrin/protein ratio of P. purpureum semicontinuous culture under the different level of surface irradiance
Показано, что для вариантов эксперимента как с низкой, так и с высокой освещенностью доля В-ФЭ в общем белке снижалась с увеличением скорости протока среды, и, соответственно, с уменьшением плотности культуры, т.е. с увеличением освещенности клеток P. purpureum (см. рис. 1А). Максимальное значение для соотношения В-ФЭ/белок зарегистрировано для варианта с минимальной освещенностью (50 Вт/м2, 20% обмен среды), а минимальное – для варианта с максимальной освещенностью (150 Вт/м2, 40% обмен среды), что согласуется с литературными данными о деградации В-ФЭ с ростом освещенности клеток (Jahn et al., 1984; Algarra, Ruediger, 1993). Таким образом, количества биогенных элементов, поступающих в культуру P. purpureum при удельной скорости протока среды 0,2 сут-1 и поверхностной освещенности 50 Вт/м2, достаточно для обеспечения высокой продукции В-ФЭ, которая на 30% выше, чем для других вариантов эксперимента. Дальнейшее повышение концентрации элементов минерального питания в культуре P. purpureum (скорости обмена среды) малоэффективно, так как основным фактором, определявшим продукционные характеристики исследованной культуры, являлся световой, что подтверждается полученными экспериментальными данными.
Заключение Определены продукционные характеристики полупроточной культуры P. purpureum при варьировании удельной скорости протока среды и поверхностной освещенности; показано, что данные параметры культивирования оказывали значительное влияние на продуктивность исследованного вида. Повышение поверхностной освещенности в 3 раза (от 50 до 150 Вт/м2) при квазинепрерывном выращивании P. purpureum (ω=0,2 сут-1) оказывало разнонаправленное действие на скорость роста культуры и продуктивность по В-фикоэритрину. Продуктивность исследованного вида по биомассе повышалась в 1,9 раза, а по В-фикоэритрину снижалась на 30%, что объясняется ответом фотосинтетического аппарата P. purpureum на различный уровень облученности клеток в культуре. Аналогичное повышение поверхностной освещенности при увеличенной в 2 раза удельной скорости протока среды не приводит к заметному изменению продуктивности, что свидетельствует о некотором угнетении как роста, так и биосинтеза В-фикоэритрина уровнем освещенности клеток. Таким образом, в условиях эксперимента основным фактором, определяющим продукционные характеристики культуры P. purpureum, являлся световой, что нужно учитывать при его интенсивном культивировании.
Работа выполнена в рамках темы Госзадания ФГБУН ИМБИ № АААА-А18-118021350003-6.
Список литературы
Статья поступила в редакцию 1.11.2018 Dilution rate and level of surface irradiance effect on production characteristics of culture Porphyridium purpureum (Bory) Ross. Аndrey B. Borovkov, Irina N. Gudvilovich Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) The format of production characteristics changes of P. purpureum semicontinuous culture has been determined under different specific medium flow rates and the levels of surface irradiance. It is experimentally shown, that the quantity of biogenic elements added to the P. purpureum culture at a specific medium flow rate of 0.2 day-1, and at a surface illumination of 50 W/m2 is sufficient for providing high productivity of B-phycoerythrin. It reaches 52 mg·l-1·day-1, which is 30% higher than the rest variants of experiment. Further increase in concentration of mineral nutrition elements for P. purpureum culture (increase of the specific medium flow rate) is ineffective. This is because the light was determining factor of the studied culture production characteristics in this experiment. This was also confirmed by obtained experimental data during the tests. Key words: Porphyridium purpureum; semicontinuous culture; the density of the culture; phycobiliproteins; B-phycoerythrin; productivity.
Об авторах Боровков Андрей Борисович - Borovkov Andrey B. кандидат биологических наук spirit2000@ua.fm Гудвилович Ирина Николаевна - Gudvilovich Irina N. кандидат биологических наук gudirina2008@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-255-07-95.
ССЫЛКА НА СТАТЬЮ: Влияние скорости разбавления и уровня поверхностной освещенности на продукционные характеристики культуры Porphyridium purpureum (Bory) Ross. // Вопросы современной альгологии. 2018. №3 (18). URL: http://algology.ru/1376
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||
|
| ||