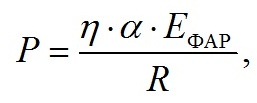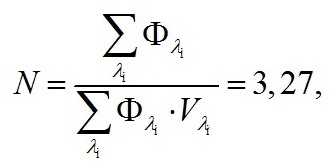|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VII Сабининские чтения 1 ноября - 25 декабря 2018 г. Продукционные характеристики Spirulina platensis и Dunaliella salina в Севастопольском регионе в осенний период
Чекушкин А.А., Гудвилович И.Н., Лелеков А.С. Anatoly A. Chekushkin, Irina N. Gudvilovich, Aleksandr S. Lelekov
Институт морских биологических исследований им. А.О.Ковалевского РАН
УДК 579:582.26/.27:639.64
Проведен расчет предельной продуктивности для культур микроводорослей при выращивании в осенний период в южных регионах России. Проведена оценка реально наблюдаемой продуктивности культур Spirulina platensis и Dunaliella salina в полупромышленных условиях в осенний период (г. Севастополь, октябрь–ноябрь 2018 г.) Отмечено ограничение скорости роста температурными условиями. Показана возможность получения дополнительного количества биомассы исследованных видов в период межсезонья. Ключевые слова: предельная продуктивность; накопительная культура; КПД фотобиосинтеза; Spirulina platensis; Dunaliella salina.
Количественная оценка экспериментальных результатов по культивированию микроводорослей подразумевает расчет или определение конкретных параметров роста. К основным ростовым параметрам можно отнести продуктивность культуры или скорость роста (валовая, средняя, максимальная), удельная скорость роста, максимальная биомасса при накопительном культивировании, эффективность преобразования световой энергии клетками (КПД фотобиосинтеза). Параметр продуктивности культуры можно рассматривать как обобщенную характеристику её физиологического состояния, так как он включает в себя всю совокупность биосинтетических и биоконверсионных процессов в клетках микроводорослей. Культивирование микроводорослей в условиях естественного освещения является основным способом получения их биомассы в промышленных масштабах (Минюк и др., 2008; Боровков, Гудвилович, 2017). Известно, что применение искусственного освещения при промышленном производстве микроводорослей, либо подсветки фотобиореакторов в ночной период, приводит к значительному удорожанию конечного продукта (Геворгиз и др., 2010). Обычно в условиях южных регионов России промышленное выращивание микроводорослей носит сезонный характер с мая по сентябрь. Однако при благоприятных погодных условиях, как световых, так и температурных, продолжительность сезона может быть значительно увеличена. В данной работе была поставлена задача оценить продуктивность микроводорослей в осенний период для южных регионов России, а также рассчитать предельную скорость роста, считая, что рост культуры ограничен количеством падающей световой энергии. В качестве объектов исследования были выбраны два наиболее широко распространенных в альготехнологии России вида – Spirulina platensis и Dunaliella salina.
Материал и методы Работы выполняли на базе отдела биотехнологий и фиторесурсов ФГБУН ИМБИ им. А.О. Ковалевского РАН, г. Севастополь. Культуру микроводоросли Dunaliella salina Teod. (штамм IMBR-2 из ЦКП «Коллекция гидробионтов Мирового океана» ФГБУН ИМБИ) выращивали на модифицированной питательной среде по (Shaish et al., 1990). Модификация заключалась в добавлении морской соли (производитель ПК «Галит», Крым) до концентрации 120 г/л. Культуру цианобактерии Spirulina platensis (Nordst.) Geitler (Arthrospira platensis (Nordstedt) Gomont) (штамм IMBR-31 из ЦКП «Коллекция гидробионтов Мирового океана» ФГБУН ИМБИ) выращивали на среде Заррук (Zarrouk, 1966). Выращивание проводили в альготехнологическом модуле ФГБУН ИМБИ; культиваторами служили квадратные бассейны 1×1 м (для D. salina) и 2×3 м (для S. platensis), выстеленные полиэтиленовой пленкой, уложенные на выровненную поверхность грунта. Высота слоя раствора составляла 7 см, объем культур – 70 и 400 л соответственно. Культивирование проводили при естественном освещении и температуре; осуществляли непрерывное перемешивание с помощью аквариумной помпы «BARBUS PUMP 006». Освещенность на поверхности культиваторов определяли люксметром Ю-116 ПО «Вибратор» (СССР). Средняя освещенность рабочей поверхности бассейнов составляла 20–30 клк, температура культур в эксперименте варьировала в диапазоне 16–30°С. Содержание сухого вещества в культуре (СВ) определяли фотометрическим методом (Методы…, 1975). Отбор проб для определения оптической плотности проводили из разных точек бассейна: отбирали по 10 мл суспензии клеток водорослей, получая таким образом «среднюю пробу» объемом 50 мл. В средней пробе после перемешивания определяли величину пропускания и оптическую плотность на фотометре UNICO-2100 при длине волны 750 нм, погрешность измерения не превышала 1%. При пересчете единиц оптической плотности на сухую биомассу D. salina использовали эмпирический коэффициент k = 0,78, а на сухую биомассу S. platensis – k = 0,8 (Геворгиз и др., 2005; Боровков, Гудвилович, 2017). Измерения проводили относительно дистиллированной воды. Кюветы располагали максимально близко к фотоприемнику, что позволяло снизить ошибку измерения оптической плотности культуры, связанную с светорассеянием. При выходе показаний прибора за границы рабочего диапазона (от 30 до 70% пропускания), проба разбавлялась дистиллированной водой. Расчет предельной продуктивности P культур микроводорослей проводили по формуле: где η – КПД фотобиосинтеза, %; α – коэффициент поглощения энергии клетками микроводорослей; EФАР – суммарное количество фотосинтетически активной радиации (ФАР), падающей за сутки на поверхность бассейна, Вт/м2; R – средняя калорийность биомассы микроводорослей, кДж/г. Рассчитывали средние арифметические
Результаты и обсуждение Предварительно провели расчет по формуле (1) предельно возможной продуктивности культуры микроводорослей (для южных регионов РФ для широты г. Севастополя) в период октябрь–ноябрь. Считали, что коэффициент поглощения энергии клетками микроводорослей α = 1, т.е. вся солнечная энергия, падающая на поверхность, полностью поглощается культурой; средняя калорийность 1 г биомассы микроводорослей составляет около 5 ккал или 20,86 кДж (Белянин и др., 1980).
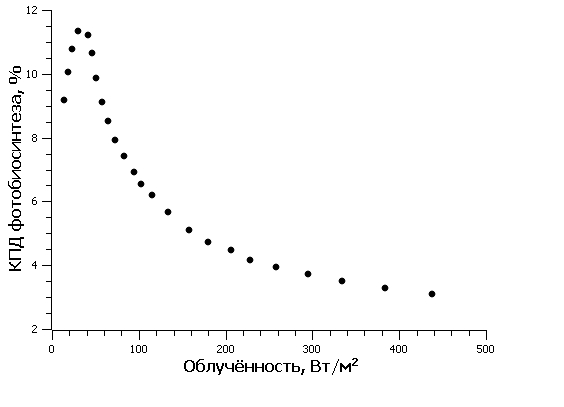
Рис.1. Энергетический КПД фотобиосинтеза цианопрокариот в зависимости от облученности для непрерывного освещения Fig.1. Energy efficiency of photobiosynthesis Cyanoprokaryota depending on continuous irradiance
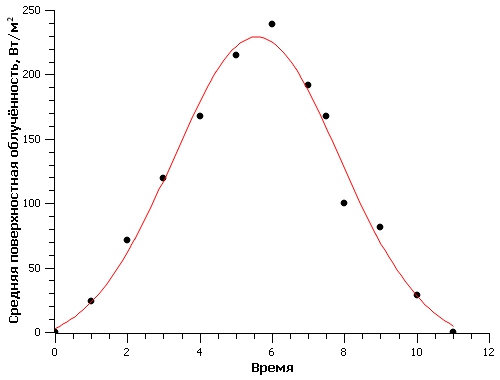
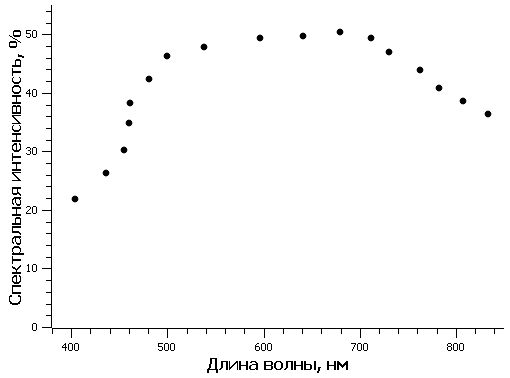
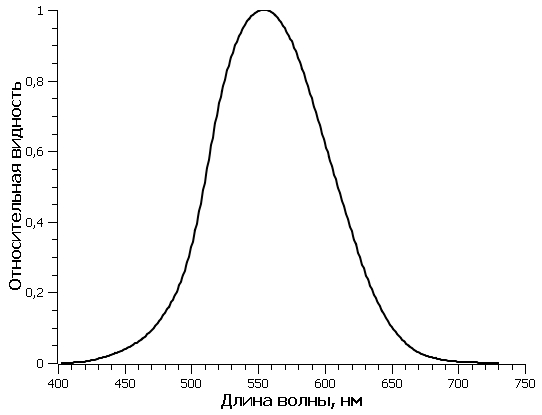
Известно, что эффективность преобразования световой энергии микроводорослями зависит от уровня освещенности культуры. Так как освещенность поверхности бассейна изменялась в течение светового дня, при расчетах использовали среднее значение КПД, составившее 5,06%. Среднее значение КПД рассчитали, используя данные (Белянин и др., 1980) (рис. 1), и считая, что диапазон изменения облученности для южных регионов РФ составляет 0–400 Вт/м2 (Чекушкин и др., 2018). Для определения EФАР были проведены измерения освещенности поверхности бассейнов в теплице в течение светового дня (вторая половина октября) (рис. 2). Для перехода от единиц освещенности, измеряемой на поверхности бассейнов с помощью люксметра, к единицам энергетической освещенности использовали формулу по (Айзенберг, 1983): где Eᵥ – освещенность поверхности бассейна, лк; N – отношение величин полной и видимой человеческим глазом световой энергии источника освещения. Величина N для солнечной активности в условиях проведения эксперимента, с учетом указанного спектра (рис. 3А) и спектральной световой эффективности (рис. 3Б), составила: где
Fig. 2. Dynamics of changes in the average surface irradiation of ponds during daylight
Рис. 3. А – распределение энергии в солнечном спектре при высоте солнцестояния 30 градусов (Клешнин, 1954); B – относительная спектральная световая эффективность (относительная видность) Fig. 3. A – the distribution of solar spectrum energy at the height of the 30 degrees solstice (Kleshnin, 1954);
Таким образом, с учетом рассчитанных параметров, суммарное количество фотосинтетически активной радиации (ФАР), падающей за сутки на освещаемую поверхность, составило EФАР = 1247 Вт/м2, а предельная продуктивность для условий южных регионов России в период октябрь–ноябрь – P = 10,8 г СВ/м2 в сутки. Важнейшими факторами, определяющими скорость роста культур микроводорослей, являются световые и температурные условия, а также обеспеченность элементами минерального питания. Нестабильность этих параметров приводит к значительным потерям урожая биомассы. Поэтому промышленное выращивание микроводорослей, особенно в осенний период, желательно организовывать на базе тепличных хозяйств, что способствует как повышению, так и стабилизации температуры в бассейнах.
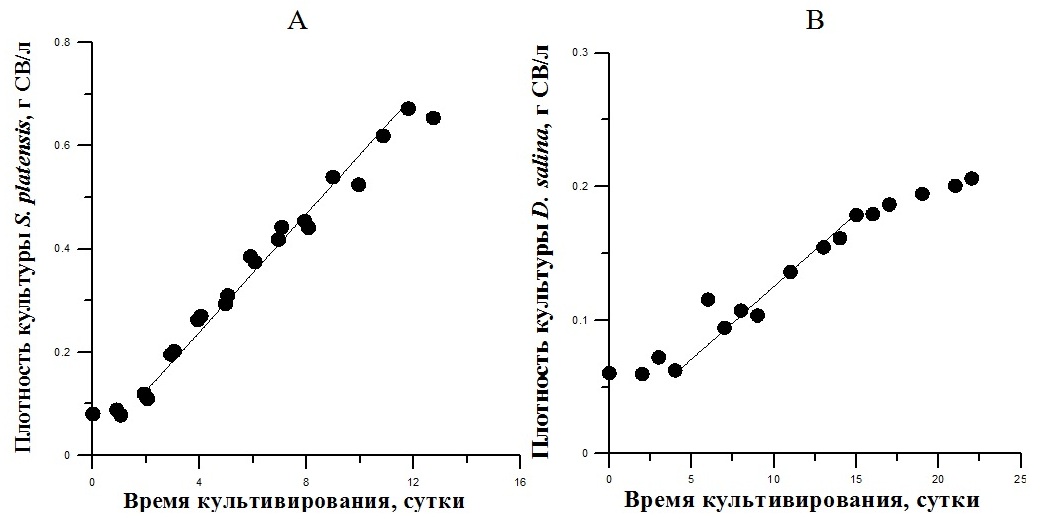
Fig. 4. The dynamics of the density batch cultures of S. platensis (A) and D. salina (B) under natural light (october–november 2018)
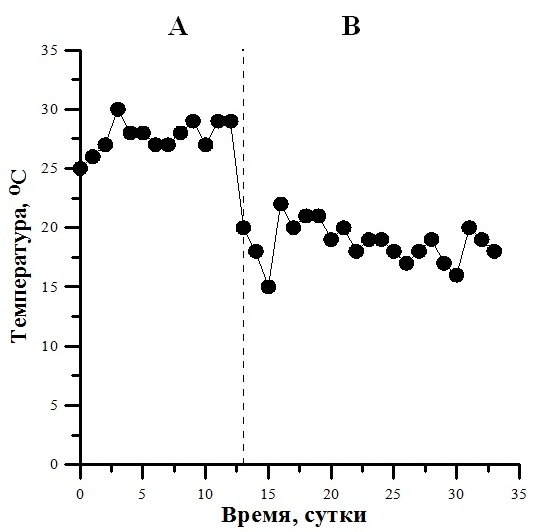
На примере культур S. platensis и D. salina проведена оценка продуктивности при их полупромышленном выращивании в тепличном комплексе в Севастопольском регионе (октябрь–ноябрь 2018 г.) Первоначальная плотность культур была приблизительно одинаковой (0,08 и 0,06 г СВ/л для спирулины и дуналиеллы соответственно) (рис. 4). Культура S. platensis, использованная в качестве инокулята, была предварительно выращена в аналогичных условиях, поэтому для её адаптации потребовалось минимальное время, а активный рост начался после 2-х суток. Что касается D. salina, то культура для её выращивания (инокулят) находилась на «красной» стадии, и в первые 5 суток проходила адаптация клеток к резко изменившимся условиям, после чего также начался рост культуры. За 10 суток выращивания S. platensis (линейная фаза) прирост её биомассы составил около 0,6, а D. salina – 0,12 г СВ с 1 л культуры. Следует отметить, что выращивание спирулины проходило при более высокой температуре, чем дуналиеллы (рис. 5), для которой данный параметр был значительно ниже оптимального (Масюк, 1973; Гудвилович, Боровков, 2017), что являлось дополнительным ограничивающим фактором наряду со снижением солнечной облученности, обусловленной сезонными условиями. На основании полученных экспериментальных данных определили максимальную и среднюю продуктивность культуры на линейном участке роста, а также урожай для каждого вида (табл. 1). Следует отметить, что питательные среды, используемые для выращивания S. platensis и D. salina в эксперименте, значительно отличаются по количественному составу основных элементов минерального питания; так, в частности, по содержанию азота в 5,3 раза (370 и 70 мг/л для спирулины и дуналиеллы соответственно). По литературным данным для синтеза 1 г биомассы микроводорослей необходимо около 80–100 мг азота (Тренкеншу, Лелеков, 2017), т.е. расчетный урожай мог достигнуть 3,7 и 0,7 г биомассы с 1 л культуры спирулины и дуналиеллы соответственно. Тем не менее, реальный урожай был значительно ниже расчетных значений (в 5–6 раз) (см. табл. 1). Поэтому рост каждой из двух культур в эксперименте не был лимитирован концентрацией азота в среде. Тот факт, что наблюдаемые скорости роста S. platensis и D. salina были ниже расчетной (10,8 г·м-2·сут-1) в 2,7 раза и в 15 раз соответственно, свидетельствует о лимитировании роста клеток культур микроводорослей световыми и температурными условиями, как наиболее вероятными факторами среды.
Табл. 1. Расчетная продуктивность для полупромышленного выращивания культур
Fig. 5. Dynamics of temperature in the ponds during the growing of crops from 11 to 23 October (A)
Заключение В работе определены продукционные характеристики для двух биотехнологически значимых видов микроводорослей S. platensis и D. salina при их выращивании в межсезонье (октябрь–ноябрь). Полученные результаты, а также расчет предельной продуктивности культуры микроводорослей по энергетике для этого периода показал, что для южных регионов России возможно получать дополнительный урожай. Однако неблагоприятные, и в первую очередь, температурные и световые условия значительно ограничивают продуктивность культур микроводорослей и накладывают дополнительные требования к организации производственного процесса. Тем не менее, определенную прибавку к урожаю исследованных культур в период межсезонья, когда тепличные комплексы уже не используются, возможно получить. Для снижения затрат и учитывая реальную продуктивность S. platensis и D. salina, для их выращивания можно использовать менее концентрированные среды; а полученную культуру дуналиеллы оставлять в теплице на зимний период, для дальнейшего использования весной в качестве инокулята.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Исследование выполнено при финансовой поддержке РФФИ и города Севастополь в рамках научного проекта № 18-44-920009 и по теме НИР ФГБУН ИМБИ № 0828-2018-0004.
Список литературы
Статья поступила в редакцию 25.12.2018
Об авторах Чекушкин Анатолий Анатольевич - Chekushkin Anatoly A. инженер 1 кат., Институт морских биологических исследований им. А.О.Ковалевского РАН, Севастополь, Россия (Kovalevsky Institute of Marine Biological Research of RAS, Russia, Sevastopol), Отдел биотехнологий и фиторесурсов chekushkin.78@mail.ru Гудвилович Ирина Николаевна - Gudvilovich Irina N. кандидат биологических наук gudirina2008@yandex.ru Лелеков Александр Сергеевич – Lelekov Alexander S. кандидат биологических наук a.lelekov@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-255-07-95.
ССЫЛКА НА СТАТЬЮ: Чекушкин А.А., Гудвилович И.Н., Лелеков А.С. Продукционные характеристики Spirulina platensis и Dunaliella salina в Севастопольском регионе в осенний период // Вопросы современной альгологии. 2019. № 1 (19). С. 96–104. URL: http://algology.ru/1435 DOI - https://doi.org/10.33624/2311-0147-2019-1(19)-96-104 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Production characteristics of Spirulina platensis and Dunaliella salina cultures in the Sevastopol region at the off-season Anatoly A. Chekushkin, Irina N. Gudvilovich, Aleksandr S. Lelekov Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia The calculation of limit productivity for microalgae cultures during cultivation in the autumn period in the southern regions of Russia is carried out. The maximum observed productivity of Spirulina platensis and Dunaliella salina in semi-industrial conditions in autumn (Sevastopol, october-november 2018) was estimated. It is noted that the growth rate is limited by temperature conditions. The possibility of obtaining additional biomass of the studied species during the off-season is shown. Keywords: maximum allowable productivity; batch culture; efficiency of photobiosynthesis; Spirulina platensis; Dunaliella salina.
References
Authors Chekushkin Anatoly A. ORCID - https://orcid.org/0000-0002-5177-4044 Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia chekushkin.78@mail.ru Gudvilovich Irina N. ORCID - https://orcid.org/0000-0001-7412-8283 Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia gudirina2008@yandex.ru Lelekov Aleksandr S. ORCID - https://orcid.org/0000-0003-1213-7963 Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia a.lelekov@yandex.ru
ARTICLE LINK: Chekushkin A.A., Gudvilovich I.N., Lelekov A.S. Production characteristics of Spirulina platensis and Dunaliella salina cultures in the Sevastopol region at the off-season. Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 1 (19). P. 96–104. URL: http://algology.ru/1435 DOI - https://doi.org/10.33624/2311-0147-2019-1(19)-96-104
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||