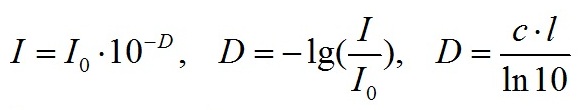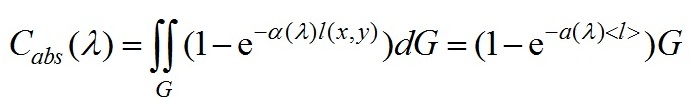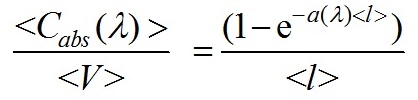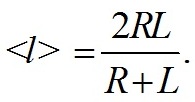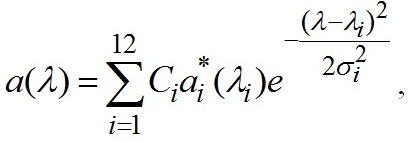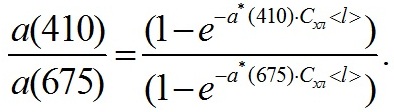|
|
|
Оценка содержания хлорофилла по спектрам поглощения нативных клеток Spirulina platensis
Парамонов Л.Е. Leonid E. Paramonov
Институт океанологии имени П.П. Ширшова РАН, Южное отделение (Геленджик, Россия)
УДК 535.34.574.583
Рассматривается способ восстановления коэффициентов поглощения пигментов Spirulina platensis с использованием спектров поглощения нативных клеток и исключающий использование экстрактов. Обсуждаются оценки внутриклеточной концентрации хлорофилла а, С-фикоэритрина, С-фикоцианина и аллофикоцианина в нативных клетках. Ключевые слова: спектр коэффициентов поглощения; Spirulina platensis; хлорофилл а; С-фикоцианин; аллофикоцианин; С-фикоэритрин.
Введение Поглощение света фитопланктоном – один из основных факторов изменения оптических свойств океанических и прибрежных вод, содержит информацию о пигментах в клетках и является основой различных приложений (Kirk, 2011; Morel, 1991; Platt, Sathyendranath, 1988; Sathyendranath et al, 2001; Шифрин, 1983). Содержание хлорофилла а в фитопланктоне служит важной характеристикой оценки первичной биопродуктивности (Кобленц-Мишке, Ведерников, 1977; Минеева, 2011; Мордасова, 2014). Данные по содержанию хлорофилла а позволяют охарактеризовать продуктивность вод Мирового океана, морей и водоемов, в том числе и с использованием дистанционных методов (Platt, Sathyendranath, 1988). При определении концентрации пигментов в фитопланктоне используются рекомендации Научного комитета по океаническим исследованиям ЮНЕСКО (SCOR-UNESCO Working Group Number 17, 1966), и межгосударственный стандарт (ГОСТ 17.1.4.02-90, 1999) для определения хлорофилла а. Методы высокоэффективной жидкостной хроматографии, спектрофотометрический и флуориметрический дают достоверные результаты при оценке концентрации в случае исследования раствора одного хлорофилла а (Daemen, 1986), отмечается, что при исследовании экстрактов смеси пигментов предпочтительнее использовать спектрофотометрический метод и метод хроматографии. Отмеченные результаты являются эталонными и используются для оценки достоверности и корректности определения концентрации пигментов в лабораторном и натурном экспериментах на основе безэкстрактных спектрофотометрических и флуориметрических методов. Эти методы (включая лазерно-индуцированную флуоресценцию) определения содержания пигментов без нарушения целостности клеток наиболее перспективны в натурных экспериментах, океанологических исследованиях фитопланктона и лабораторных экспериментах с монокультурами водорослей. Однако имеются существенные ограничения – между измеренными спектрами оптической плотности, как и спектрами флуоресценции, и концентрацией пигментов существуют достаточно сложные зависимости. В настоящей статье на основе результатов и экспериментальных спектров поглощения нативных клеток (Парамонов, 2018) в видимой области спектра восстанавливаются коэффициенты поглощения раствора пигментов цианобактерии Spirulina platensis. Полученные данные позволяют оценить вариации коэффициентов поглощения взвесей нативных клеток, обусловленные эффектом упаковки (Duysens. 1956), с учетом распределения по размерам и форме Spirulina platensis. Внутриклеточная концентрация хлорофилла а, С-фикоцианина, аллофикоцианина и С-фикоэритрина оценивается с использованием а) разложения спектра коэффициентов поглощения пигментов на гауссианы (Hoepffner, Sathyendranath, 1991) и б) данных об удельных коэффициентах поглощения отмеченных пигментов (Boussiba, Richmond, 1979; Ficek et al, 2004; Simis, Kauko, 2012). Трихомы Spirulina platensis состоят из множества гомоцитных клеток, что обеспечивает равномерное распределение пигментов внутри цианобактерии. Это обстоятельство и определяет выбор объекта исследования.
Теоретические основания Рассмотрим слой, например, раствора пигментов, на который перпендикулярно поверхности падает свет интенсивности I0. В соответствии с законом Бугера-Ламберта-Бэра, интенсивность излучения после прохождения оптического пути (длина кюветы) l имеет вид – I=I0e-cl, – коэффициент ослабления, характеризующий раствор пигментов. При измерении ослабления света спектрофотометрами используется оптическая плотность D:
Известно, что c=b+a, здесь b и a коэффициенты рассеяния и поглощения соответственно. Оценка коэффициента поглощения раствора пигментов может быть проведена с использованием спектрофотометра, измеряющего коэффициент ослабления, так как в этом случае вклад рассеяния мал (b « a) и c ≅ a. Для оценки коэффициента поглощения взвеси нативных клеток фитопланктона используют измерения спектрофотометров с интегрирующей сферой, чтобы исключить влияние рассеяния света, так как коэффициент рассеяния взвеси клеток сравним или может превышать коэффициент поглощения. Для оценки сечений поглощения биологических клеток используем приближение аномальной дифракции (ван де Хюлст, 1961; Шифрин, 1983; Парамонов, 2018): G рассматривается как площадь проекции частицы на плоскость xOy, ортогональную направлению падающего излучения, так и область интегрирования, α(λ)[м-1] – коэффициент поглощения клеточного вещества, l(x,y) – длина оптического пути луча, через клетку и точку (x,y), Для усредненного сечения поглощения взвеси слабопреломляющих частиц используем формулу (Шифрин, Тонна 1992; Парамонов, 2018): < V >, < G > – средние объем и площадь проекции клеток. Формула (2) применима и к неоднородным клеткам, в этом случае <l> – средняя длина оптического пути через поглощающиеся структуры (хлоропласты, фикибилисомы), < G > – их площадь проекции. В исследованиях полезно использовать коэффициент характеризующий поглощение единицей объема клетки и эффект упаковки (Duysens. 1956), с ростом < l > эффективность поглощения уменьшается, максимальное значение достигается при молекулярном растворе пигментов (< l >=0): Spirulina platensis является нитевидной цианобактерией с цилиндрическими многоклеточными трихомами в левозакрученной спирали. В нашем исследовании в качестве модели Spirulina platensis выбрана вытянутая цилиндрическая частица, характеризующаяся длиной L и радиусом основания R. Для цилиндрических частиц с равномерным распределением по ориентациям в пространстве
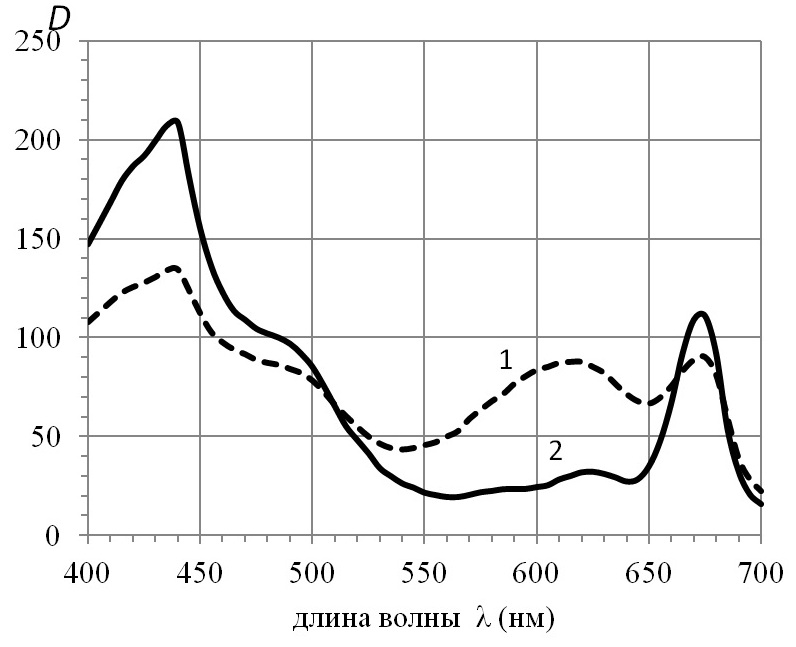
Результаты и обсуждение При измерениях поглощения света клетками фитопланктона используются спектрофотометры с интегрирующими сферами, что позволяет исключить влияние рассеяния света. Однако существует проблема – неопределенной остается длина оптического пути лучей многократно прошедших через исследуемый образец. Калибровка представляет собой предмет отдельного исследования. В настоящее время для измерения поглощения широко используется техника, где взвесь клеток концентрируется на оптоволоконных фильтрах, необходима коррекция, связанная с рассеянием света, к тому же клетки фитопланктона располагаются большей площадью проекции к направлению света, что уменьшает величину <l>, увеличивая эффективность поглощения единицей объема. В настоящем исследовании, чтобы исключить погрешности применения абсолютных измерений, используем относительные величины. Полагаем, что в природных условиях и при измерениях трихомы Spirulina platensis хаотически (равномерно) ориентированы в пространстве. При восстановлении спектра коэффициентов поглощения α(λ) пигментов Spirulina platensis использовали экспериментальные данные (Парамонов, 2018). На рис. 1 приведены спектры поглощения нативных клеток Spirulina platensis и этих же клеток, подвергнутых ультразвуковому воздействию; измерения проведены с помощью спектрофотометра СФ-14 с интегрирующей сферой.
Рис. 1. Спектры поглощения взвеси нативных клеток Spirulina platensis до (1) и после ультразвукового воздействия (2). Значения приводятся в относительных единицах оптической плотности Fig. 1. Absorption spectra of suspensions of native Spirulina platensis cells before (1) and after ultrasound exposure (2). Values are given in relative units of optical density
При оценке спектра коэффициентов поглощения α(λ) пигментов Spirulina platensis использовали экспериментальные данные, приведенные на рис. 1, и данные микроскопического анализа: <l> = 5,73; 1,61 мкм соответственно для нативных и после ультразвукового воздействия клеток, оценка <l> точечная, объем каждой выборки превышал 100. Теоретический анализ спектров коэффициентов поглощения включает следующие этапы. А) Полагаем, что хлорофилл а не теряет поглощательной способности после ультразвукового воздействия. При λ = 410 нм поглощение, при отсутствии растворенного органического вещества (РОВ), определяется исключительно хлорофиллом а. Из измеренного отношения коэффициентов поглощения нативных клеток до и после ультразвукового воздействия коэффициент поглощения пигментов a(410) находится как решение уравнения на основе формулы (2). Б) При известном значении a(410) с использованием (2) и спектра коэффициентов поглощения взвеси нативных клеток (рис. 1, кривая 1) восстанавливается спектр коэффициентов поглощения раствора пигментов. В) Одним из приложений полученных результатов является определение внутриклеточной концентрации пигментов. Для этого используем разложение спектра коэффициентов поглощения α(λ) раствора пигментов (рис. 2) на гауссианы
Ci (мг∙м-3) – внутриклеточная концентрация пигментов, α*i(λi) (м2∙мг-1) – удельный коэффициент поглощения пигментов в локальных максимумах поглощения λi (нм) хлорофилла а (λi=384, 415, 436, 623, 675, 700), каротиноидов (λi=464, 493, 532), фикоэритрина (λi=565), фикоцианина (λi=611), аллофикоцианина (λi=658), σi характеризует полуширину распределения.
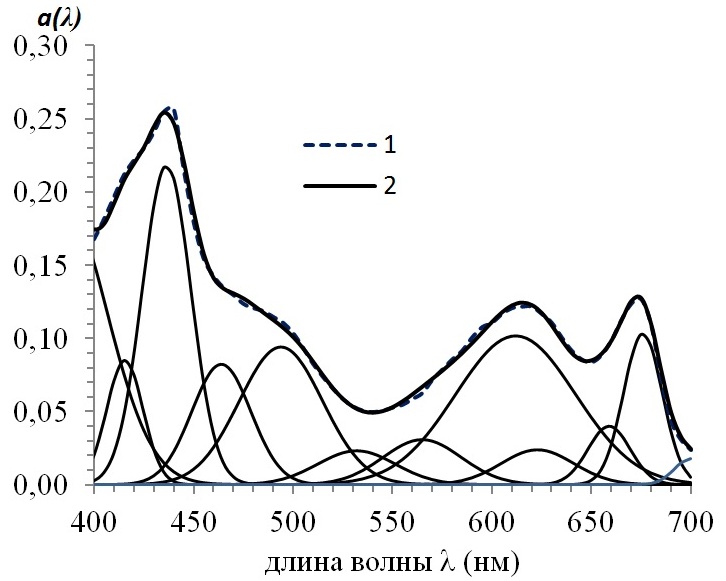
Рис. 2. Разложение спектра коэффициентов поглощения раствора пигментов α(λ) (мкм-1) Spirulina platensis (1) в виде линейной комбинации гауссианов (2) Fig. 2. Expansion of the spectrum of absorption coefficients of the pigment solution α(λ) (μm-1) Spirulina platensis (1) in the form of a linear combination of Gaussians (2)
Данные (Ficek et al, 2004; Hoepffner, Sathyendranath, 1991): α*i (675)=0,02 и (Boussiba, Richmond, 1979; Simis, Kauko, 2012): α*i (611)=0,0073, α*i (565)=0,01, α*i (656)=0,0058, а также результаты разложения (рис. 2) позволяют определить внутриклеточную концентрацию хлорофилла а – 5,15·106 мг м-3, фикоцианина – 14·106 мг м-3, фикоэритрина – 3,1·106 мг м-3, аллофикоцианина – 6,9·106 мг м-3.
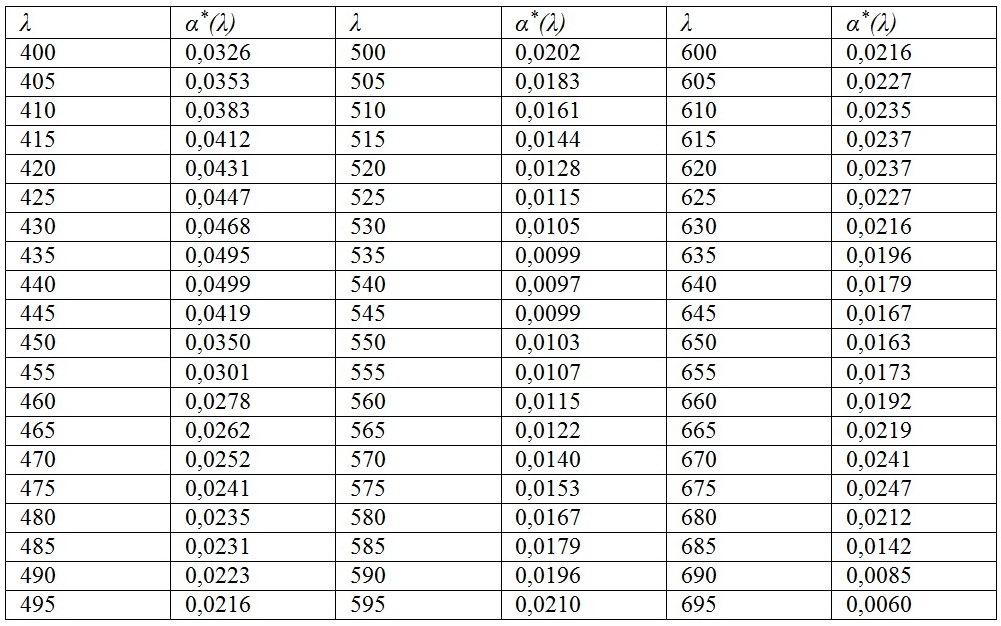
В табл. 1 представлены коэффициенты поглощения раствора пигментов, нормированные на внутриклеточную концентрацию хлорофилла а (Схл).
Таблица 1. Спектр коэффициентов поглощения α*(λ) [м2мг-1] раствора пигментов Spirulina platensis, нормированных на внутриклеточную концентрацию хлорофилла а Table 1. Spectrum of absorption coefficients α*(λ) [m2mg-1] of Spirulina platensis pigment solution normalized to intracellular chlorophyll a concentration
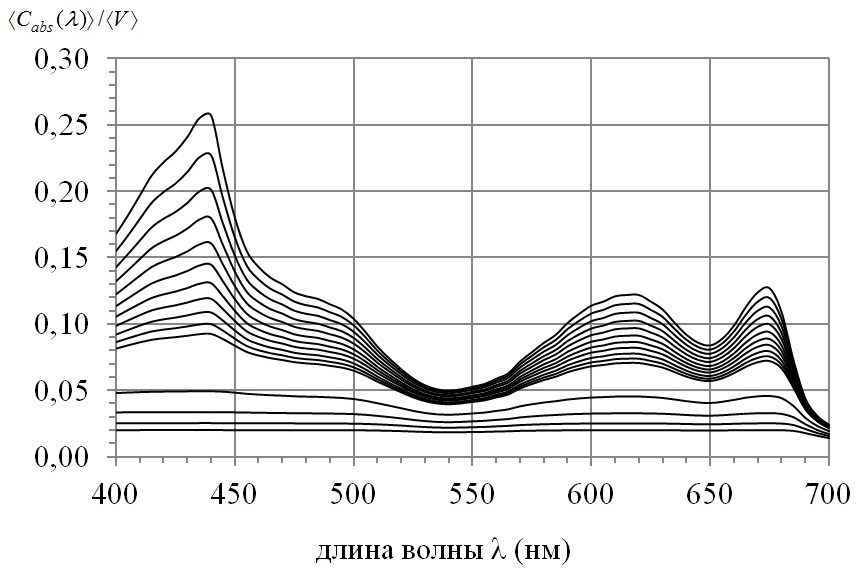
На рис. 3 представлены спектры нормированных сечений поглощения Чтобы избежать фотоингибирующего действия света, в летнее время в естественных водоемах при высоком уровне облученности Spirulina platensis сворачивается в клубок, уменьшая эффективность поглощения на единицу объема. В северо-восточной части Черного моря в весенне-зимний период доминируют мелкоклеточные диатомеи, а в летний период с увеличением облученности преобладают крупноклеточные диатомовые водоросли.
Fig. 3. Spectrum of normalized absorption cross sections
Основываясь на данных настоящего исследования, рассмотрим способ определения содержания хлорофилла а. Отношение коэффициентов поглощения взвесей нативных клеток Spirulina platensis, при использовании данных табл. 1 и формулы (2), имеет вид По измеренным коэффициентам a(410), a(675) и найденной в результате микроскопического анализа оценке <l> [мкм], внутриклеточная концентрация [мг∙мл-1] хлорофилла а (Cхл) находится как решение уравнения (4). Выбор длин волн λ для отношения коэффициентов поглощения обусловлен следующими соображениями: а) при λ=410 нм поглощение определяется только хлорофиллом а; Аналогичный подход может быть использован и для диатомовых водорослей (Парамонов, 2017). Диатомеи, в отличие от Spirulina platensis, имеют подвижную систему хлоропластов и способны регулировать величину поглощенной энергии – равномерное распределение одиночных хлоропластов по объему клетки наблюдается при низких уровнях облученности, с увеличением облученности наблюдаются скопления хлоропластов.
Автор заявляет об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена в соответствии с темой госзадания № 0149-2019-0014 ИО РАН.
Список литературы
Статья поступила в редакцию 11.11.2019
Об авторе Парамонов Леонид Евгеньевич − Paramonov Leonid E. доктор физико-математических наук lparamonov@yandex.ru Корреспондентский адрес: Россия, 353470, Краснодарский край, г. Геленджик, ул. Просторная 1-г. Телефон/факс 8-861-41-280-89.
ССЫЛКА НА СТАТЬЮ: Парамонов Л.Е. Оценка содержания хлорофилла по спектрам поглощения нативных клеток Spirulina platensis // Вопросы современной альгологии. 2020. № 1 (22). С. 25–33. URL: http://algology.ru/1607 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-25–33
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Estimation of chlorophyll content by absorption spectra of native Spirulina platensis cells Leonid E. Paramonov Shirshov Institute of Oceanology RAS, Southern Branch (Gelendzhik, Russia) A method for retrieving the absorption coefficients of Spirulina platensis pigments using absorption spectra of native cells and excluding the use of extracts is considered. Estimates of the intracellular concentration of chlorophyll a, С-phycoerythrin, С- phycocyanin and allophycocyanin in native cells are discussed. Key words: spectrum of absorption coefficients; Spirulina platensis; chlorophyll a; С-phycocyanin; allophycocyanin; С-phycoerythrin.
Author Paramonov Leonid E. ORCID - https://orcid.org/0000-0002-8561-8197 Shirshov Institute of Oceanology RAS, Southern Branch, Russia, Gelendzhik lparamonov@yandex.ru
References
ARTICLE LINK: Paramonov L.E. Estimation of chlorophyll content by absorption spectra of native Spirulina platensis cells. Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 1 (22). P. 25-33. URL: http://algology.ru/1607 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-25-33
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||