|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VIII Сабининские чтения 10 ноября 2019 - 29 февраля 2020 Многолетняя динамика биомассы фитопланктона и концентрации хлорофилла а в поверхностном слое прибрежных вод Черного моря (район Севастополя)
Стельмах Л.В., Мансурова И.М. Liudmila V. Stelmakh, Irina M. Mansurova
Федеральный исследовательский центр
УДК 574.583:581.132
В поверхностном слое Севастопольской и Карантинной бухт на протяжении 2000–2014 гг. как летом, так и осенью наблюдается понижение средних значений концентрации хлорофилла а и биомассы фитопланктона в 2–5 раз. Это обусловлено снижением содержания нитратов и соединений кремния в воде, а также относительной доли диатомовых водорослей в суммарной биомассе фитопланктона. Регрессионный анализ показал, что в летний период многолетний отрицательный тренд в изменении относительной биомассы диатомовых водорослей определялся в основном содержанием нитратов в воде и ее температурой, тогда как в осенний – содержанием нитратов и кремния. Доля динофитовых водорослей и кокколитофрид за весь период наблюдений увеличивалась. Зимой и весной в бухтах и во все сезоны в открытом прибрежье однонаправленных изменений концентрации хлорофилла и суммарной биомассы фитопланктона не наблюдалось. Ключевые слова: биомасса фитопланктона; хлорофилл а; диатомеи; динофлагелляты; кокколитофориды; биогенные вещества; температура; Черное море
Введение Первичным звеном любой водной экосистемы является фитопланктон, изменчивость которого определяет развитие и динамику всех последующих трофических уровней. За последнее столетие в результате изменений климата температура морской воды в глобальном масштабе повысилась примерно на 1ºC (Häder, Gao, 2015). В поверхностном слое глубоководной части Черного моря с середины 1990-х годов изменение температуры характеризуется положительным трендом (Oguz, Gliber, 2007). В результате усиления температурной стратификации водной толщи поступление биогенных веществ из глубин в зону фотосинтеза, среднегодовые значения концентрации хлорофилла а и биомассы фитопланктона постепенно снижаются (Mikaelyan et al., 2018). Для прибрежных вод Черного моря в районе Крымского полуострова также отмечается многолетний положительный тренд по температуре воды поверхностного слоя (Репетин, 2012). Повышение температуры водной среды может оказывать как прямое, так и опосредованное влияние на функционирование и структуру фитопланктонного сообщества (Winder, Sommer, 2012). В водах Севастопольского региона фитопланктон подвержен влиянию не только климата, но и постоянно растущему антропогенному воздействию. В бухты, расположенные в районе Севастополя, поступает большое количество органических и неорганических веществ с городскими сточными водами, а также с ливневыми стоками. Важное влияние на формирование гидрохимической структуры вод Севастопольских бухт оказывают речной и терригенные стоки, являющиеся одним из основных источников биогенных веществ (Совга и др., 2014). Прибрежные воды Черного моря у Севастополя подвержены влиянию стока таких рек, как Черная, Бельбек и Кача. Поэтому исследования, направленные на выявление изменений, происходящих в первичном звене экосистем этих акваторий в результате совместного влияния климата и антропогенных факторов, представляют значительный интерес. Они имеют не только фундаментальное значение, но и прикладное, так как могут быть использованы в комплексе мероприятий по оценке состояния морской среды в зонах рекреации и районах локализации марихозяйств. Цель настоящей работы – дать анализ многолетней изменчивости концентрации хлорофилла а, суммарной биомассы фитопланктона и относительной доли его основных таксономических групп в поверхностном слое прибрежных вод Черного моря в районе Севастополя за период 2000–2014 гг.
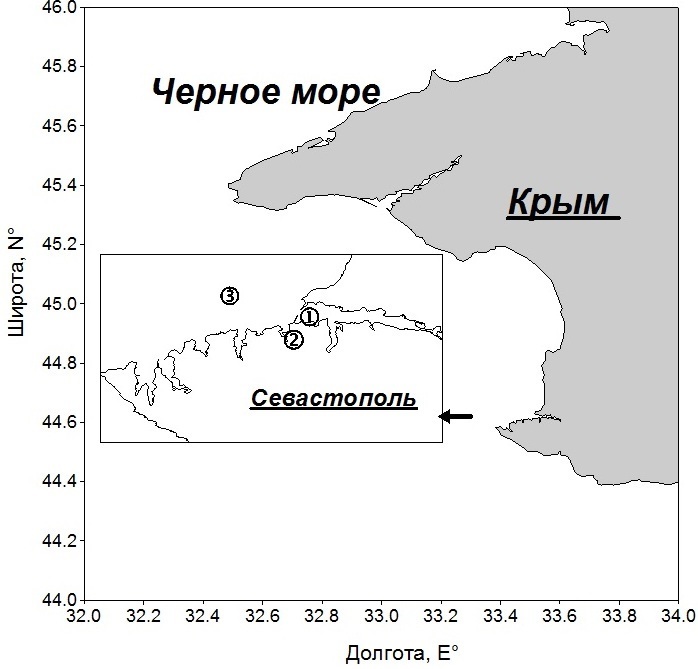
Материал и методы Работа выполнена на основе данных ежемесячных определений концентрации хлорофилла а и биомассы фитопланктона на трех станциях в прибрежных водах Черного моря в районе Севастополя за 2000–2011 гг. (рис. 1). В 2014 г. на станции 1, локализованной в Севастопольской бухте, наблюдения осуществлялись еженедельно. Общая глубина для первых двух станций составляла 14–19 м, а на третьей – 50 м. Пробы воды объемом 4–5 л отбирали в слое 0–1 м, как правило, в утренние часы (8–10 ч).
Рис. 1. Карта станций: 1 – Севастопольская бухта, 2 – Карантинная бухта, 3 – открытое прибрежье Fig. 1. Station map: 1 – Sevastopol Bay, 2 – Quarantine Bay, 3 – open coastal area
Для определения концентрации хлорофилла a часть исходной пробы (не более 1 л) фильтровали на стекловолокнистые фильтры марки GF/F или Sartorius (диаметр 25 мм), которые хранили в морозильной камере при -20ºС в течение 1–2 суток. Затем фильтры помещали в раствор 90% ацетона. Экстрагирование пигментов осуществлялось в темноте при температуре 4ºС в течение 18 часов. После чего экстракты центрифугировали в течение 20 мин. Регистрацию флуоресценции ацетоновых экстрактов до и после подкисления 5%-ным раствором соляной кислоты осуществляли на лабораторном флуориметре, калибровку которого проводили по чистому хлорофиллу а фирмы Sigma Chemical Co. Концентрацию хлорофилла а рассчитывали по формуле, приведенной в (JGOFS Protocol, 1994), но с коэффициентом, рассчитанным для нашего флуориметра: где Хл а – концентрация хлорофилла а, мг·м-3, Fo – флуоресценция ацетонового экстракта до подкисления, выраженная в вольтах (В), Fa – флуоресценция ацетонового экстракта после подкисления (В), Vol1 – объем ацетонового экстракта, мл, Vol2 – объем профильтрованной пробы, л. Для количественного анализа фитопланктона пробы воды объемом 2–3 л сгущали в воронке обратной фильтрации по методике, описанной ранее (Stelmakh, Georgieva, 2014). Пробы фиксировали 1% нейтрализованным формалином и приступали к обработке. Идентификацию видов водорослей, определение их численности и линейных размеров осуществляли в капле объемом 0,1 мл, помещенной в счетную камеру типа Нажотта, в 3 повторностях под световым микроскопом ZEISS Primo Star. Объем клеток водорослей рассчитывали на основе принципа геометрического подобия. Общая биомасса фитопланктона приравнивалась к его суммарному объему. Для перехода от сырой биомассы фитопланктона, именуемой в англоязычной литературе как «biovolume» и выраженной в мг·м-3, к биомассе в углеродных единицах (мгС·м-3) использовали известные уравнения (Menden-Deuer, Lessard, 2000). Содержание нитратов измеряли путем восстановления их до нитритов омедненным кадмием с последующим определением единым «цветным реактивом», аммония – по Гроссгофу-Юхансену, фосфатов – по Морфи и Райли и силикатов – по голубому кремнемолибденовому комплексу (Сапожников, 1988). Температуру воды регистрировали с помощью гидрологического термометра, предназначенного для ее измерения в поверхностном слое моря (0–1 м). Для каждого года 15-летнего периода исследований были рассчитаны средние по сезонам значения температуры воды, концентрации биогенных веществ, хлорофилла а, биомассы фитопланктона, а также относительное содержание диатомовых, динофитовых водорослей и кокколитофорид в суммарной биомассе фитопланктона. Статистическую обработку материалов осуществляли с использованием программы Exсel 2007 для Windows. Представленные в работе значения коэффициента детерминации (R2) линий регрессии рассчитаны для случаев, при которых вероятность p ˂ 0,05. Графики выполнялись с помощью программы Grapher 3.
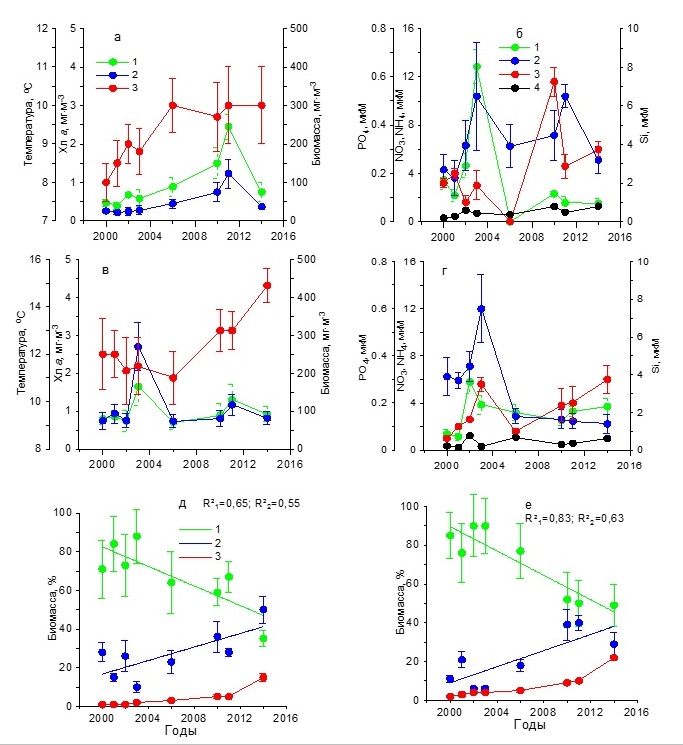
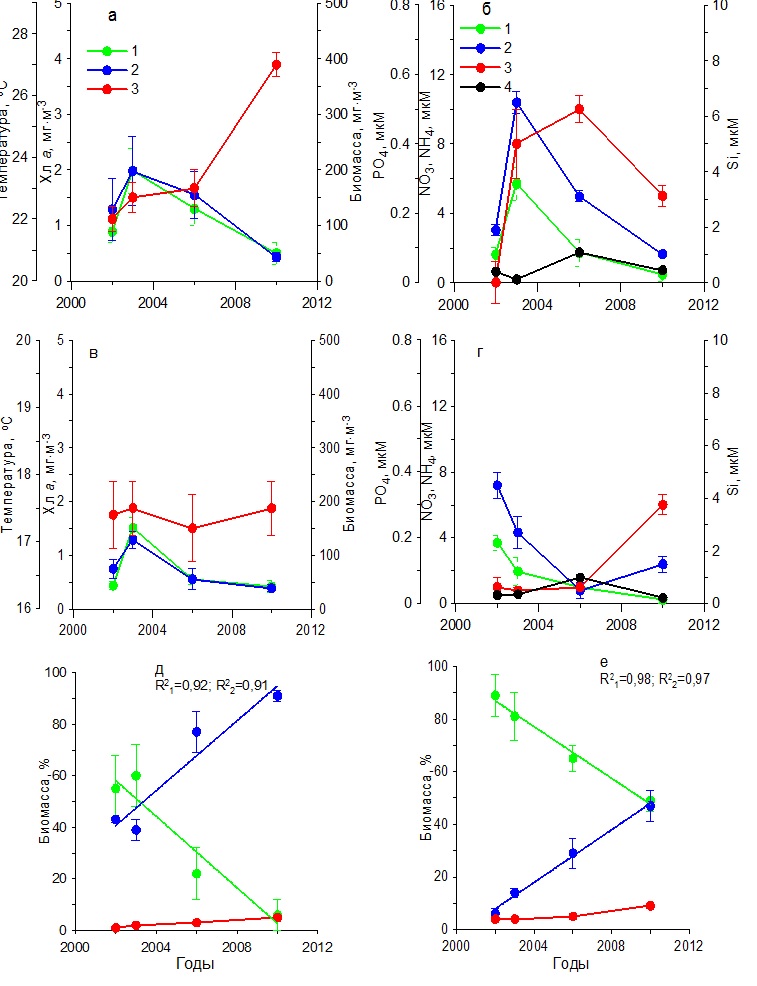
Результаты Севастопольская бухта Анализ результатов, полученных за 15 лет, показал, что зимой (в декабре – феврале) средние значения температуры воды постепенно возрастали от 8 до 10ºС в период с 2000 по 2006 гг., сохраняясь в дальнейшем на практически постоянном уровне (рис. 2а). Концентрация нитратов до 2006 г. составляла в среднем 2–13 мкМ, а затем снизилась до 0–2 мкМ (рис. 2б). Среднее содержание фосфатов в первый период (2000–2006 гг.) составляло 0–0,20 мкМ, а во второй (2010–2014 гг.) повысилось до 0,25–0,60 мкМ. Однонаправленных изменений в содержании кремния и аммония не наблюдалось. Средние значения первого биогенного элемента составляли 2,20–6,50 мкМ, тогда как второго не превышали 1 мкМ. На этом фоне отмечено постепенное повышение концентрации хлорофилла а к 2011 г. от 0,5 до 2,5 мг·м-3 с последующим снижением до 0,7 мг·м-3 к 2014 г. (рис. 2а). Подобный характер изменений получен и для биомассы фитопланктона, максимальное среднее значение которой было 120 мг С·м-3, минимальное – 25 мг С·м-3. Максимумы хлорофилла и биомассы фитопланктона отмечены при достаточно высоком содержании нитратов, кремния и фосфатов (1,56, 6,50 и 0,22 мкМ соответственно). Основу биомассы фитопланктона исследуемых акваторий составляли диатомовые и динофитовые водоросли. В течение всего многолетнего периода наблюдений среди диатомовых по биомассе преобладали мелкие виды Skeletonema costatum (Grev.) Cleve и Chaetoceros socialis Laud. Динофитовые водоросли были представлены преимущественно представителями двух родов: Gymnodinium и Prorocentrum. Третьей по значимости группой водорослей были кокколитофориды, среди которых доминировала Emiliania huxleyi (Lohmann) Hay & Mohler. Удельная биомасса диатомовых водорослей однонаправлено снижалась с 70– 88% в 2000–2003 гг. до 37% в 2014 г. (рис. 2д), что обусловлено, вероятно, снижением концентрации нитратов в среде. Доля динофитовых увеличивалась от 10–30% до 50%, а кокколитофорид – от 1 до 10%.
Рис. 2. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1), динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в Севастопольской бухте в зимний (а, б, д) Fig. 2. Long-term dynamics: a, в – chlorophyll a concentration (1), phytoplankton biomass (2) and water temperature (3), б, г – concentration of nitrates (1), silicon (2), phosphates (3) and ammonium (4),
Весной в период с марта по май температура воды возросла от 11–12ºС в 2000–2006 гг. до 15ºС в 2014 г. (рис. 2 в,г). Однонаправленных изменений в содержании биогенных веществ не отмечено. Максимальное содержание кремния (7,50 мкМ) и фосфатов (0,30 мкМ) выявлено в 2003 г. При этом наблюдалась достаточно высокая концентрация нитратов (4 мкМ), что, вероятно, послужило гидрохимической основой для увеличения концентрации хлорофилла а до 1,6 мг·м-3 и биомассы фитопланктона до 260 мг С·м-3 (рис. 2г). Низкие значения этих показателей в 2000–2002 гг. обусловлены, вероятно, невысокими концентрациями нитратов и фосфатов в среде. Снижение концентрации хлорофилла и биомассы фитопланктона после 2003 г. обусловлено, вероятно, снижением содержания кремния. В эти годы концентрация хлорофилла была, как правило, не выше 1 мг·м-3, а биомасса фитопланктона – не более 100 мг С·м-3. По средним значениям вклад диатомовых водорослей в суммарную биомассу фитопланктона изменялся от 75–90% в 2000–2003 гг. до 50% в 2014 г. (рис. 2е). В это же время доля динофитовых водорослей увеличивалась от 5–20% до 30%, а кокколитофорид – от 1 до 20%. Доминирующее положение по биомассе среди диатомовых водорослей в 2000–2003 гг. занимали Chaetoceros curvisetus Cleve, C. socialis и S. costatum. Тогда как в 2010–2014 гг. доминировали Pseudo-nitzschia delicatissima (Cleve) Heiden, S. costatum и Сyclotella caspia Grunow. Среди динофитовых преобладали виды, относящиеся к роду Prorocentrum. Летом в течение всего периода исследований наблюдалось постепенное повышение средней для сезона температуры воды поверхностного слоя от 21 до 26–27ºС (рис. 3а). Концентрация нитратов достигла максимальных значений (3,20 мкМ) в 2003 г., после чего отмечено их постепенное снижение до 0,30–0,70 мкМ, тогда как количество аммония было в 2 раза выше (рис. 3б). Содержание кремния в 2000–2002 гг. находилось в диапазоне 1,00–1,20 мкМ, а затем постепенно снижалось к 2010 г. до 0,30 мкМ, и только в 2014 г. возросло до 3,20 мкМ. Минимальные концентрации фосфатов (0,02–0,03 мкМ) зарегистрированы в 2000–2001 гг. В остальное время его содержание колебалось от 0,20 до 0,50 мкМ. Максимальная концентрация хлорофилла а, составившая 1,91 мг·м-3, наблюдалась в 2003 г., а затем уменьшалась до 1 мг·м-3. Биомасса фитопланктона в течение всего периода исследований постепенно снижалась от 350 до 130 мг С·м-3 (рис. 3а). Как видно из рис. 3д, динамика относительной биомассы диатомовых водорослей имела отрицательный тренд с высоким коэффициентом детерминации (R2=0,84 при p ˂ 0,05). В результате доля этой группы водорослей к 2014 г. составила лишь 18%. Динамика удельной биомассы динофитовых водорослей характеризовалась положительным трендом. К концу периода исследований эта величина была равна 67%. Доля кокколитофорид также постепенно возрастала и достигла в 2014 г. 15%. Снижение относительного вклада диатомовых водорослей в суммарную биомассу фитопланктона сопровождалось изменением их видового состава. Так в 2002 и 2006 гг. в течение июня – августа среди диатомовых водорослей преобладали представители рода Chaetoceros и, прежде всего, C. socialis, а также Coscinodiscus sp., Proboscia alata (Brightwell) Sundström, P. delicatissima, Licmophora ehrenbergii (Kützing) Grunow, Thalassionema nitzshioides Grun. и Cerataulina pelagica (Cleve) Hendey. Тогда как в 2010 и 2014 гг. представители рода Chaetoceros, которые в течение многих предшествующих десятилетий массово развивались, достигая уровня «цветения» в исследуемых водах, не отмечены среди доминирующих видов. Такие виды, как Nitzschia tenuirostris Mer., Striatella interrupta (Ehrenberg) Heiberg, Cyclotella caspia Grunow и Pseudosolenia calcar-avis (Schultze) B.G.Sundström преобладали среди диатомовых водорослей. Динофитовые водоросли были представлены преимущественно представителями рода Gynmodinium, а также Prorocentrum cordatum (Ostf.) Dodge, Prorocentrum micans Ehrenberg, Prorocentrum lima (Ehrenberg) Stein, Prorocentrum compressum (Bailey) Dodge. Среди кокколитофорид доминировала E. huxleyi. В осенний период температура воды постепенно возрастала от 17 ºС в 2001 г. до 18ºС в 2010 г. (рис. 3в). На фоне слабо меняющихся концентраций аммонийного азота (0,3–0,8 мкМ) содержание нитратов в 2000–2003 гг. составляло 0,7–5,7 мкМ, а в 2006–2014 гг. снизилось до 0,3–1,2 мкМ (рис. 3г). Концетрации кремния достигали максимальных значений (2–3 мкМ) в 2001, 2003 и 2014 гг. В другие периоды его содержание снижалось до 0,4–1,5 мкМ. Первый максимум концентрации фосфора (0,20 мкМ) был отмечен в 2001 г., второй (0,50 мкМ) – в 2014 г. В остальные годы значения этого параметра находились в диапазоне 0–0,15 мкМ.
Рис. 3. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1), динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в Севастопольской бухте в летний (а, б, д) и осенний (в, г, е) периоды Fig. 3. Long-term dynamics: a, в – chlorophyll a concentration (1), phytoplankton biomass (2) and water temperature (3), б, г – concentration of nitrates (1), silicon (2), p hosphates (3) and ammonium (4),
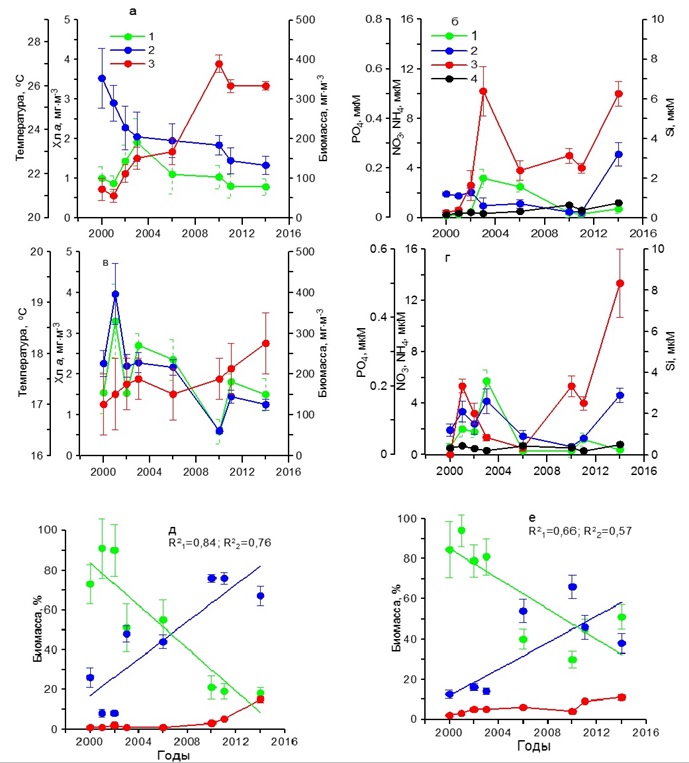
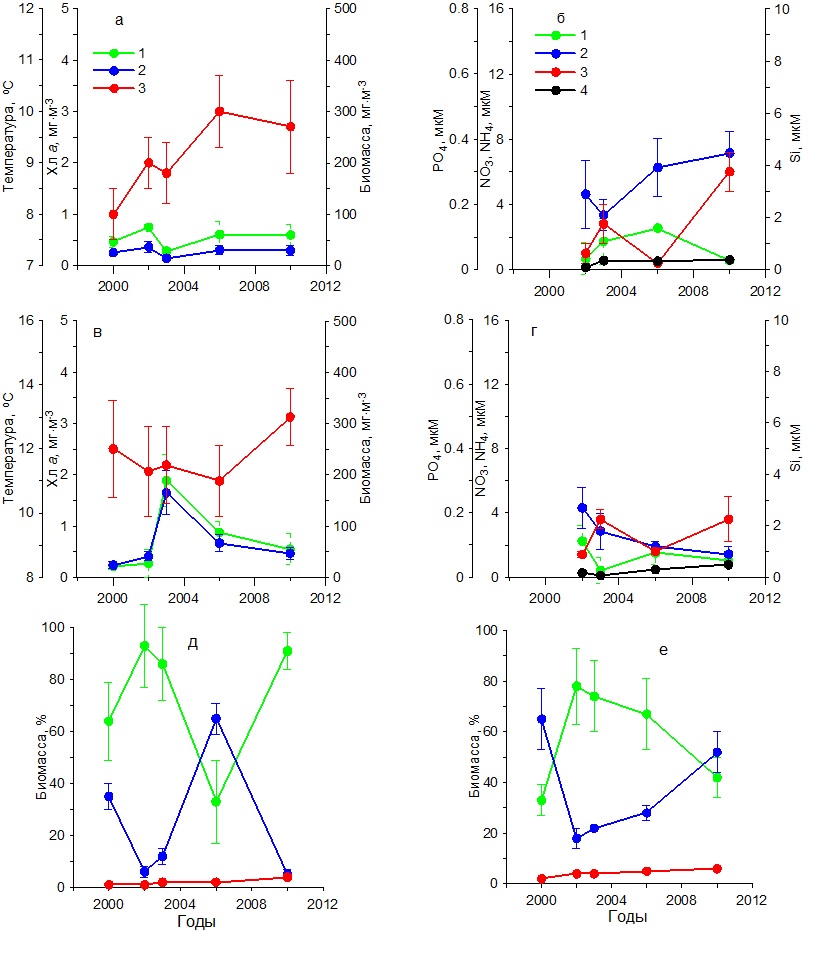
Содержание хлорофилла а в 2000–2006 гг. характеризовалось наиболее высокими значениями (1,50–3,20 мг·м-3), тогда как в 2010–2014 гг. снизилось до 0,50–1,80 мг·м-3 (рис. 3в). Подобным образом изменялась и биомасса фитопланктона. В первый период наблюдений она составила 200–400 мг С·м-3, тогда как во второй понизилась до 60–140 мг С·м-3. В этих условиях за весь период наблюдений доля диатомовых водорослей в суммарной биомассе фитопланктона снижалась от 80–95% до 30–50%. Вклад динофитовых возрастал от 10–15% до 40–70%. Доля кокколитофорид в суммарной биомассе фитопланктона за период с 2000 по 2014 гг. увеличилась с 2 до 10% (рис. 3е). В осеннем фитопланктоне среди диатомовых в течение всего периода исследований доминировали такие виды, как P. delicatissima, Dactyliosolen fragilissimus (Bergon) Hasle и C. pelagica, среди динофитовых представители рода Prorocentrum и Ceratium. Карантинная бухта В зимний период в течение 2002–2010 гг. температура поверхностного слоя воды увеличилась примерно на 1ºС (рис. 4а). Наиболее высокие концентрации среди биогенных веществ отмечены для кремния, содержание которого находилось в пределах 4–7 мкм (рис. 4б). Концентрация нитратов изменялась от 0,50 до 6,00 мкМ, аммония – от 0,50 до 4,00 мкМ. Содержание фосфатов составляло 0,02–0,37 мкМ. В этих условиях содержание хлорофилла а и биомасса фитопланктона изменялись слабо. Первый показатель был равен 0,50–0,70 мг·м-3, второй 20– 50 мг С·м-3 (рис. 4а). Относительная биомасса диатомовых водорослей в начальный период работ составляла 90–95%, а затем снижалась до 10–50% (рис. 4д). Видовой состав фитопланктона был практически такой же, как и в Севастопольской бухте.
Рис. 4. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1) и динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в Карантинной бухте в зимний (а, б, д) и весенний (в, г, е) периоды Fig. 4. Long-term dynamics: a, в – chlorophyll a concentration (1), phytoplankton biomass (2) and water temperature (3), б, г – concentration of nitrates (1), silicon (2), phosphates (3) and ammonium (4),
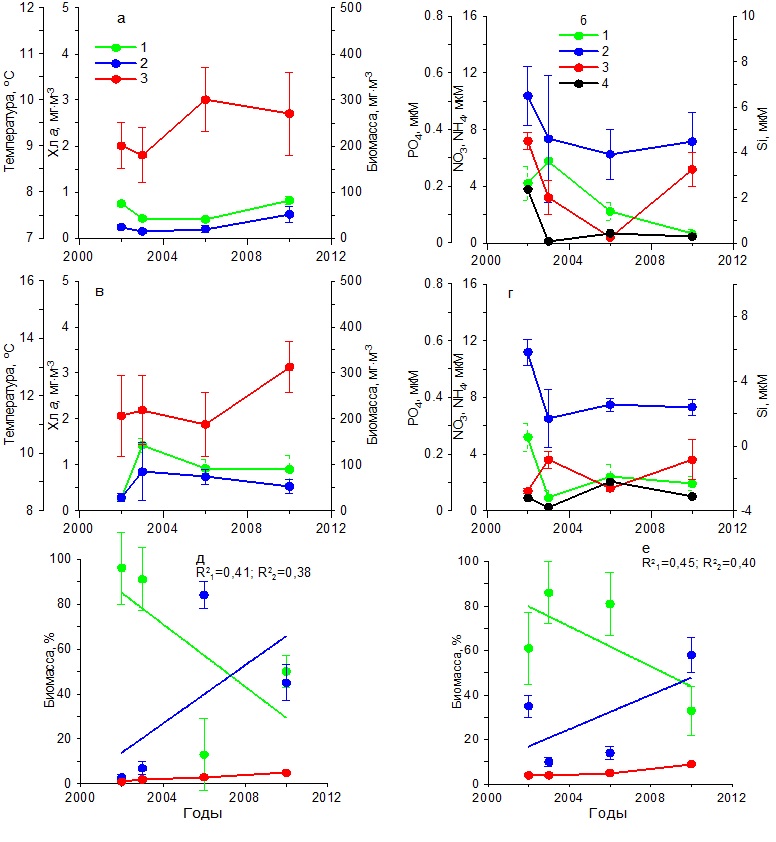
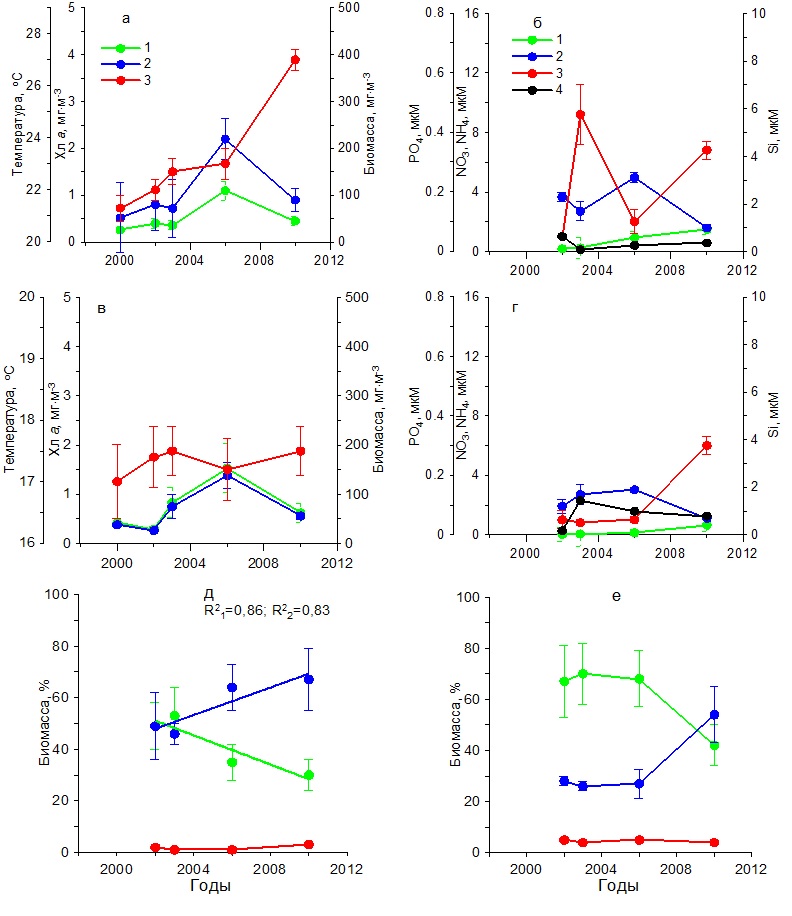
В весенний период температура воды повысилась от 11 до 13ºС (рис. 4в). Содержание нитратов и фосфатов было ниже, чем в зимний период. Тогда как концентрации аммония увеличились по сравнению с зимним периодом, а кремния незначительно снизились (рис. 4г). Содержание хлорофилла а изменялось от 0,30 до 1,50 мг·м-3, а биомасса фитопланктона от 20 до 60 мг С·м-3 с максимумом в 2003 г. (рис. 4в). Наиболее высокие значения удельной биомассы диатомовых водорослей наблюдались в 2003 г., составив 85%. Тогда как самая низкая их относительная биомасса (30%) получена в 2010 г., когда вклад динофитовых водорослей возрос до 60%, а кокколитофорид – до 8% (рис. 4д). Видовой состав фитопланктона в течение всего периода исследований в Карантинной и Севастопольской бухтах был практически одинаков. В летний период на фоне повышения с 2002 по 2010 гг. средних значений температуры на 5ºС концентрация хлорофилла и биомасса фитопланктона достигали максимальных значений в 2003 г., составив 2 мг·м-3 и 200 мг С·м-3 соответственно (рис. 5а), что совпадало с максимальным содержанием нитратов, кремния и фосфатов в этих водах (рис. 5б). Тогда как в остальные годы продукционные показатели существенно снижались, что обусловлено, вероятно, понижением содержания биогенных веществ в воде, прежде всего нитратов и кремния (рис. 5 а,б). Однако летом 2006 и 2010 гг. наблюдалось увеличение концентрации аммония до 1–2 мкМ. В период исследований доля диатомовых водорослей в суммарной биомассе фитопланктона изменялась от 58% в 2002 г. до 5% в 2010 г. Одновременно относительная биомасса динофитовых водорослей и кокколитофорид возрастала (рис. 5д). Осенью на фоне слабых изменений температуры воды значения концентрации хлорофилла а и биомассы фитопланктона были максимальными в 2003 г., составив 1,5 мг·м-3 и 120 мг С·м-3 соответственно (рис. 5в). В это время содержание нитратов составляло 2 мкМ, кремния – 2,5 мкМ, а фосфатов – 0,05 мкМ (рис. 5г). Последующее снижение концентраций нитратов и кремния вызвало падение продукционных показателей фитопланктона и относительной биомассы диатомовых водорослей к 2010 г. (рис. 5е). При этом доля динофитовых водорослей и кокколитофорид возрастала. Основные виды диатомовых и динофитовых в Карантинной бухте были те же, что и в Севастопольской бухте. Открытое прибрежье В течение 2002–2010 гг. в зимний период на фоне повышения температуры воды на 2ºС и изменений содержания биогенных веществ концентрация хлорофилла а и биомасса фитопланктона изменялись незначительно (рис. 6 а,б). Однонаправленных трендов в динамике доли диатомовых и динофитовых водорослей в суммарной биомассе фитопланктона не выявлено. Как правило, в фитопланктоне доминировали диатомовые водоросли (64–90%). Исключение составляет 2006 г., когда доля этой группы водорослей снизилась до 35% (рис. 6д). В весенний период на фоне многолетних изменений средних значений температуры воды в пределах 11–13ºС и непериодических колебаний содержания биогенных веществ максимальные значения концентрации хлорофилла (2 мг·м-3) и биомассы фитопланктона (160 мг С·м-3) наблюдались в 2003 г. (рис. 6 в,г), что совпало с максимальным вкладом диатомовых водорослей в суммарную биомассу фитопланктона – в среднем 78% (рис. 6е). В остальные годы величины продукционных параметров и доля диатомовых водорослей были значительно ниже. В летний период, когда межгодовые различия по температуре были максимальны (6ºС), однонаправленных изменений хлорофилла, биомассы фитопланктона и содержания биогенных веществ в исследованном районе не выявлено (рис. 7 а,б). Максимальные значения концентрации хлорофилла (1 мг·м-3) и биомассы фитопланктона (210 мг С·м-3) получены в 2006 г, когда среднее содержание кремния было максимальным (3 мкМ). В остальные годы наблюдалось снижение этих двух продукционных показателей. Доля диатомовых водорослей в общей биомассе фитопланктона с 2002 по 2010 гг. снижалась от 50 до 32%, а динофитовых и кокколитофорид возрастала (рис. 7д).
Рис. 5. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1) и динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в Карантинной бухте в летний (а, б, д) и осенний (в, г, е) периоды Fig. 5. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1) и динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в Карантинной бухте в летний (а, б, д) и осенний (в, г, е) периоды
В осенний период на фоне небольших межгодовых изменений температуры воды и низких концентраций биогенных веществ (рис. 7 в,г) концентрация хлорофилла а и биомасса фитопланктона достигли максимума в 2003 г. Содержание хлорофилла составило 1,50 мг·м-3, а биомасса фитопланктона – 120 мг С·м-3, тогда как в другие годы эти показатели были ниже. Доля диатомовых водорослей в суммарной биомассе фитопланктона составляла в разные годы около 70%. И только в 2010 г. снизилась до 45%. Остальную биомассу создавали в основном динофитовые водоросли и кокколитофориды (рис. 7е).
Рис. 6. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1) и динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в открытом прибрежье в зимний (а, б, д) и весенний (в, г, е) периоды Fig. 6. Long-term dynamics: a, в – chlorophyll a concentration (1), phytoplankton biomass (2) and water temperature (3), б, г – concentration of nitrates (1), silicon (2), phosphates (3) and ammonium (4),
Следовательно, максимальные многолетние изменения концентрации хлорофилла а, биомассы фитопланктона и относительной доли диатомовых водорослей в его суммарной биомассе наблюдались в летний и осенний периоды, тогда как в зимний вариабельность этих параметров была минимальной. Регрессионный анализ исходных данных показал, что для летнего периода многолетняя изменчивость удельной биомассы диатомовых водорослей (Б) обусловлена в основном двумя независимыми параметрами – содержанием нитратов (NO3) и температурой воды (T): Б = 2,098·NO3 – 9,512·T + 267,5877 (n = 48, R2 = 0,70, F = 15,047, p = 0,0004), (2) где n – объем выборки, R2 – коэффициент детерминации, F – критерий Фишера, p – уровень значимости. Из полученной зависимости следует, что по мере снижения концентрации нитратов и повышения температуры водной среды относительная доля диатомовых водорослей в суммарной биомассе фитопланктона понижается.
Рис. 7. Многолетняя динамика: а, в – концентрации хлорофилла а (1), биомассы фитопланктона (2) и температуры воды (3), б, г – концентрации нитратов (1), кремния (2), фосфатов (3) и аммония (4), д, е – доли диатомовых (1) и динофитовых (2) водорослей и кокколитофорид (3) в суммарной биомассе фитопланктона в открытом прибрежье в летний (а, б, д) и осенний (в, г, е) периоды Fig. 7. Long-term dynamics: a, в – chlorophyll a concentration (1), phytoplankton biomass (2) and water temperature (3), б, г – concentration of nitrates (1), silicon (2), phosphates (3) and ammonium (4),
Для осеннего периода основная доля многолетней изменчивости относительной биомассы диатомовых водорослей связана с содержанием нитратов и кремния (Si) в среде:
Б = 2,262·NO3 + 12,923·Si + 38,549 (n = 48, R2 = 0,67, F = 13,462, p = 0,0007) (3)
Как видно из регрессионного уравнения (3), 67% многолетней изменчивости относительной биомассы диатомовых водорослей в исследованных водах в осенний период обусловлено вариабельностью указанных двух независимых параметров. Остальная доля этой изменчивости связана с другими неучтенными факторами.
Обсуждение Динамика морского фитопланктона определяется совместным влиянием на него абиотических и биотических факторов среды. Климат и усиленное антропогенное воздействие влияют на эти факторы, что приводит к изменениям в структуре фитопланктона и его обилии (Winder, Sommer, 2012). Для выявления основных тенденций в фитопланктонном сообществе прибрежных районов Черного моря необходимы многолетние наблюдения. В российском секторе Черного моря такие работы активно проводятся в северо-восточных районах, и они свидетельствуют о снижении в последние годы численности и биомассы фитопланктона, изменениях в его видовом составе в бухтах курортных городов Анапы и Геленджика (Ясакова, 2014; Полякова, Полякова, 2016). Большое внимание исследователи уделяют выявлению основных механизмов «цветений» массовых видов диатомовых водорослей и кокколитофорид, обеспечивающих смену видов и таксономических групп в фитопланктоне (Silkin et al., 2019). Анализ многолетней динамики фитопланктона Севастопольской бухты, выполненный для периода 1940–2001 гг., свидетельствует об отсутствии однонаправленных изменений в среднегодовых значениях биомассы фитопланктона в это время. Отмечено постоянство таксономического состава видов-доминантов в фитопланктоне на протяжении целого ряда десятилетий, что, по мнению авторов, свидетельствует о значительной степени устойчивости данного сообщества к антропогенным, климатическим и биотическим воздействиям в этом регионе (Поликарпов и др., 2003). Однако, как отмечают некоторые исследователи (Орехова, Вареник, 2018), за последние 20 лет в экосистеме Севастопольской бухты отмечены значительные изменения гидрохимических, физико-химических и некоторых биологических характеристик. Они привели к развитию гипоксии и анаэробных условий в верхнем слое донных отложений, трансформации естественных режимов и природных циклов. Вероятно, эти изменения повлияли и на планктонные сообщества. Выполненный нами анализ, показал, что с 2000 по 2014 гг. в Севастопольской и Карантинной бухтах однонаправленные изменения в фитопланктоне наблюдались летом и осенью, когда температурная стратификация водной толщи наиболее выражена. В исследованный период среднесезонные значения концентрации хлорофилла и биомассы суммарного фитопланктона снизились в 2–5 раз. Это было обусловлено низким после 2006 г. содержанием нитратов и кремния в воде, а также снижением относительной доли диатомовых водорослей в суммарной биомассе фитопланктона в пользу динофитовых и кокколитофорид. Одна из особенностей динофитовых водорослей заключается в том, что они обладают значительно меньшим (в 2–3 раза), чем у диатомовых водорослей удельным содержанием хлорофилла а в клетках и низкими значениями удельной скорости роста (Мансурова, 2013). Поэтому при прочих равных условиях они обеспечивают меньший прирост концентрации хлорофилла и биомассы фитопланктона. Снижение вклада диатомовых водорослей в суммарную биомассу фитопланктона наблюдалось в бухтах практически во все сезоны, а на станции, расположенной в открытом прибрежье – только летом. Одна из основных причин таких перестроек таксономического состава фитопланктона обусловлена снижением содержания нитратов и соединений кремния в среде. Эти биогенные вещества необходимы для интенсивного развития диатомовых водорослей, тогда как динофитовые и кокколитофориды хорошо растут на аммонийном азоте в отсутствии кремния и нитратов (Glibert et al., 2016). Низкая относительная биомасса диатомовых водорослей летом 2010–2014 гг. по сравнению с предшествующим периодом (2000–2006 гг.) обусловлена не только понижением содержания биогенных веществ, но и действием высокой температуры, о чем может свидетельствовать выполненный нами регрессионный анализ. Прямое отрицательное влияние на диатомовые водоросли высокой летней температуры поверхностного слоя воды, возросшей за 15 лет на 6ºС, обусловлено, вероятно, тем, что максимальная температура роста, после которой наблюдается деградация их представителей, в частности S. costatum и C. curvisetus, составляет 23–25ºС. Тогда как для динофитовых этот показатель на 4–6ºС выше. Хотя некоторые виды диатомовых водорослей, выделенные из планктона Черного моря, например Thalassiosira weissflogii (Grunow) G.Fryxell & Hasle и Cylindrotheca closterium (Ehrenberg) Reimann & J.C. Lewin, по своей температурной устойчивости не отличаются от динофитовых водорослей (Акимов, Соломонова, 2019). Возможно, по этой причине в летний период в исследованных бухтах в 2010–2014 гг. доминировавшие ранее диатомовые водоросли, например представители рода Chaetoceros, были представлены в небольшом количестве. В тоже время другие виды, такие как N. tenuirostris и P. calcar-avis стали преобладать. Опосредованное отрицательное влияние высоких температур на диатомовые водоросли в летнее время связано, вероятно, с тем, что в бухты с хозяйственно-бытовыми стоками поступает большое количество органических форм азота, которые в процессе трансформации дают аммонийный азот. Его содержание в Севастопольской бухте летом 2010–2014 гг. превышало содержание нитратов примерно в 2 раза. Установлено, что это соединение азота даже при низких его концентрациях, составляющих десятые доли мкМ, ингибирует поглощение нитратов микроводорослями (Lomas, Glidert, 1999). В результате лимитирование роста диатомовых водорослей азотом может усиливаться, так как именно нитраты необходимы для их интенсивного роста. Следующей возможной причиной, вызывающей сокращение доли диатомовых водорослей в фитопланктоне в условиях высоких температур, может быть повышение скорости выедания фитопланктона микрозоопланктоном по мере увеличения температуры среды, так как эти гетеротрофные организмы чувствительны к действию температуры (Allen et al., 2005). Именно микрозоопланктон является основным потребителем мелкоклеточных и средних по размерам клеток диатомовых водорослей в море (Sherr, Sherr, 2007; Stelmakh, Georgieva, 2014).
Заключение В течение 2000–2014 гг. в исследованных поверхностных водах наиболее выраженные однонаправленные изменения концентрации хлорофилла а, биомассы фитопланктона и соотношения между его основными таксономическими группами наблюдались летом и осенью. В бухтах в эти периоды выявлено понижение среднесезонных значений концентрации хлорофилла а и биомассы фитопланктона приблизительно в 2–5 раза. Последнее обусловлено снижением содержания нитратов и соединений кремния в среде, а также относительной доли диатомовых водорослей в суммарной биомассе фитопланктона. Многолетнее понижение относительной биомассы диатомовых водорослей в фитопланктоне летом зависело в основном от содержания нитратов в воде и ее температуры, тогда как осенью – от содержания нитратов и кремния. Влияние температуры на фитопланктон имеет, вероятно, как прямой, так и опосредованный характер. Доля динофитовых водорослей и кокколитофрид за весь период наблюдений в большинстве случаев в районах работ увеличивалась. В бухтах зимой и весной, а в открытом прибрежье во все сезоны однонаправленных изменений концентрации хлорофилла и суммарной биомассы фитопланктона не выявлено.
Благодарности. Авторы выражают искреннюю благодарность сотрудникам ФИЦ ИнБЮМ Бабич И.М., Георгиевой Е.Ю. и Родионовой Н.Ю. за помощь в выполнении работы. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Исследование выполнено при финансовой поддержке РФФИ и города Севастополя в рамках научного проекта № 20-45-920002 «Стратегии адаптации фитопланктона и его потребление микрозоопланктоном под влиянием климатических изменений и антропогенной нагрузки на прибрежные экосистемы Черного моря (район Севастополя)».
Список литературы
Статья поступила в редакцию 14.12.2019
Об авторах Стельмах Людмила Васильевна – Stelmakh Liudmila V. доктор биологических наук lustelm@mail.ru Мансурова Ирина Мяулитовна – Mansurova Irina M. младший научный сотрудник, ФИЦ «Институт морских биологических исследований имени А.О. Ковалевского РАН», Севастополь, Россия (Kovalevsky Institute of Marine Biological Research RAS, Russia, Sevastopol), Отдел экологической физиологии водорослей ira.mansurova2013@yandex.ua Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИНБЮМ РАН; тел. (8692)-55-09-44.
ССЫЛКА НА СТАТЬЮ: Стельмах Л.В., Мансурова И.М. Многолетняя динамика фитопланктона и концентрации хлорофилла а в поверхностном слое прибрежных вод Черного моря (район Севастополя) // Вопросы современной альгологии. 2020. № 1 (22). С. 66–81. URL: http://algology.ru/1616 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-66-81
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Long-term dynamics of phytoplankton biomass and chlorophyll a concentration in the surface layer of the coastal waters of the Black Sea (Sevastopol region) Liudmila V. Stelmakh, Irina M. Mansurova Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia In the surface layer of the Sevastopol and Quarantine bays, during 2000–2014 in summer and in autumn, the average values of the concentration of chlorophyll a and phytoplankton biomass are reduced by a factor of 2–5. This is due to a decrease in the content of nitrates and silicon compounds in water, as well as the relative proportion of diatoms in the total biomass of phytoplankton. Regression analysis showed that in the summer period the long-term negative trend in the change in the relative biomass of diatoms was determined mainly by the nitrate content in the water and its temperature, while in the autumn – by the content of nitrates and silicon. The share of dinoflagellates and coccolithophores increased over the entire observation period. In winter and spring in bays, and in the open coast during all seasons, unidirectional changes in the concentration of chlorophyll and the total biomass of phytoplankton were not detected. Key words: phytoplankton biomass; chlorophyll a; diatoms; dinoflagellates; coccolithophores; nutrients; temperature; Black Sea
References
Authors Stelmakh Liudmila V. Orcid ID – https://orcid.org/0000-0003-2970-0281 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia lustelm@mail.ru Mansurova Irina M. Orcid ID – https://orcid.org/0000-0001-7171-6231 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia ira.mansurova2013@yandex.ua
ARTICLE LINK: Stelmakh L.V., Mansurova I.M. Long-term dynamics of phytoplankton and chlorophyll a concentration in the surface layer of the coastal waters of the Black Sea (Sevastopol region).Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 1 (22). P. 66–81. URL: http://algology.ru/1616 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-66-81
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||
|
| ||