
|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VIII Сабининские чтения 10 ноября 2019 - 29 февраля 2020 Роль элементов минерального питания в регуляции структуры фитопланктонного сообщества северо-восточной части Черного моря в конце мая 2019 г.
Лифанчук А.В.1, Федоров А.В.1, Алиева Э.И.2 Anna V. Lifanchuk, Alexey V. Fedorov, Elvina I. Alieva
1Институт океанологии имени П.П. Ширшова РАН, Южное отделение (Геленджик, Россия)
УДК 574.55: 574.24
Изучено влияние добавок азота и фосфора на видовую структуру фитопланктона в конце мая 2019 г. Повышение концентрации азота и фосфора в морской воде приводило к увеличению численности кокколитофорид, при этом относительная роль фосфора в регуляции численности была выше. Преобладанию мелкоклеточных диатомей в сообществе способствовала одновременная добавка азота и фосфора, при этом относительная роль азота была выше, чем фосфора. Увеличение концентраций азота при относительно низких концентрациях фосфора интенсифицировало рост крупноклеточных диатомей. Ключевые слова: фитопланктон; кокколитофориды; диатомовые водоросли; азот; фосфор.
Введение Фитопланктон представляет собой основу морской пищевой цепи и является важным компонентом биогеохимических процессов, регулирующим климат планеты (Паутова, Силкин, 2019; Hutchins, Fu, 2017). Без понимания закономерностей формирования структуры фитопланктонного сообщества невозможно оценить данные процессы (Cloern, Dufford, 2005). Многолетние наблюдения природных популяций с привлечением экспериментальных методов позволяют выявить механизмы регуляции структуры сообщества. Так, возможные экологические риски для водных экосистем, вызванные изменениями климата, могут быть спрогнозированы с применением экспериментальных исследований по влиянию колебаний температур, концентраций элементов минерального питания и их стехиометрии как на пресноводные (Gerhard et al., 2019; Hofmann et al., 2019; Schulhof et al., 2019; Thrane et al., 2017), так и на морские (Peter, Sommer, 2013; Skau et al., 2017) фитопланктонные сообщества. В Южном отделении Института океанологии им. П.П. Ширшова с 2005 г. изучается пространственно-временная изменчивость структуры фитопланктонного сообщества северо-восточной части Черного моря (Лифанчук, 2012; Силкин и др., 2009; Silkin et al., 2014; Silkin et al., 2016). Целью данной работы, продолжающей цикл исследований, было определение с помощью полевых наблюдений и экспериментов влияния концентраций элементов минерального питания на видовую структуру фитопланктонного сообщества в конце мая 2019 г. в северо-восточной части Черного моря.
Материалы и методы В данной работе были применены полевые и экспериментальные исследования.
На МНИС «Ашамба» был выполнен разрез из Голубой бухты (район Геленджика) к центру моря, в ходе которого производили отбор проб фитопланктона для определения структуры сообщества. На станции над изобатой 50 м (44°32’N, 37°57’E) с глубины 0–0,5 м пластиковой емкостью объемом 5 л отобрали морскую воду, которую затем распределили между 4,5 л емкостью (экспериментальные исследования) и пластиковой бутылкой объемом 0,5 л. Пробу морской воды в бутылке зафиксировали 40%-ным формалином, нейтрализованным бурой (Na2BO3). Конечная концентрация формалина в пробе составляла 1%. Концентрирование проб проводилось методом отстаивания (Суханова, 1983). Идентификация видов и подсчет числа клеток проводились с использованием микроскопа ЛЮМАМ И-3 в счетной камере Нажотта объемом 0,05 мл для нанопланктона и Наумана объемом 1,0 мл для микропланктона. При расчете биомассы применен метод «истинного объема» (Киселев, 1969), биомасса выражена в единицах сырой биомассы (мг/м3). Идентификация видов проводилась с помощью Identifying Marine Phytoplankton (1997) и электронных ресурсов www.algaebase.org и www.marinespecies.org.
В береговой лаборатории ЮО ИО РАН (г. Геленджик) проводились исследования по влиянию добавок нитратов и фосфатов на структуру фитопланктонного сообщества. Вода для экспериментов была взята одновременно с полевыми пробами. Пробы воды отбирали в пластиковые емкости объемом 4,5 л с одновременной фильтрацией через два слоя мельничного газа №36 для удаления зоопланктона. Эксперименты проводили в 0,5-литровых колбах Эрленмейера, объем культуральной среды составлял 200 мл. Опыты поставлены с применением метода планирования экспериментов, которые позволяют получать уравнения регрессии, отражающие действие выбранных факторов на изучаемый параметр (Максимов, Федоров, 1969). Исходным параметром для построения уравнений регрессии служила биомасса доминирующих видов фитопланктона в стационарной фазе роста накопительной культуры, а действующими факторами – добавки азота и фосфора, с соотношением их концентраций близким к соотношению Редфилда. Конечная концентрация элементов минерального питания в колбе после добавления составляла 12–14 мкМ и 1 мкМ для нитратов и фосфатов соответственно. Для эксперимента использовалась схема полного факторного эксперимента (табл. 1) (Максимов, 1980). В табл. 1 знак «+» означает добавку элементов минерального питания, «-» – отсутствие добавки. Для вычисления влияния элементов минерального питания на увеличение биомассы или численности в стационарной фазе роста, знак «-» или «+» должен быть заменен на X1 (добавка азота) и X2 (добавка фосфора) в уравнении регрессии: Υ=b0 + b1X1 + b2X2 + b12X1X2, где коэффициент b0 равен среднему арифметическому результатов эксперимента (биомасс) во всех вариантах; b1X1 – эффект добавки азота; b2X2 – эффект добавки фосфора; b12X1X2 – эффект совместной добавкой азота и фосфора.
Таблица 1. План экспериментов по изучению влияния добавок элементов минерального питания на рост доминирующих видов фитопланктона Table 1. Plan of experiments to study the effect of additives of mineral nutrients on the growth of dominant phytoplankton species
В эксперименте использовали аппарат для культивирования, где температура среды соответствовала температуре морской воды в месте отбора проб – 18оС. Интенсивность падающего света поддерживалась на уровне 58–61 мкмоль/(м2×с) ФАР; фотопериод составлял 16 ч света : 8 ч темноты. Во всех экспериментах применялся накопительный режим культивирования. Подсчет количества клеток водорослей проводили ежедневно, используя камеру Нажжота объёмом 0,05 мл. Для расчета биомассы использовался метод, основанный на геометрической форме клеток (Киселев, 1969). Биомасса была выражена в единицах сырого веса (мг/м3).
Результаты и обсуждения Полевые исследования В конце мая 2019 г. в структуре фитопланктонного сообщества доминантами являлись кокколитофориды, их доля составила 85% (рис. 1). Такое интенсивное развитие характерно для данного сезона (Pautova et al., 2007; Mikaelyan et al., 2011, 2015). Численность Emiliania huxleyi в этот период достигала 2,5×106 кл/л. Остальные группы фитопланктона составляли лишь 15% от общей биомассы. Доля диатомей в структуре фитопланктонного сообщества в это время была невелика, всего 3%. Они были представлены видами Pseudo-nitzschia pseudodelicatissima, Thalassionema nitzschioides и Dactyliosolen fragilissimus с превалированием последней (табл. 2). Таким образом, исходная популяция представляла собой практически монокультуру Emiliania huxleyi с редкими вкраплениями динофлагеллят и диатомей в сообществе фитопланктона. Подобная картина наблюдалась в начале июня 2012 г., тогда доля кокколитофорид в сообществе превысила 70%, а численность составила 9×106 кл/л (Лифанчук, 2017).
Рис. 1. Структура фитопланктонного сообщества (биомасса) в поверхностном слое воды (0–0,5 м) на шельфовой станции над изобатой 50 м 21.05.2019 г. Fig. 1. The structure of the phytoplankton community (biomass) in the surface water layer (0–0.5 m) at a shelf station above the isobath of 50 m on May 21, 2019
Таблица 2. Видовой состав и биомасса фитопланктонного сообщества в поверхностном слое воды (0–0,5 м) на шельфовой станции над изобатой 50 м 21.05.2019 г. Table 2. Species composition and biomass of the phytoplankton community in the surface water layer (0–0.5 m) at a shelf station above the isobath of 50 m on May 21, 2019
Экспериментальные исследования При накопительном культивировании природного фитопланктона интенсивный прирост биомассы происходит прежде всего у видов, относящихся к доминантам или субдоминантам в природном сообществе. В экспериментах доминатом являлась кокколитофорида Emiliania huxleyi, а субдоминантами – диатомовые водоросли Pseudo-nitzschia pseudodelicatissima и Dactyliosolen fragilissimus. Максимальные биомассы кокколитофориды Emiliania huxleyi и мелкоклеточной диатомеи Pseudo-nitzschia pseudodelicatissima наблюдались на 7 день эксперимента в варианте с совместным добавлением элементов минерального питания и составили 23263,6 и 7246,6 мг/м3 соответственно (рис. 2).
Рис. 2. Рост биомассы кокколитофориды Emiliania huxleyi и диатомеи Pseudo-nitzschia pseudodelicatissima в варианте эксперимента с совместной добавкой нитратов и фосфатов Fig. 2. The growth of biomass of coccolithophorids Emiliania huxleyi and diatoms Pseudo-nitzschia pseudodelicatissima in a variant of the experiment with the combined addition of nitrates and phosphates
Уравнение регрессии, описывающее влияние элементов питания на рост кокколитофориды Emiliania huxleyi, имеет вид: Wst=7112 + 5083 N +5292 P + 5166 NP (95% доверительный интервал – 551,0), где Wst – биомасса кокколитофориды Emiliania huxleyi в стационарной фазе роста. Значения коэффициентов уравнения регрессии, описывающих уровень накопленной биомассы, указывают на то, что как совместная добавка фосфора и азота приводила к интенсивному развитию кокколитофориды Emiliania huxleyi в конце весны 2019 г. При этом относительный вклад фосфора выше, чем азота. Уравнение регрессии, описывающее влияние добавок азота и фосфора на биомассу диатомеи Pseudo-nitzschia pseudodelicatissima, выглядит следующим образом: Wst= 2205,0 + 1991 N + 1382 P + 1341 NP (95% доверительный интервал – 419,4) Данное уравнение показывает, что одновременная добавка азота и фосфора интенсифицировала рост этого вида, при этом вклад азота в стимулирование роста этой диатомовой водоросли превышает вклад фосфора. Максимальная биомасса крупноклеточной диатомовой водоросли Dactyliosolen fragilissimus в периодической культуре зафиксирована на 7 день эксперимента в варианте с добавлением нитратов и составила 2480,6 мг/м3. Для диатомеи Dactyliosolen fragilissimus уравнение регрессии имеет вид: Wst= 1612 + 310 N – 294 P – 132 NP (95% доверительный интервал – 479,8) Совместная добавка элементов минерального питания не приводила к значимому эффекту на рост диатомеи D. fragilissimus. Наиболее интенсивный рост вид демонстрировал при добавлении только азота. Представим уравнение регрессии только с добавкой азота: Wst= 1613,7 + 310,4 + 294,3 + 133,6 = 738,3 > 479,8 Конечный результат превышает доверительный интервал, математически доказывая то, что рост Dactyliosolen fragilissimus был лимитирован концентрацией азота в море.
Fig. 3. Concretization of the figure from the article Silkin V.A. et al. (2019a), taking into account the coexistence of species at the end of May 2019 in the northeastern Black Sea
Экспериментальные исследования в северо-восточной части Черного моря показали, что важным регулятором роста кокколитофорид является фосфор (Лифанчук, 2017; Silkin et al., 2014). Данный вид способен расти при низких концентрациях азота, что связано с более низкими значениями константы полунасыщения для поглощения азота. Константа полунасыщения является ключевым параметром при определении способности вида конкурировать за данный элемент питания согласно теории R-competition Тилмана (Tilman, 1977; Tilman et al., 1982). Выигрывает конкуренцию вид, способный расти при более низких концентрациях ресурса. Низкие концентрации азота и высокие фосфора приводят к соотношению N:P ниже соотношения Редфилда, являясь необходимым условием для доминирования кокколитофорид (Silkin et al., 2014). Мелкоклеточные диатомеи преобладают в сообществе при соотношении азота к фосфору близкому к соотношению Редфилда (N:P=16) (Silkin et al., 2019b). Совместная добавка азота и фосфора в накопительную культуру водорослей интенсифицировала рост кокколитофориды Emiliania huxleyi и мелкоклеточной диатомеи Pseudo-nitzschia pseudodelicatissima в зоне сосуществования видов (рис. 3). Крупноклеточные диатомеи доминируют при соотношении азота к фосфору выше соотношения Редфилда (N:P>16) (Silkin et al., 2019a). Наши экспериментальные исследования подтвердили данное утверждение, показав, что увеличение концентрации азота усилило рост диатомеи Dactyliosolen fragilissimus (рис. 3) в зоне сосуществования с мелкоклеточными диатомеями. Хотя рост мелкоклеточной диатомеи Pseudo-nitzschia pseudodelicatissima вызван совместной добавкой элементов минерального питания, но вклад азота был выше. Значения биомассы и численности динофлагеллят в экспериментах по добавлению элементов минерального питания в накопительную поливидовую культуру на основе природного сообщества фитопланктона были сравнимы с ошибкой эксперимента, что связано с их низкими количественными показателями в начале эксперимента и с неспособностью конкурировать с кокколитофоридами и диатомовыми водорослями.
Выводы Экспериментальные исследования показали, что концентрации и соотношение азота и фосфора являются важными регулирующими факторами структуры фитопланктонного сообщества в северо-восточной части Черного моря. Установлено, что в конце мая 2019 г. доминантом являлась кокколитофорида Emiliania huxleyi. Совместное повышение концентрации фосфора и азота в морской воде ответственно за увеличение численности кокколитофорид и преобладание этих водорослей в структуре сообщества, но вклад фосфора был выше. Добавка элементов минерального питания, соотношение которых было близко к соотношению Редфилда, интенсифицировала рост мелкоклеточной диатомеи Pseudo-nitzschia pseudodelicatissima. При низких концентрациях фосфора и высоких азота, когда соотношение азота к фосфору было существенно выше соотношения Редфилда, происходил рост крупноклеточной диатомеи Dactyliosolen fragilissimus. Результаты данных исследований подтверждают выводы предыдущих работ и убедительно показывают, что, изменяя концентрации азота и фосфора и их соотношение в среде, можно регулировать структуру сообщества фитопланктона в паре диатомовые–кокколитофориды.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Статья поступила в редакцию 23.12.2019
Об авторах Лифанчук Анна Викторовна – Lifanchuk Anna V. кандидат биологических наук lifanchuk.anna@mail.ru Фёдоров Алексей Владимирович – Lifanchuk Anna V. младший научный сотрудник, ФГБУН «Институт океанологии им.П.П.Ширшова РАН», Южное отделение, Геленджик, Россия (Shirshov Institute of Oceanology RAS, Southern Branch, Gelendzhik, Russia) aleksey_fedorov_199001@mail.ru Алиева Эльвина Исмаиловна – Alieva Elvina I. студент, Кубанский государственный университет, Краснодар, Россия (Kuban State University, Krasnodar, Russia), Биологический факультет, кафедра Зоологии elvinaalieva98.98@mail.ru Корреспондентский адрес: Россия, 353470, Краснодарский край, г. Геленджик, ул. Просторная 1-г. Телефон/факс 8-861-41-280-89.
ССЫЛКА НА СТАТЬЮ: Лифанчук А.В., Федоров А.В., Алиева Э.И. Роль элементов минерального питания в регуляции структуры фитопланктонного сообщества северо-восточной части Черного моря в конце мая 2019 г. // Вопросы современной альгологии. 2020. № 1 (22). С. 56–65. URL: http://algology.ru/1614 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-56-65
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
The role of mineral nutrients in regulation of phytoplankton community structure of the North-Eastern part of the Black Sea at the end of May 2019 Anna V. Lifanchuk1, Alexey V. Fedorov1, Elvina I. Alieva2 1Shirshov Institute of Oceanology RAS, Southern Branch (Gelendzhik, Russia) The effect of nitrogen and phosphorus additives on the species structure of the natural phytoplankton population at the end of May 2019 was studied. An increase in the concentration of nitrogen and phosphorus in seawater led to a rise in the number of coccolithophores, while the relative contribution of phosphorus was higher. The predominance of small-cell diatoms in the community was facilitated by the simultaneous addition of nitrogen and phosphorus. In contrast, the relative contribution of nitrogen was higher than that of phosphorus. An increase in nitrogen concentrations at relatively low phosphorus concentrations intensified the growth of large-cell diatoms. Key words: phytoplankton; coccolithophores; diatoms; nitrogen; phosphorus
References
Authors Lifanchuk Anna V. Orcid ID – https://orcid.org/0000-0001-9953-7374 Shirshov Institute of Oceanology RAS, Southern Branch, Gelendzhik, Russia lifanchuk.anna@mail.ru Fedorov Aleksey V. Orcid ID – https://orcid.org/0000-0003-4673-6649 Shirshov Institute of Oceanology RAS, Southern Branch, Gelendzhik, Russia aleksey_fedorov_199001@mail.ru Alieva Elvina I. Orcid ID – https://orcid.org/0000-0003-0244-0926 Kuban State University, Krasnodar, Russia elvinaalieva98.98@mail.ru
ARTICLE LINK: Lifanchuk A.V., Fedorov A.V., Alieva E.I. The role of mineral nutrients in regulation of phytoplankton community structure of the North-Eastern part of the Black Sea at the end of May 2019. Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 1 (22). P. 56–65. URL: http://algology.ru/1614 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-56-65
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required

|
|||
|
| ||
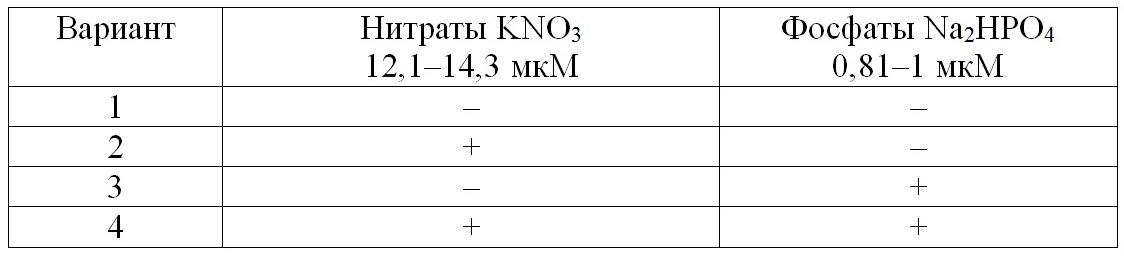
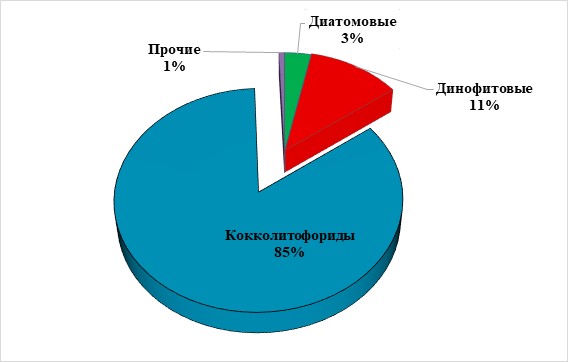
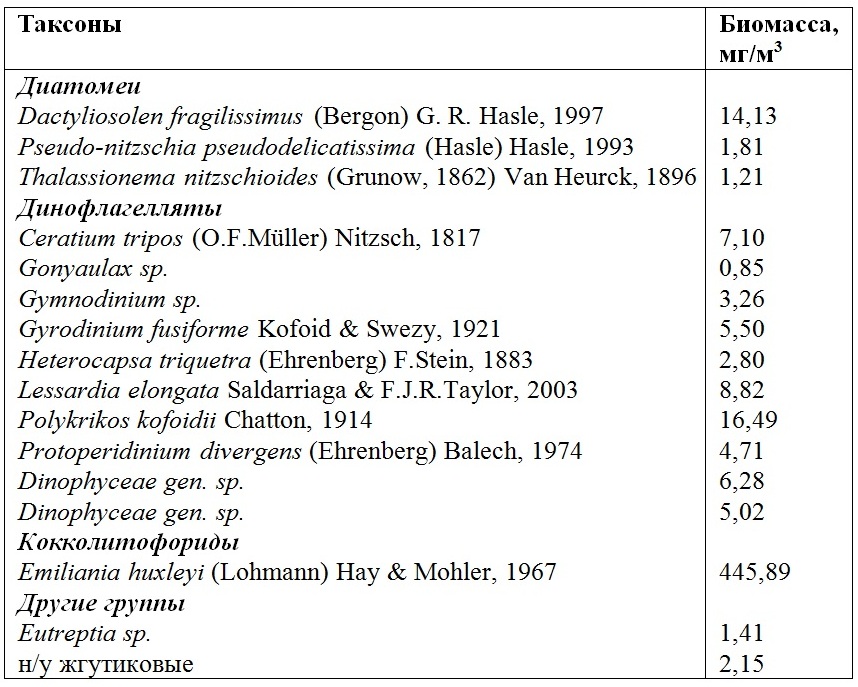
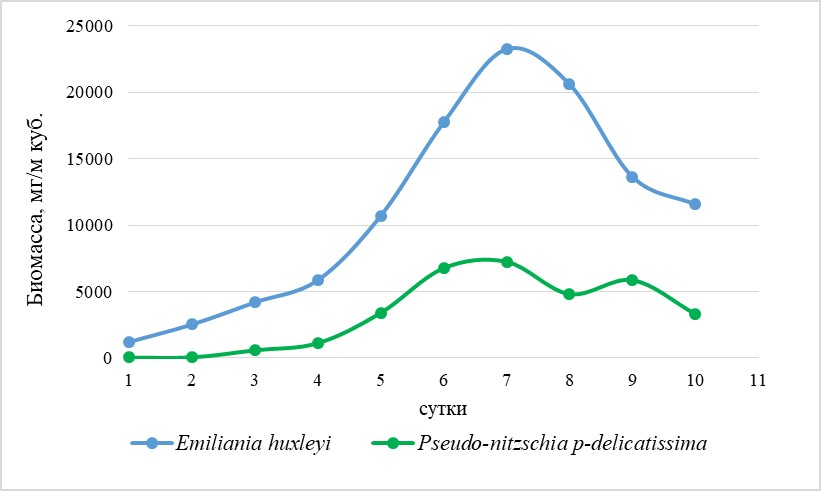
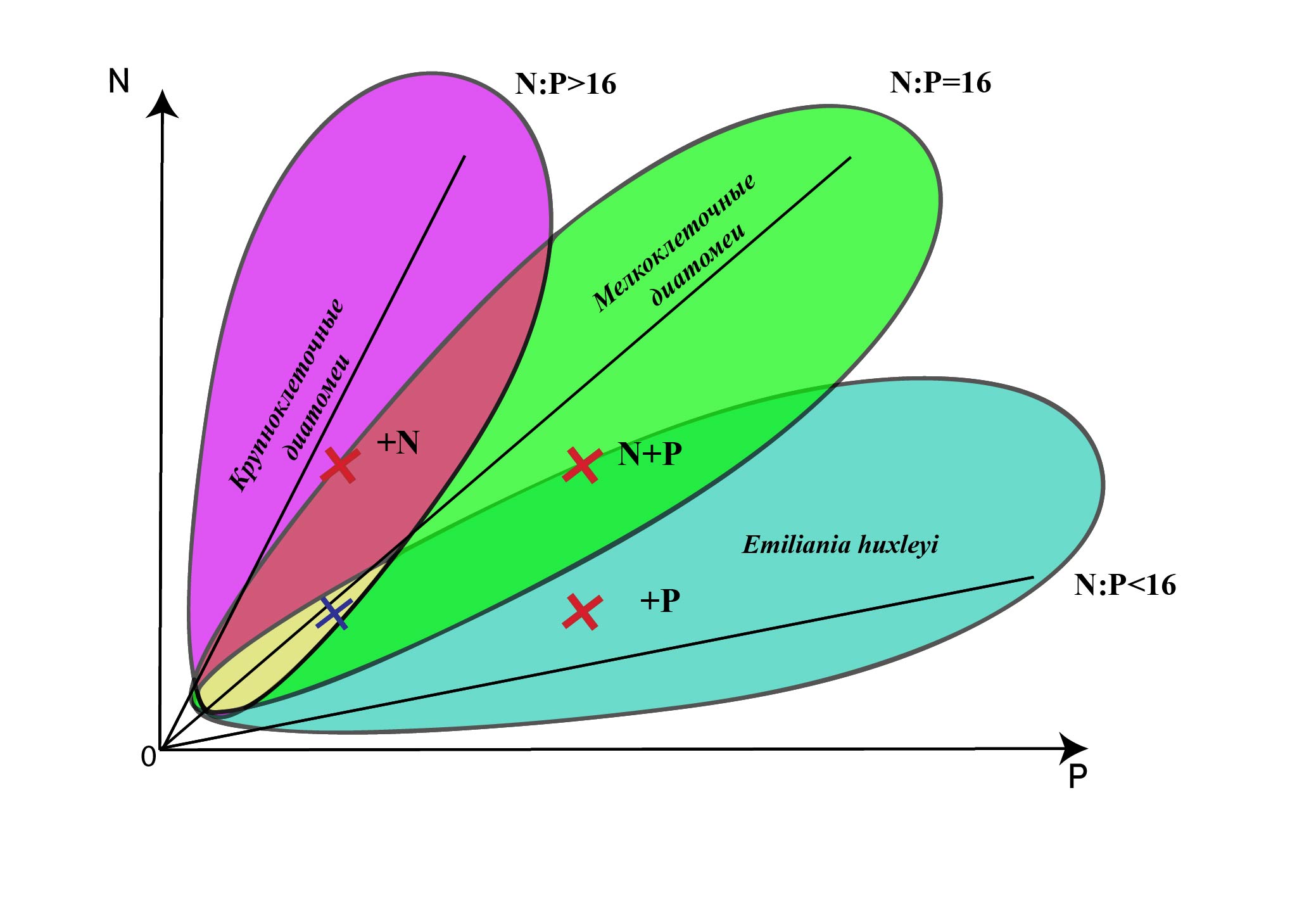 Рис. 3. Конкретизация рисунка из статьи Силкина В.А. и соавторов (Silkin et al., 2019a) с учетом сосуществования видов в конце мая 2019 г. в северо-восточной части Черного моря
Рис. 3. Конкретизация рисунка из статьи Силкина В.А. и соавторов (Silkin et al., 2019a) с учетом сосуществования видов в конце мая 2019 г. в северо-восточной части Черного моря