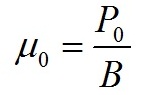|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VIII Сабининские чтения 10 ноября 2019 - 29 февраля 2020 Зависимость удельной скорости эндогенного расхода и валовой продуктивности культуры микроводорослей от облучённости
Авсиян А.Л., Лелеков А.С. Anna L. Avsyan, Alexander S. Lelekov
Федеральный исследовательский центр
УДК 58.035.3+57.036
В работе предложены выражения для расчёта валовой продуктивности и удельной скорости расхода культуры микроводорослей на основании продукционных характеристик. Проведена верификация полученных выражений для Arthrospira platensis и Dunaliella salina, и показано, что валовая продуктивность и удельная скорость расхода линейно возрастают при увеличении облучённости. Определена удельная скорость дыхания поддержания (0,01 ч-1 для A. platensis и 0,01–0,04 сут-1 для D. salina). Ключевые слова: культура микроводорослей; наблюдаемая продуктивность; дыхание роста; дыхание поддержания; фотобиосинтез; моделирование.
Введение Исследования процессов роста фотоавтотрофных организмов традиционно проводятся на культурах микроводорослей. Основным достоинством использования культур является возможность получения воспроизводимых результатов. Это позволяет дать количественную оценку влияния того или иного фактора на скорость фотобиосинтеза, где под фотобиосинтезом понимаем согласованный синтез всех клеточных структур, т.е. биологический синтез живой структуры. Кроме того, к достоинствам культур микроводорослей при проведении гидробиологических исследований отнесём малые, часто правильные геометрические размеры и высокую скорость размножения. Как в естественных, так и в искусственных условиях скорость роста микроводорослей определяется разностью между валовой продуктивностью и скоростью эндогенного расхода биомассы. Валовая продуктивность в отсутствии лимитирования по биогенным элементам определяется притоком энергии в области ФАР, коэффициентом поглощения, а также эффективностью ее утилизации (Тренкеншу, Лелеков, 2017). Для естественных условий приток суммарной солнечной радиации на земную поверхность зависит от многих факторов, таких как время года, широта и долгота местности, оптические характеристики атмосферы, рельеф местности и пр. Для многих стран составлены подробные карты распределения притока солнечной энергии (Справочник ..., 1966), поскольку это важно для многих исследовательских работ в области возобновляемых и нетрадиционных источников энергии. При выращивании микроводорослей в лабораторных условиях облучённость культуры определяется спектром и мощностью используемого источника освещения (Гаврилов, Костылев, Лелеков, 2018). Как на свету (наряду с фотосинтезом), так и в темноте происходит эндогенный расход биомассы в результате темнового дыхания. Основными функциями расхода биомассы в ходе эндогенного катаболизма являются энергетическое обеспечение процессов поддержания, а также обеспечение процессов фотобиосинтеза необходимыми АТФ, НАДФ·Н и углеродными скелетами. Согласно общепринятой парадигме моделирования компонентов дыхания растений (Amthor, 2000), дыхание микроводорослей также можно разделить на «дыхание роста» и «дыхание поддержания» (Cournac et al., 2002, Raven, Beardall, 2016). Концепция энергии поддержания используется и для моделирования энергетики роста в культурах бактерий (Pirt, 1965). Расход биомассы и энергии на поддержание определяется обновлением клеточных структур (главным образом, белков), восстановлением фотоповреждённых компонентов фотосистем, поддержанием градиентов растворённых веществ. «Дыхание роста» обеспечивает поглощение неорганических ионов, включение этих ионов в промежуточные метаболические соединения и синтез из этих соединений структурных и функциональных компонентов клетки (Geider, Osborne, 1989; Raven, Beardall, 2016). Кроме дыхания, потери органического углерода могут происходить за счёт выделения экзометаболитов (Hulatt, Thomas, 2010). Ранее нами сформулированы базовые принципы, на основе которых должно строиться моделирование фотобиосинтеза (Лелеков, Тренкеншу, 2018). Одно из ключевых положений говорит о том, что нормированная скорость (удельная скорость) синтеза биомассы в зависимости от приведённой плотности потока лимитирующего субстрата описывается ломаными. Цель данной работы – моделирование влияния облучённости на величину валовой продуктивности и удельной скорости расхода культуры микроводорослей.
Результаты и обсуждение Рассмотрим процессы, определяющие изменение продуктивности с увеличением плотности популяции низших фототрофов. В соответствии с представлениями о моделировании фотобиосинтеза (Лелеков, Тренкеншу, 2018) для каждой интенсивности света в данных условиях при отсутствии лимита по биогенным элементам среды существует некоторое значение валовой продуктивности P0 :
где Isat – насыщающая облучённость, при которой скорость синтеза биомассы достигает максимального значения. Энергия Iе определяется коэффициентом поглощения α и поверхностной облученностью I0:
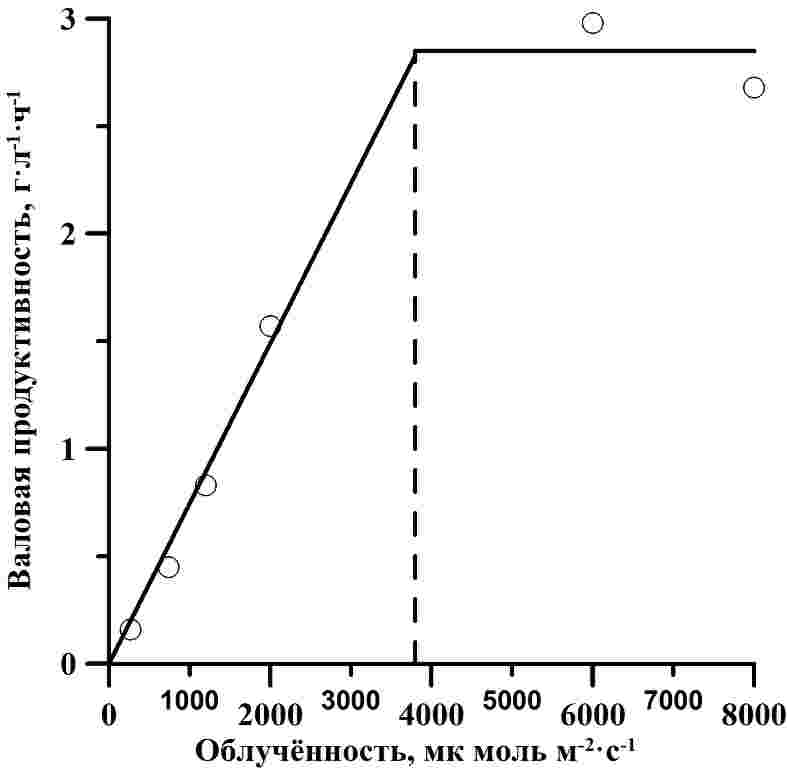
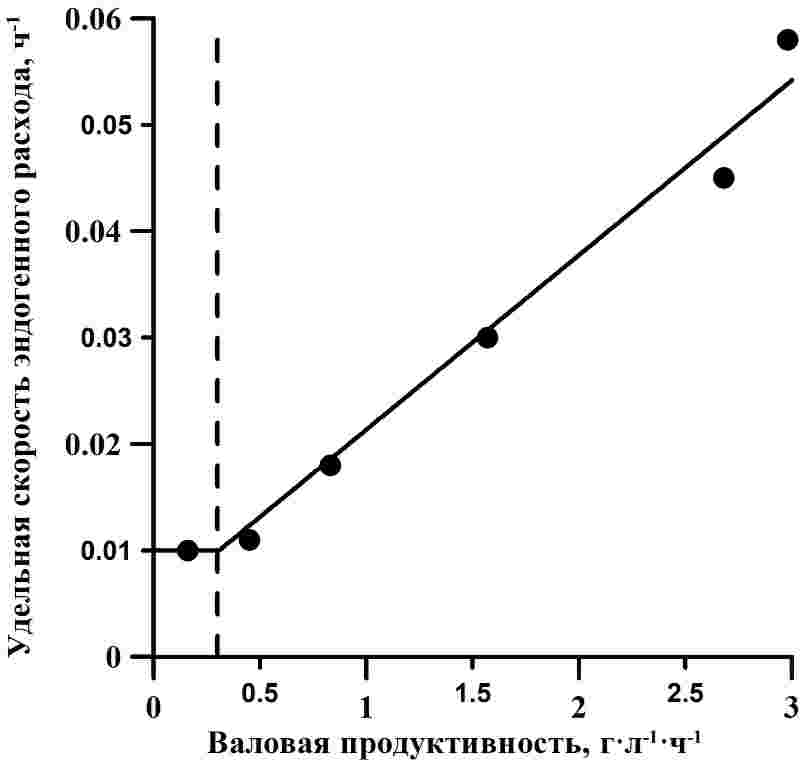
Для оптически плотных культур микроводорослей вся падающая световая энергия поглощается. При неизменных световых условиях и отсутствии лимитирования другими факторами среды величина валовой продуктивности будет константой (P0 = const) и определяется поверхностной облучённостью. Валовая продуктивность отражает скорость синтеза биомассы в клетке. Однако в то же время происходит эндогенный расход биомассы для энергетического обеспечения жизнедеятельности клетки. Скорость потери биомассы путем эндогенного расхода обозначим Pr : где μr – удельная скорость расхода; B – плотность культуры. Наблюдаемая продуктивность P в каждый момент времени будет равна разности между валовой продуктивностью и скоростью эндогенного расхода биомассы: Снижение величины продуктивности при росте плотности культуры микроводорослей обусловлено тем, что при неизменной валовой продуктивности возрастают потери, связанные с эндогенным расходом биомассы. Соотношение интенсивности дыхательных процессов с интенсивностью фотосинтеза и скоростью роста давно вызывает большой интерес исследователей, поскольку оно важно для моделирования роста и расчёта продуктивности микроводорослей. Интенсивность дыхания микроводорослей зачастую оказывается линейно зависимой от их скорости роста (Geider, Osborne, 1989): где μ – удельная скорость роста культуры; μr0 – минимальная удельная скорость поддержания при μ = 0; b – безразмерный коэффициент. Подобный подход основывается на том, что дыхание микроводорослей подразделяется на «дыхание роста» и «дыхание поддержания» (Cournac et al., 2002, Raven, Beardall, 2016). Метаболические затраты на поддержание по определению не зависят от скорости роста, тогда как эндогенный расход биомассы, относящийся к «дыханию роста» обеспечивает энергетические потребности биосинтетических процессов (Raven, Beardall, 2016). К недостаткам модели (4) следует отнести попытку связать величину μr с наблюдаемой удельной скоростью роста. Согласно (1), скорость роста культуры микроводорослей ограничена либо световым потоком, либо газовым обеспечением, либо потоком биогенных элементов на ключевой регулятор энергообмена. В случае отсутствия света, макроэрги будут находиться в окисленных формах НАДФ+ и АДФ, поступление энергии для биосинтеза возможно только за счёт внутриклеточных запасных веществ, к которым, в первую очередь, относятся углеводы. Митохондриальное дыхание (Raven, Beardall, 2016) позволяет покрыть недостаток восстановленных макроэргов, однако скорость синтеза биомассы будет лимитирована недостатком первичных моносахаров, следовательно, потери АТФ, связанные с «дыханием роста», будут снижаться. При недостатке СО2 в клетках будут накапливаться восстановленные формы при фотосинтезе НАДФ·Н и АТФ, так как не будет происходить их отток на синтез фосфорилированных сахаров и других продуктов цикла Кальвина. В таких условиях клеточная потребность в макроэргах снижается, а, следовательно, по принципу обратной связи уменьшается митохондриальное дыхание. При нехватке азота будет остановлен синтез аминокислот, полипептидов, биосинтез будет направлен в сторону образования углеводов и липидов за счёт энергии макроэргов, интенсивность потерь энергии на транспорт биогенных элементов в клетку снижается. Это подтверждается исследованиями, показавшими увеличение потребления кислорода и выделения углекислого газа при добавлении солей азота в культуру Selenastrum minutum, лимитированную по азоту (Weger, Turpin, 1989). Таким образом, можно сделать вывод, что скорость эндогенного расхода биомассы определяется не наблюдаемой, а валовой продуктивностью. В случае лимитирования роста световыми условиями, «дыхание роста» можно считать прямо пропорциональным количеству поглощённой энергии. Считая дыхание поддержания малой величиной, коэффициент пропорциональности легко определить в накопительной культуре: при достижении стационарной фазы роста, наблюдаемая продуктивность равна нулю, следовательно, с учётом (3): Для верификации представленных выражений рассмотрим данные зависимости наблюдаемой скорости роста от биомассы культуры A. platensis при различной облучённости (Qiang et al., 1998). При аппроксимации экспериментальных данных выражением (3) были определены значения валовой продуктивности и удельной скорости расхода биомассы (Авсиян, Тренкеншу, 2017). Стоит отметить, что данные значения продуктивности получены в культуре A. platensis с ультравысокой плотностью (10–50 г·л-1) и при высоких величинах облученности фотобиореакторов, которые не наблюдаются в естественных условиях (Qiang et al., 1998). На рисунке 1А представлена зависимость валовой продуктивности от облучённости. Отметим, что данные описываются (R2 = 0,99) ломанными (1). Отношение максимальной скорости роста к насыщающей облучённости, согласно расчётам, составляет 0,00074, Isat – около 3800 мкмоль·м-2·с-1. Зависимость удельной скорости расхода от облучённости имеет аналогичный вид. Больший интерес представляет зависимость удельной скорости поддержания от валовой продуктивности (рис. 1Б). Уменьшение P0 приводит к соответствующему снижению μr вплоть до некоторой величины, которая определяет «дыхание поддержания». По нашим расчётам для культуры A. platensis согласно экспериментальным данным (Hu,1998) удельная скорость поддержания структуры составляет 0,01 ч-1 или 0,24 сут-1. Удельная скорость потерь, связанных с ростом, возрастает при увеличении валовой продуктивности (и облучённости) с коэффициентом 0,016. Рис. 1. А – зависимость рассчитанной (Авсиян, Тренкеншу, 2017) валовой продуктивности от облучённости для A. platensis (по данным Qiang et al., 1998). Сплошная линия – аппроксимация данных выражением (1) (R2 = 0,99). Пунктирная линия показывает графический способ определения насыщающей освещённости, Isat = 3800 мкмоль·м-2 с-1. В – зависимость удельной скорости расхода от валовой продуктивности (по данным Qiang et al., 1998). Аппроксимация данных линейным сплайном (R2 = 0,98). Пунктирная линия показывает графический способ определения удельной скорости дыхания поддержания
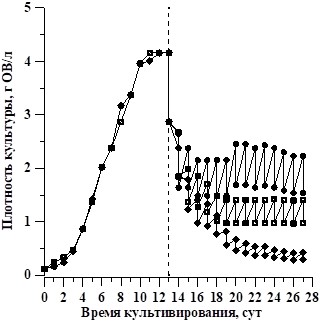
Для сравнения оценим удельную скорость расхода и валовую продуктивность культуры зелёной водоросли Dunaliella salina при её выращивании в накопительном и квазинепрерывном режимах при различной облучённости (Боровков, Гудвилович, 2014). На рисунке 2 представлены кривые роста D. salina.
Рис. 2. Кривые роста культуры D. salina в накопительном и квазинепрерывном режимах культивирования при различной поверхностной облучённости (Боровков, Гудвилович, 2014):
На тринадцатый день накопительного роста плотность культуры достигла максимального значения 4,16 г ОВ/л, таким образом для облученности 350 мкмоль·м-2·с-1 валовая продуктивность и удельная скорость расхода связаны соотношением:
Учитывая последнее соотношение и выражение (3), для непрерывного режима культивирования рассчитаем величины валовой продуктивности и удельной скорости расхода, используя экспериментально определенные значения наблюдаемой продуктивности Р и стационарной плотности культуры В. Рассчитанное значение валовой продуктивности P0 также позволяет определить величину валовой удельной скорости роста μ0: Рассчитанные параметры представлены в таблице 1.
Таблица 1. Продукционные характеристики D. salina, при различной поверхностной облучённости Table 1. D. salina productional characteristics under different surface irradiance
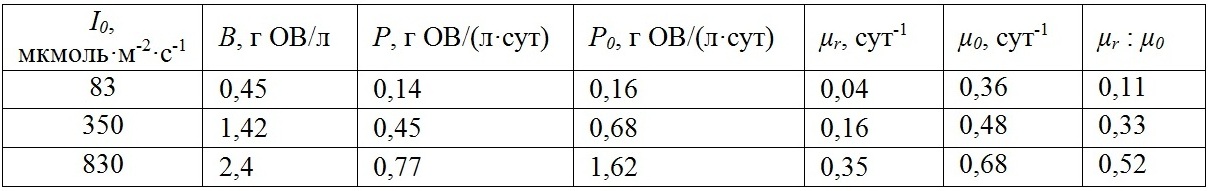
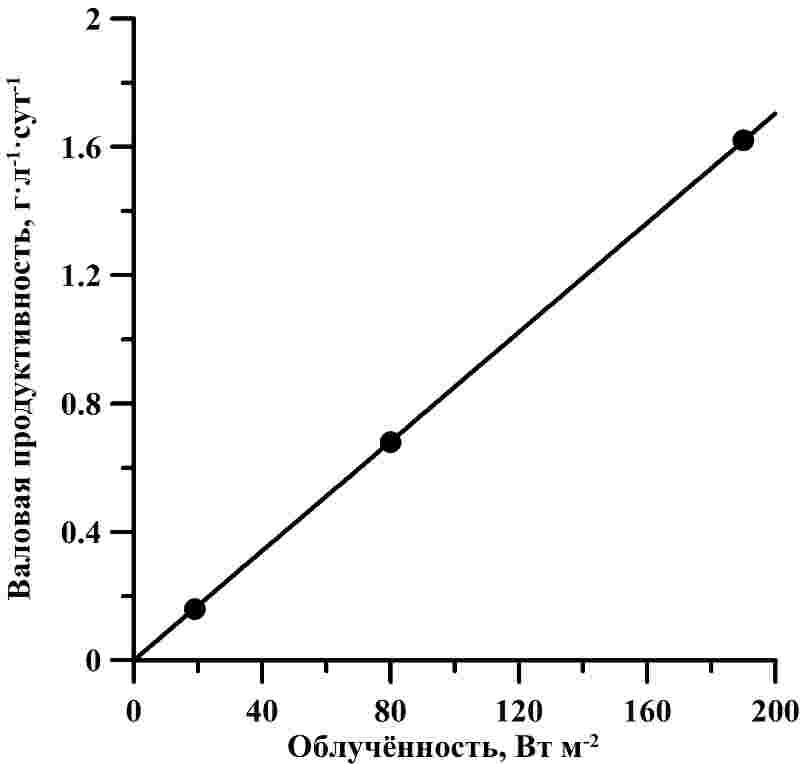
Рис. 3. А – зависимость валовой продуктивности от облучённости для D. salina (по данным Боровков, Гудвилович, 2014). Сплошная линия – аппроксимация данных выражением (1) (R2 = 0,999). В – зависимость удельной скорости расхода от облучённости для D. salina (по данным Боровков, Гудвилович, 2014). Сплошная линия – аппроксимация данных выражением (1) с учётом (5) (R2 = 0,998)
Соотношение удельной скорости поддержания и валовой удельной скорости роста μr : μ0 отражает соотношение интенсивности дыхания и фотосинтеза, выраженных относительно расхода и биосинтеза биомассы. Для D. salina показатель μr : μ0 с увеличением облучённости возрастал от 0,11 до 0,52. По литературным данным, соотношение темнового дыхания и максимального фотосинтеза составляет 0,05-0,65 для микроводорослей различных систематических групп при различных условиях культивирования (Geider, Osborne, 1989; Langdon, 1993). Изменение соотношения синтеза и расхода биомассы D. salina при увеличении облучённости может объясняться разницей в содержании основных биохимических компонентов. Например, снижалось содержание фотосинтетических пигментов при росте облучённости (Боровков, Гудвилович, 2014). Большое влияние на интенсивность дыхания оказывает содержание резервных соединений (углеводов, липидов) (Тренкеншу, 2016), которое также меняется при различных световых условиях.
Заключение Облучённость клеток микроводорослей является важнейшим фактором, влияющим на величину их валовой и наблюдаемой продуктивности. Рассмотрение соотношения биосинтетических процессов и эндогенного расхода биомассы в плотных культурах позволило предложить выражения, описывающие зависимость между значениями плотности культуры, валовой продуктивности и удельной скорости расхода. Как для A. platensis, так и для D. salina, рассчитанные значения валовой продуктивности линейно возрастают с увеличением облучённости. Удельная скорость расхода также линейно увеличивалась при повышении облучённости и валовой продуктивности, что согласуется с подходом, подразделяющим дыхательные потери микроводорослей на «дыхание роста» и «дыхание поддержания». Зависимость удельной скорости расхода от облучённости позволяет определить величину удельной скорости дыхания поддержания. Предложенная методика расчёта удельных скоростей синтеза и расхода с использованием значений плотности культуры и продуктивности позволяет провести достаточно точное определение этих параметров, в то время как оценка фотосинтеза и дыхания путём непосредственного измерения поглощения либо выделения кислорода и СО2 сопряжена со значительными методологическими сложностями и может неверно отражать реальные показатели (Xue et al., 1996; Beardall et al., 2009). Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена в рамках госзадания ФИЦ ИнБЮМ по теме «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации АААА-А18-118021350003-6).
Список литературы
Статья поступила в редакцию 12.12.2019
Об авторах Авсиян Анна Львовна - Avsiyan Anna L. младший научный сотрудник, Федеральный исследовательский центр «Институт биологии южных морей им. А.О.Ковалевского РАН» (ФИЦ ИнБЮМ РАН), Севастополь, Россия (Kovalevsky Institute of Marine Biological Research RAS, Russia, Sevastopol), Отдел биотехнологий и фиторесурсов anna.l.avsiyan@gmail.com Лелеков Александр Сергеевич – Lelekov Alexander S. кандидат биологических наук a.lelekov@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИНБЮМ РАН; тел. (8692)-55-07-95.
ССЫЛКА НА СТАТЬЮ: Авсиян А.Л., Лелеков А.С. Зависимость удельной скорости эндогенного расхода и валовой продуктивности культуры микроводорослей от облучённости // Вопросы современной альгологии. 2020. № 1 (22). С. 8–16. URL: http://algology.ru/1589 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-8-16
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Dependence of microalgae culture specific endogenous loss rate and gross productivity on irradiance Anna L. Avsyan, Alexander S. Lelekov Kovalevsky Institute of Biology of the Southern Seas RAS, Sevastopol, Russia Microalgal growth rate is determined by the difference between gross productivity and endogenous biomass loss rate. Gross productivity is a function of surface irradiance and reaches the maximal value under saturating light intensity. Endogenous biomass consumption of microalgal cells is mainly due to the respiration which can be sub-divided into growth and maintenance respiration. The paper proposes equations for calculating microalgae culture gross productivity and specific loss rate based on production characteristics. Verification of the obtained equations was performed for Arthrospira platensis and Dunaliella salina cultivated under constant illumination with different irradiance. It was demonstrated that gross productivity and specific loss rate increase linearly with increasing irradiance. Specific loss rate varied from 0,01 to 0,58 h-1 in A. platensis and from 0,04 to 0,35 day-1 in D. salina. Specific maintenance respiration rate was determined to be 0,01 h-1 in A. platensis and 0,01–0,04 day-1 in D. salina. The proposed calculation method enables a sufficiently accurate determination of productivity and loss rates based on culture density dynamics measures. Key words: microalgal culture; net productivity; growth respiration; maintenance respiration; photobiosynthesis; modeling.
References
Authors Avsiyan Anna L. Orcid ID – https://orcid.org/0000-0002-2828-9614 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia anna.l.avsiyan@gmail.com Lelekov Alexander S. Orcid ID – https://orcid.org/0000-0003-1213-7963 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia a.lelekov@yandex.ru
ARTICLE LINK: Avsiyan A.L., Lelekov A.S. Dependence of microalgae culture specific endogenous loss rate and gross productivity on irradiance. Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 1 (22). P. 8–16. URL: http://algology.ru/1589 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-8-16
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||