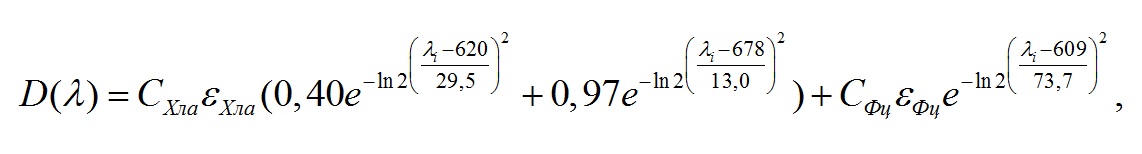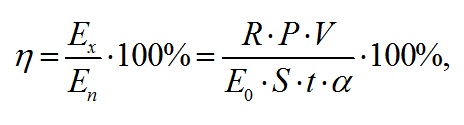|
|
|
|
Энергетические процессы водных фототрофов Исследование световой эффективности роста накопительной культуры Arthrospira (Spirulina) platensis
Клочкова В.С. 1, Лелеков А. С.2 Viktoria S. Klochkova, Alexander S. Lelekov
1Севастопольский государственный университет (Севастополь, Россия)
УДК 574.6:57.036
В работе исследовано изменение интегрального коэффициента поглощения света и световой эффективности роста с увеличением концентрации клеток накопительной культуры микроводорослей. В качестве объекта использовали цианопрокариоту Arthrospira platensis, культивируемую при низкой освещённости. Выбор области светолимитирования обусловлен невысокими скоростями фотобиосинтеза, что с методической точки зрения упрощает определение динамики концентрации биомассы и её основных биохимических компонентов. Предложен экспресс-метод определения концентрации хлорофилла а по истинным спектрам поглощения, компенсированных на рассеяние. Рассчитаны продукционные характеристики культуры (максимальная удельная скорость роста – 0,02 ч-1, продуктивность – 0,17 г·л-1·сут-1, доля хлорофилл а – 1,5%). Показана их взаимосвязь с поверхностной облучённостью фотобиореактора. Зависимость коэффициента поглощения света от поверхностной концентрации хлорофилла а описывается с высокой точностью (R2=0,99) уравнением Бугера-Ламберта-Бера. Коэффициент удельного поглощения составил 0,02 м2·мг-1, что в 2 раза выше, чем определённый ранее для зелёных морских водорослей. Эффективность утилизации световой энергии снижалась в экспоненциальной фазе роста, стабилизируясь на линейной на уровне 4,9%. Полученные результаты могут быть использованы при прогнозировании продукции биологически ценных компонентов в лабораторных и полупромышленных условиях. Ключевые слова: коэффициент поглощения света; истинный спектр поглощения; спектры пиков Гаусса; хлорофилл а; эффективность фотобиосинтеза
Введение Массовые исследования культур микроводорослей посвящены вопросам производства продуктов питания и биотоплива, выявлению физиологических особенностей различных видов в условиях действия внешних факторов (Uebel et al., 2019). Одним из наиболее распространенных модельных объектов является спирулина Arthrospira platensis – многоклеточная нитевидная спиралевидная цианобактерия. На сегодняшний день детально исследованы механизмы синтеза биологически активных соединений спирулины (Wu et al., 2021), показано, что она является высокопродуктивным источником белков, витаминов, минералов, углеводов и фикобилипротеиновых пигментов (Marrez et al., 2014; Alvarenga et al., 2011). Рост плотных культур низших фотоавтотрофов определяется действием многих факторов, но, с точки зрения фотосинтеза, первостепенное значение имеет свет. Он определяет функциональное состояние клеток, скорость размножения микроводорослей, а также оказывает непосредственное влияние на метаболизм в целом (Maltsev et al., 2021). При промышленном выращивании микроводорослей применяется как естественное, так и искусственное освещение. Солнечный свет используется для культивирования микроводорослей в открытых горизонтальных бассейнах (Wu et al., 2021). Интенсивность солнечной радиации периодически изменяется в течение дня, что приводит к суточной ритмике продукционных характеристик культуры. В лабораторных условиях используются фотобиореакторы (культиваторы) и искусственное освещение. Благодаря простоте технической реализации, большинство экспериментальных работ осуществляется в накопительном режиме при постоянной поверхностной облучённости. Изменение световых условий может быть использовано для повышения продуктивности культуры микроводорослей и накопления в ней биологически ценных соединений. Биомасса микроводорослей создаёт градиент освещённости внутри фотобиореактора. Интенсивность света, воздействующая на клетки, является функцией экстинкции, оптического пути и концентрации биомассы (Krichen et al., 2021). Таким образом, микроводоросли только вблизи освещаемой поверхности получают столько же световой энергии, сколько падает на фотобиореактор. Клетки, находящиеся в глубинных слоях культуры, могут не получать никакого света. Обобщённой характеристикой количества поглощённой световой энергии является интегральный (по всему диапазону фотосинтетически активной радиации (ФАР)) коэффициент поглощения света, который, согласно закону Бугера-Ламберта-Бера, экспоненциально увеличивается с ростом плотности культуры, а точнее концентрации хлорофилла а (Grima et al., 1994). Известно, что вся поглощённая энергия передаётся на реакционные центры фотосинтеза, являющимися молекулами хлорофилл а. Хлорофилл а также входит в структуру светособирающего комплекса (ССК): на одну молекулу реакционного центра в среднем приходится 200 – 250 молекул антенного хлорофилл а (Ризниченко, Рубин, 2020). Знание коэффициента поглощения позволит оценить количество поглощённой культурой световой энергии, а, следовательно, прогнозировать величину продуктивности культуры и скорости синтеза биохимических компонентов биомассы. Не менее значимым параметром культуры микроводорослей является эффективность утилизации световой энергии или коэффициент использования света. Этот показатель необходим для оценки энергии, запасаемой в стабильных органических веществах в результате роста клеток, и поглощённой лучистой энергии, которая расходуется во всех процессах, следующих за актом поглощения фотонов водорослями (Белянин, Сидько, Тренкеншу, 1980). Целью данного исследования является определение зависимости коэффициента поглощения света и эффективности утилизации световой энергии от концентрации хлорофилла а.
Материал и методы В качестве объекта исследования была выбрана Arthrospira (Spirulina) platensis (Nordst.) Gomont, полученная из коллекции ФИЦ Института биологии южных морей имени А. О. Ковалевского РАН, г. Севастополь. A. platensis выращивали в унифицированной лабораторной установке (Тренкеншу и др., 2017) на питательной среде (Zarrouk, 1966) в накопительном режиме. Использовался фотобиореактор плоскопараллельного типа толщиной 2 см, площадь рабочей поверхности 0,05 м2, объём 1 л. В качестве источника освещения использовали холодные люминесцентные лампы Philips Daylight TL-D 54-765 6G мощностью 18 Вт. Освещённость регистрировали люксметром Ю-116, средняя освещённость рабочей поверхности фотобиореактора составляла 5 клк, что с учётом спектра лампы составляет около 17 Вт·м-2 (Клочкова, Богачёва, Лелеков, 2021). Температура суспензии поддерживалась на уровне 26±1°С. Оптическую плотность культуры определяли на фотометре КФК-2 при длине волны 750 нм, погрешность измерения величины пропускания не превышала 1% пропускания. Измерения проводили относительно дистиллированной воды. Кюветы располагали максимально близко к фотоприёмнику, что позволяло снизить ошибку измерения оптической плотности культуры, связанную со светорассеянием. При пересчёте единиц оптической плотности на сухую биомассу (СВ) использовали ранее определённый эмпирический коэффициент 0,8 (Клочкова, Богачёва, Лелеков, 2021). Спектры поглощения регистрировались в диапазоне от 400 до 800 нм с шагом 0,5 нм на двухлучевом спектрофотометре Lambda 365 Double Beam UV-Visible (производитель: Perkin Elmer, Индия), который оснащён интегрирующей сферой (ИС) диаметром 60 мм (внешнее покрытие – BaSO4). Для определения концентрации хлорофилла а и фикоцианина использовался метод Купера (Küpper, Seibert, Parameswaran, 2007), основанный на описании каждого спектра нативной культуры серией пиков Гаусса. Образец спектра аппроксимируется линейной комбинацией гауссиан с учётом автоматической коррекции неточности длины волны, нестабильности базовой линии, мутности образца. В процессе расчёта концентрации пигментов использовалась ранее предложенная модель нативного спектра поглощения спирулины (Чернышёв, Клочкова, 2021) с модификацией для красной области (550–700 нм): где D(λ) – общая оптическая плотность, отн. ед; СХла – концентрация хлорофилла а (г·л-1); СФц – концентрация фикоцианина (г·л-1); εХла – экстинкция хлорофилла а 88,15 (л·г-1·см-1); εФц – экстинкция фикоцианина 7,3 (л·г-1·см-1).
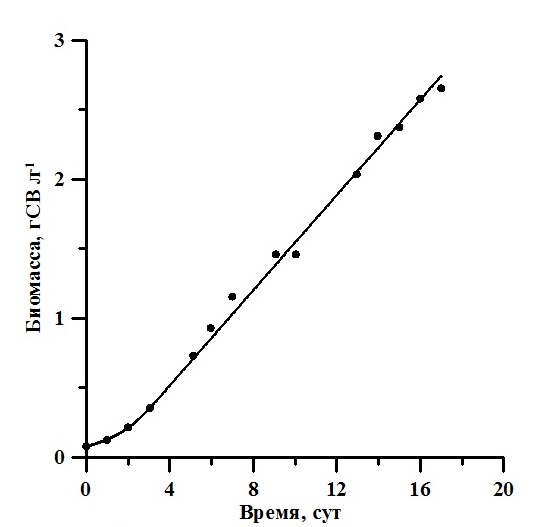
Результаты Накопительная кривая роста A. platensis представлена на рис. 1. Биомасса увеличилась с 0,08 до 3,66 г·л-1, а значение продуктивности изменялось от 0,04 г·л-1·сут-1 в начале эксперимента до 0,17 г·л-1·сут-1 в линейной фазе роста.
Рис. 1. Накопительная кривая роста A. platensis. Линия – аппроксимация данных выражениями (2) для экспоненциальной фазы (0–3 сутки) (R2 = 0,99) и (3) для линейной фазы (3–20 сутки) (R2 = 0,98). Значения коэффициентов в тексте Fig. 1. Batch curve of A. platensis. A solid line is an approximation of the data by expressions (2) for the exponential phase (0–3 days) (R2 = 0.99) and (3) for the linear phase (3–20 days) (R2 = 0.98).
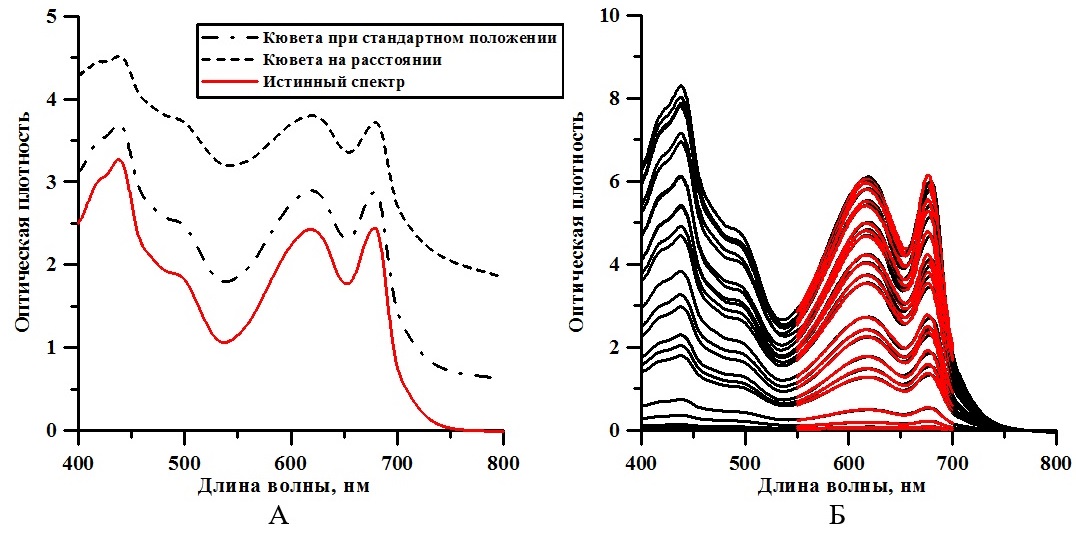
Экспоненциальная фаза роста продолжалась первые трое суток. Этот участок кривой роста характеризуется постоянством максимальной скорости роста культуры μm = 0,5 сут-1 (Тренкеншу, 2005) и описывается выражением (2): Линейная фаза роста описывается уравнением (3) (Тренкеншу, 2005) и характеризуется постоянством максимальной продуктивности культуры Pm = 0,17 г·л-1·сут-1: Для определения коэффициента поглощения света α регистрировали спектры ослабления нативной культуры A. platensis. Используемый спектрофотометр не позволяет получить спектры истинного поглощения, так как кювета с образцом находится вне интегрирующей сферы, что приводит к частичному светорассеянию и к ненулевым значениям оптической плотности в дальней красной области. Для определения истинного спектра поглощения использовали подход, предложенный в (Merzlyak, Naqvi, 2000; Клочкова и др., 2021): где D(λ;r) – оптическая плотность образца, расположенного на некотором расстоянии r от ИС; D(λ;0) – оптическая плотность образца при стандартном положении кюветы; Lосл-е(r;0) – поправочный коэффициент света. На рис. 2А представлен пример спектров, полученных при стандартном положении кюветы, на расстоянии 1 см от входного окна ИС и истинного спектра, определённого по выражению (4). В течение экспоненциальной фазы значение поправочного коэффициента ослабления света Lосл-е(r;0) варьировало от 1,37 до 1,45, а на линейной фазе – от 1,49 до 1,55. Следует отметить, что расчёт проводился в область длин волн, в которой спирулина не поглощает (т.е. к области 750–800 нм видимого диапазона).
Рис. 2. А – пример расчёта истинного спектра культуры A. platensis по выражению (4). Fig. 2. A – example of calculating the true spectrum of A. platensis culture by expression (4). B – change in the true spectrum of A. platensis batch culture, red lines – approximation by expression (1)
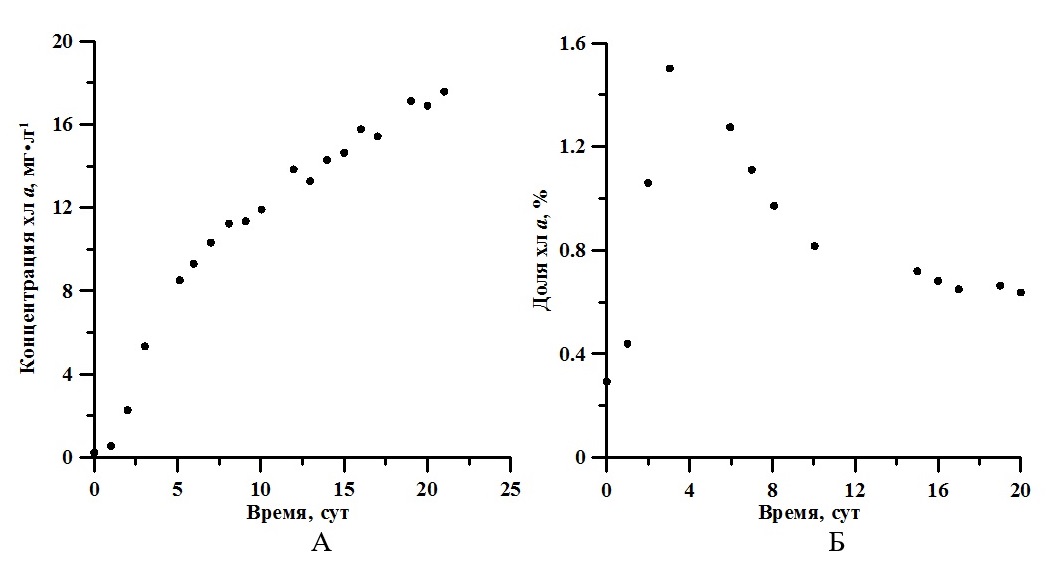
На рис. 2Б показано изменение истинного спектра в течение эксперимента. С помощью аппроксимации выражением (1) получены значения концентрации хлорофилла а, которые изменялось от 0,23 мг·л-1 до 17,58 мг·л-1 (рис. 3А). Максимальная удельная скорость синтеза хлорофилл а составила 1,15 сут-1, продуктивность 0,77 мг·л-1·сут-1.
Рис. 3. Динамика концентрации (А) и доли хлорофилл а (Б) накопительной культуры A. platensis Fig. 3. Dynamic of Chl a concentration (A) and the Chl a ratio (B) A. platensis batch culture
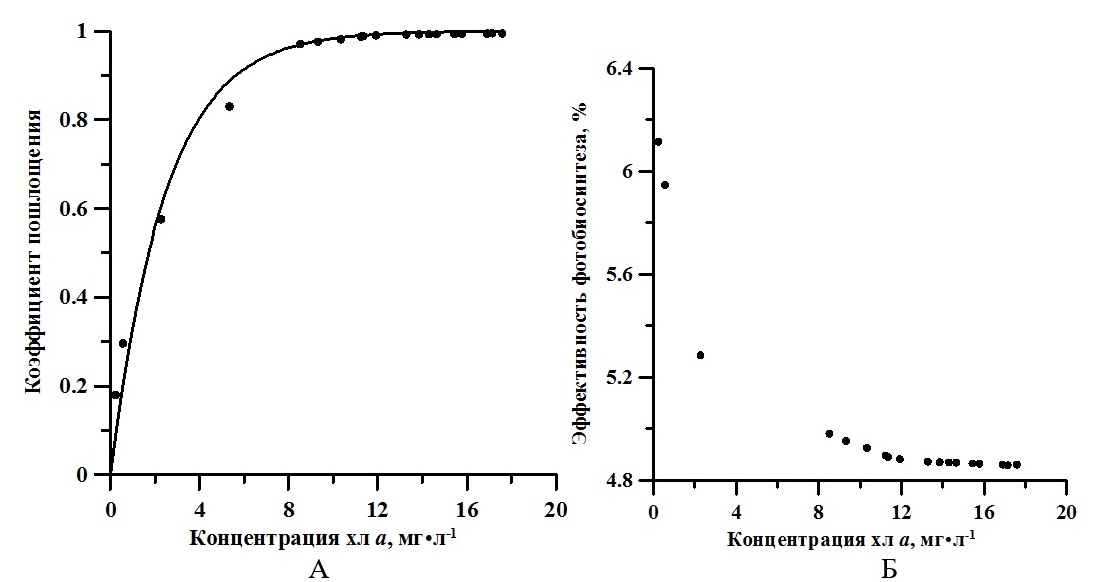
Для расчёта концентрации использовали эталонные справочные коэффициенты экстинкции (Jeffrey, Mantoura, Wright, 1997). Известно, что коэффициент экстинкции хлорофилла а в нативной форме составляет 76 л·г-1·см-1 (Myers, Graham, Wang, 1978). Концентрации хлорофилла а, рассчитанные с использованием этих коэффициентов, отличаются на 16%. Используемый метод определения концентрации пигментов является экспресс анализом, однако он позволяет определить динамику концентрации пигментов в условиях накопительной культуры без вмешательства в процессы её роста. По истинным спектрам определены значения интегрального коэффициента поглощения света (α). Для расчёта использовали выражение, предложенное в (Геворгиз, Шматок, Лелеков, 2005). Полученные результаты представлены на рис. 4А. В течение экспоненциальной фазы роста спирулина поглощала примерно от 18 до 83% падающего света. В линейной фазе – коэффициент поглощения принимал значения близкие к единице. Эффективность (КПД) фотобиосинтеза рассчитывалось по формуле (5) (Клочкова и др. 2021). На экспоненциальном участке кривой продуктивность определялась как произведение удельной скорости роста (2) на биомассу, а на линейном – по аппроксимации из (3). Результаты представлены на рис. 4Б. где R – калорийность, кДж; P – продуктивность, г·л-1·сут-1; V – объём, л; E0 – облучённость, Вт·м-2; S – площадь поверхности фотобиореактора, м2; t – время, с; α – коэффициент поглощения.
Рис. 4. Зависимость коэффициента поглощения (А) и эффективности утилизации световой энергии (Б) от концентрации хлорофилл а. Линия – аппроксимация данных выражениями (6) Fig. 4. The dependence of the absorption coefficient (A) and the efficiency of utilization of light energy (B) on the concentration of chlorophyll a. Line - approximation of data by expressions (6)
Обсуждение Известно, что для накопительной культуры A. platensis с увеличением поверхностной облучённости продукционные характеристики (удельная скорость роста и продуктивность) увеличиваются (Клочкова, Богачёва, Лелеков, 2021). При этом по литературным данным доля хлорофилла а в биомассе для многих видов микроводорослей уменьшается (MacIntyre et al., 2002). Как указано в (Заворуева, Заворуев, Крум, 2011) при 40 Вт·м-2 ФАР удельная скорость роста спирулины равна 0,07 ч-1, что составляет половину от ее максимально возможной удельной скорости роста. В данной работе в экспоненциальной фазе роста μm равняется 0,5 сут-1 (около 0,02 ч-1) при облучённости 17 Вт·м-2. Таким образом, полученное нами значение коррелирует с полученными ранее литературными данными. Согласно (Белянин, Сидько, Тренкеншу, 1980), насыщающая облучённость, при которой удельная скорость роста полупоглощающей культуры A. platensis достигает максимума 0,1 ч-1, составляет 100 Вт·м-2. Следовательно, поверхностная облучённость в нашем эксперименте составляла около 17% от насыщающей. На рис. 3Б представлена динамика изменения доли хлорофилла а со временем. Экспериментально показано, что эта величина достигает максимума (1,5%) в конце экспоненциальной фазы. Далее в течение линейной фазы роста доля хлорофилла а уменьшилась примерно в 2,5 раза. Для сравнения при промышленном культивировании в открытом бассейне максимальная доля хлорофилла а составила 1,4% и далее уменьшилась примерно в 2 раза (до 0,8%) (Wu et al., 2021). Это может быть связано с постепенным понижением количества биогенных элементов в среде, а также с уменьшением количества света, приходящееся на одну клетку в плотной культуре. Анализируя изменение КПД фотобиосинтеза (см. рис. 4Б), можно заметить, что эффективность утилизации световой энергии в процессе роста сначала уменьшается (с 6,11 до 4,92%), а потом практически не изменяется (примерно 4,87%). Согласно выражению (5), КПД в большей степени будет определяться калорийностью биомассы водорослей, продуктивностью и коэффициентом поглощения света, которые, в отличие от поверхностной облучённости, площади и объёма фотобиореактора, будут изменяться в процессе роста культуры. В работе (Wu et al., 2021) представлена динамика изменения биохимического состава спирулины с ростом плотности накопительной культуры. Согласно этим данным, содержание жиров в клетках A. platensis практически не изменялось, углеводов – увеличивалось, а белков – уменьшалось. Зная, сколько энергии содержится в 1 грамме каждого биохимического компонента биомассы (белки – 5,6 ккал; жиры – 9,3 ккал; углеводы – 4,2 ккал) (Геворгиз, Шматок, Лелеков, 2005), можно рассчитать калорийность биомассы спирулины в целом. Для этого необходимо просуммировать отдельные вклады калорийности. Полученное значение R варьировало от 4907 кал до 4492 кал, или от 20,5 кДж до 18,8 кДж. То есть, можно сказать, что в процессе роста накопительной культуры калорийность биомассы A. platensis практически не изменяется. Поэтому для расчёта световой эффективности роста можно использовать среднее значение 20 кДж на грамм. Как было указано выше, для первоначального периода роста (экспоненциальной фазы) характерно увеличение биомассы культуры по экспоненциальному закону (2). Удельная скорость роста остаётся неизменной, так как при малых плотностях культуры клетки не затеняют друг друга (Тренкеншу, 2005). Однако, продуктивность на этой фазе будет возрастать с увеличением биомассы. Далее в линейной фазе скорость роста постоянна, а биомасса растёт согласно формуле (3). Это объясняется тем, что увеличение концентрации клеток культуры будет компенсироваться уменьшением удельной скорости роста из-за лимитирования по количеству световой энергии, приходящейся на одну клетку. За счёт самозатенения клеток в растущей накопительной культуре количество падающей на клетку энергии ФАР снижается. То есть, в течение всего роста продуктивность сначала экспоненциально растёт, а потом не изменятся, что можно объяснить ростом количества поглощённой энергии. Зависимость коэффициента поглощения от концентрации хлорофилла а представлена на рис. 4А. Данные описываются законом Бугера-Ламберта-Бера (R2 = 0,99): где Схла – концентрация хлорофилла а; 0,02 – удельное поглощение, м2·мг-1· Анализ выражения (6) показывает, что при поверхностной концентрации хлорофилла а 1 мг·м-2 клетки культуры A. platensis поглощают 2% падающего света. Для сравнения в работе (Тренкеншу, Лелеков, Новикова, 2018) определено значение удельного коэффициента поглощения для зелёных морских водорослей, которое составило 0,008 м2·мг-1.
Заключение В работе исследована динамика продуктивности, удельной скорости роста, калорийности с ростом накопительной культуры A. platensis в условиях светолимитирования. Показано, что коэффициент поглощения света увеличивается с ростом плотности культуры, достигая максимального значения в начале линейной фазы. Зависимость α от поверхностной концентрации хлорофилла а с высокой точностью описывается законом Бугера-Ламберта-Бера. Величина коэффициента удельного поглощения составила 0,02 м2·мг-1, что более чем в два раза выше, чем у зелёных водорослей. Эффективность утилизации световой энергии также зависит от концентрации хлорофилла а на экспоненциальной фазе роста, в то время как на линейной фазе она не изменяется и составляет 4,9%.
Работа выполнена в рамках Госзадания ФИЦ «Институт биологии южных морей имени А. О. Ковалевского РАН», № гос. регистрации 121030300149-0. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Поступила в редакцию 10.02.2022
Об авторах Клочкова Виктория Сергеевна – Viktoriya S. Klochkova студент, Севастопольский государственный университет, Севастополь, Россия Sevastopol State University, Sevastopol, Russia); кафедра «Физика» viki-iki@mail.ru Лелеков Александр Сергеевич – Alexander S. Lelekov кандидат биологических наук a.lelekov@yandex.ru Корреспондентский адрес: Россия, 299011, г. Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ РАН; тел. +7 (869)255-07-95.
При перепечатке ссылка на сайт обязательна
Light utilization efficiency of Arthrospira (Spirulina) platensis batch culture Viktoriya S. Klochkova1, Alexander S. Lelekov2 1Sevastopol State University (Sevastopol, Russia) The dynamics of the integral coefficient of light absorption and the light efficiency of the growth of dense cultures of microalgae is researched. A batch cyanoprokaryotic culture of Arthrospira (Spirulina) platensis was grown under light-limiting conditions. The choice of the light-limiting region is due to the low rates of photobiosynthesis, which, from a methodological point of view, simplifies the determination of the dynamics of biomass concentration and its main biochemical components. An express method for determining the concentration of chlorophyll a from true absorption spectra compensated for scattering is proposed. The production characteristics of culture were calculated (maximum specific growth rate – 0.02 h-1, productivity 0.17 g·l-1·d-1, percentage of Chl a – 1.5%). It is shown their relationship with the surface irradiation of the. It is revealed the dependence of the light absorption coefficient on the surface concentration of chl a is described with high accuracy (R2=0.99) by the Bouguer-Lambert-Beer law. The specific absorption coefficient was 0.02 m2·mg-1, which is 2 times higher than that calculated for green algae. The efficiency of light energy utilization decreased at the exponential growth phase and stabilized at the linear one at the level of 4.9%. The obtained results can be used to predict the production of biologically valuable components in laboratory and semi-industrial conditions. Keywords: absorption coefficient; spectra of Gaussian peaks; chlorophyll a concentration; photobiosynthesis efficiency
References
Authors Klochkova Viktoriya S. ORCID – https://orcid.org/0000-0002-2120-9589 Sevastopol State University, Sevastopol, Russia viki-iki@mail.ru Lelekov Alexander S. ORCID – https://orcid.org/0000-0002-3876-3455 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia a.lelekov@yandex.ru
К другим статьям Международной конференции
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||