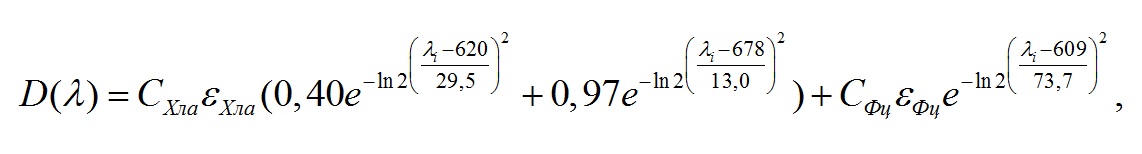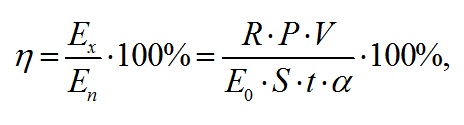|
|
|
Исследование эффективности фотобиосинтеза накопительной культуры Arthrospira (Spirulina) platensis
Клочкова В.С. 1, Лелеков А. С.2 Viktoria S. Klochkova, Alexander S. Lelekov
1Севастопольский государственный университет (Севастополь, Россия)
УДК 574.6:57.036
В работе исследовано изменение интегрального коэффициента поглощения света и КПД фотобиосинтеза в накопительной культуре низших фотоавтотрофов. В качестве модельного объекта использовали цианопрокариоту Arthrospira (Spirulina) platensis (Nordst.) Gomont, выращиваемую при низкой освещённости 17 Вт/м2. Выбор области светолимитирования обусловлен невысокими скоростями фотобиосинтеза, что с методической точки зрения упрощает определение динамики биомассы и её основных биохимических компонентов. Предложен экспресс-метод определения концентрации хлорофилла а по истинным спектрам поглощения, компенсированным на рассеяние. Рассчитаны продукционные характеристики культуры (максимальная удельная скорость роста – 0,02 ч-1, продуктивность – 0,17 г·л-1·сут-1 и доля хлорофилла а – 1,5%). Показана их взаимосвязь с поверхностной облучённостью фотобиореактора. Зависимость интегрального коэффициента поглощения света от поверхностной концентрации хлорофилла а описывается с высокой точностью (R2 = 0,99) уравнением Бугера-Ламберта-Бера, при этом удельный показатель поглощения составил 0,02 м2·мг-1, что в 2 раза выше, чем определённый ранее для зелёных морских водорослей. Эффективность утилизации световой энергии снижалась в экспоненциальной фазе роста, стабилизируясь в линейной на уровне 4,9%. Полученные результаты могут быть использованы при прогнозировании продукции биологически ценных компонентов в лабораторных и полупромышленных условиях. Ключевые слова: интегральный коэффициент поглощения света; истинный спектр поглощения; хлорофилл а; эффективность фотобиосинтеза
Введение Массовые исследования культур микроводорослей посвящены вопросам производства продуктов питания и биотоплива, выявлению физиологических особенностей различных видов в условиях действия внешних факторов (Uebel et al., 2019). Одним из наиболее распространенных модельных объектов является спирулина Arthrospira (Spirulina) platensis (Nordst.) Gomont – многоклеточная нитевидная спиралевидная цианобактерия. На сегодняшний день детально исследованы механизмы синтеза биологически активных соединений спирулины (Wu et al., 2021), показано, что она является высокопродуктивным источником белков, витаминов, минералов, углеводов и фикобилипротеиновых пигментов (Alvarenga et al., 2011; Marrez et al., 2014). Рост плотных культур низших фотоавтотрофов определяется действием многих факторов, но, с точки зрения фотосинтеза, первостепенное значение имеет свет. Он определяет функциональное состояние клеток, скорость размножения микроводорослей, а также оказывает непосредственное влияние на метаболизм в целом (Maltsev et al., 2021). При промышленном выращивании микроводорослей применяется как естественное, так и искусственное освещение. Солнечный свет используется для культивирования микроводорослей в открытых горизонтальных бассейнах (Wu et al., 2021). Интенсивность солнечной радиации периодически изменяется в течение дня, что приводит к суточной ритмике продукционных характеристик культуры. В лабораторных условиях используются фотобиореакторы (культиваторы) и искусственное освещение. Благодаря простоте технической реализации, множество экспериментальных работ осуществляется в накопительном режиме при постоянной поверхностной облучённости. Изменение световых условий может быть использовано для повышения продуктивности культуры микроводорослей и накопления в ней биологически ценных соединений. В оптически плотных культурах микроводорослей биомасса создаёт градиент световой энергии внутри фотобиореактора. Интенсивность света, воздействующая на клетки, является функцией экстинкции, оптического пути и концентрации клеток (Krichen et al., 2021). Таким образом, микроводоросли только вблизи освещаемой поверхности получают столько же световой энергии, сколько падает на фотобиореактор. Клетки, находящиеся в глубинных слоях культуры, могут не получать никакого света. Обобщённой характеристикой количества поглощённой световой энергии является интегральный (по всему диапазону фотосинтетически активной радиации (ФАР)) коэффициент поглощения света, который экспоненциально увеличивается с ростом плотности культуры, а точнее концентрации фотосинтетических пигментов (Grima et al., 1994). Известно, что вся поглощённая энергия передаётся на реакционные центры фотосинтеза, являющимися молекулами хлорофилл а. У A. platensis хлорофилл а также входит в структуру светособирающего комплекса (ССК): на одну молекулу реакционного центра в накопительной культуре в среднем приходится 120–180 молекул антенного хлорофилл а, при этом 95% хлорофилла связано с первой фотосистемой (Заворуева и др., 2011). Знание количественной зависимости интегрального коэффициента поглощения от концентрации хлорофилла а позволит прогнозировать величину продуктивности культуры и скорости синтеза биохимических компонентов биомассы. В общем случае такая зависимость описывается общепринятым законом Бугера-Ламберта-Бера, при этом величину удельного показателя поглощения можно рассматривать как видоспецифический параметр. В некоторых работах указано на влияние спектрального состава света на данную величину (Ефимова, 2021). Не менее значимой характеристикой культуры микроводорослей является эффективность использования световой энергии или КПД фотобиосинтеза (Силкин, Хайлов, 1988). Для полупоглощающих культур микроводорослей в литературе приводится зависимость КПД фотобиосинтеза от поверхностной облучённости фотобиореактора (Белянин и др., 1980). Однако для оптически плотных культур микроводорослей практически отсутствуют сведения о динамике изменения данной величины. В лучшем случае авторы ограничиваются указанием средних значений (Hase et al., 2000; Zanolla et al., 2021). Целью данного исследования является определение зависимости интегрального коэффициента поглощения света и КПД фотобиосинтеза от концентрации хлорофилла а для накопительной культуры A. platensis.
Материал и методы В качестве объекта исследования была выбрана Arthrospira (Spirulina) platensis (Nordst.) Gomont, полученная из коллекции ФИЦ Института биологии южных морей имени А.О. Ковалевского РАН, г. Севастополь. A. platensis выращивали в унифицированной лабораторной установке (Тренкеншу и др., 2017) на питательной среде (Zarrouk, 1966) в накопительном режиме. Использовался фотобиореактор плоскопараллельного типа толщиной 2 см, площадь рабочей поверхности 0,05 м2, объём 1 л. В качестве источника освещения использовали холодные люминесцентные лампы Philips Daylight TL-D 54-765 6G мощностью 18 Вт. Освещённость регистрировали люксметром Ю-116, средняя освещённость рабочей поверхности фотобиореактора составляла 5 клк, что с учётом спектра лампы составляет около 17 Вт·м-2 (Геворгиз, Малахов, 2018). Температура суспензии поддерживалась на уровне 26±1°С. Оптическую плотность культуры определяли на фотометре КФК-2 при длине волны 750 нм, погрешность измерения величины пропускания не превышала 1% пропускания. Измерения проводили относительно дистиллированной воды. Кюветы располагали максимально близко к фотоприёмнику, что позволяло снизить ошибку измерения оптической плотности культуры, связанную со светорассеянием. В отдельном эксперименте был определён коэффициент перевода единиц оптической плотности D750 в сухую биомассу. Культуру выращивали в квазинепрерывном режиме, удельная скорость протока составляла 10%. Сухую биомассу (СВ) A. platensis определяли методом фильтрации суспензии микроводорослей через бумажные фильтры (Геворгиз, Алисевич, Шматок, 2005). Предварительно измеряли массу фильтра, отбирали 100 мл суспензии (10 проб по 10 мл) и пропускали через фильтровальную бумагу. Промывка осуществлялась дистиллированной водой. Далее бумагу с получившейся пастой помещали в сушильный шкаф при температуре 40оС на 24 часа. Полученные результаты описываются линейной зависимостью (R2 = 0,96) : В = 0,8 · D750. Спектры поглощения регистрировались в диапазоне от 400 до 800 нм с шагом 0,5 нм на двухлучевом спектрофотометре Lambda 365 Double Beam UV-Visible (производитель: Perkin Elmer, Индия), который оснащён интегрирующей сферой (ИС) диаметром 60 мм (внешнее покрытие – BaSO4). Для определения концентрации хлорофилла а и фикобилиновых пигментов использовался метод Купера (Küpper et al., 2007), основанный на описании каждого спектра нативной культуры функциями Гаусса. Образец спектра аппроксимируется линейной комбинацией гауссиан. В процессе расчёта концентрации пигментов использовалась ранее предложенная модель нативного спектра поглощения спирулины (Чернышёв, Клочкова, 2021) с модификацией для красной области (550–700 нм): где D(l) – общая оптическая плотность, отн. ед; Была проведена серия параллельных измерений концентрации хлорофилла а при помощи ацетоновых экстрактов (Геворгиз, 2017). Результаты представлены на рис. 1.
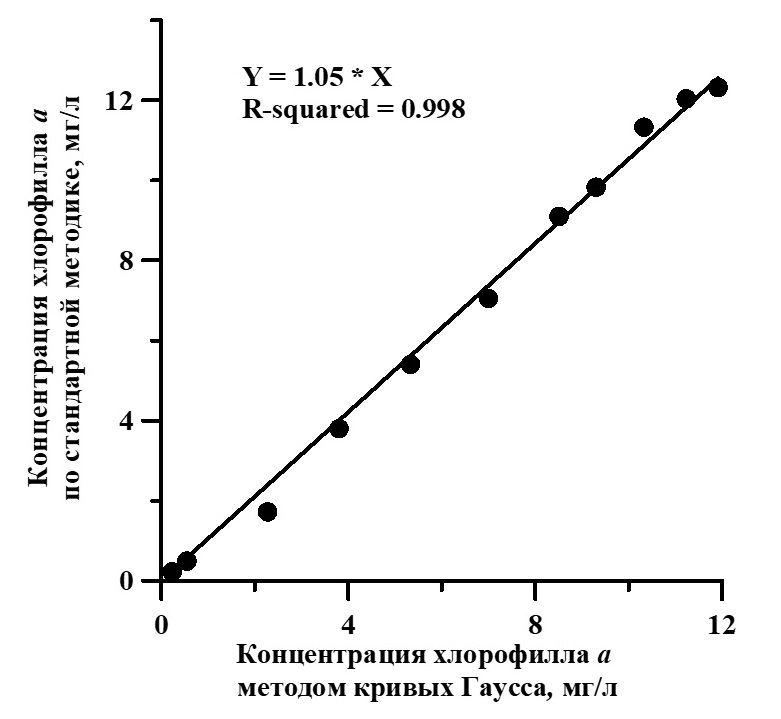
Рис. 1. Концентрация хлорофилла а, определённая по стандартной методике и при помощи модели (1) Fig. 1. The concentration of chlorophyll a, determined by the standard method and using the model (1)
Анализируя полученные результаты, можно сделать вывод, что предлагаемый способ декомпозиции спектра может быть использован как экспресс-метод определения концентрации пигментов в культуре, без выделения пигментов в чистом виде, что важно при работе с накопительными культурами без вмешательства в процессы их роста. Расчёт коэффициентов уравнений выполняли в программах Grapher, SciDavis, QtiPlot, разделение спектра на отдельные кривые Гаусса в программе MagicPlot.
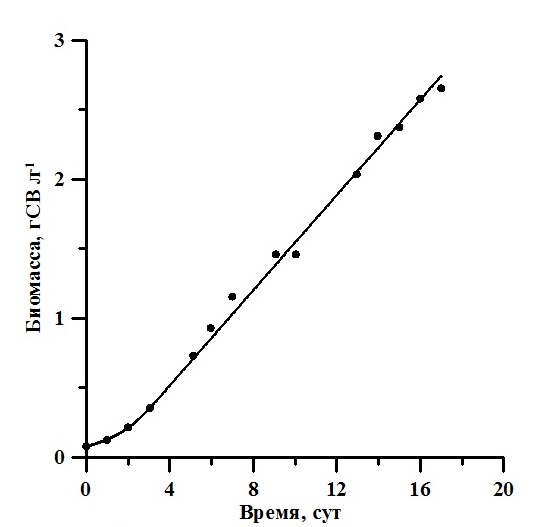
Результаты Накопительная кривая роста A. platensis представлена на рис. 2. Биомасса увеличилась с 0,08 до 3,66 г·л-1, а значение продуктивности изменялось от 0,04 г·л-1·сут-1 в начале эксперимента до 0,17 г·л-1·сут-1 в линейной фазе роста.
Рис. 2. Накопительная кривая роста A. platensis. Линия – аппроксимация данных выражениями (2) для экспоненциальной фазы (0–3 сутки) (R2 = 0,99) и (3) для линейной фазы (3–20 сутки) (R2 = 0,98). Значения коэффициентов – в тексте Fig. 2. Batch curve of A. platensis. A solid line is an approximation of the data by expressions (2) for the exponential phase (0–3 days) (R2 = 0.99) and (3) for the linear phase (3–20 days) (R2 = 0.98).
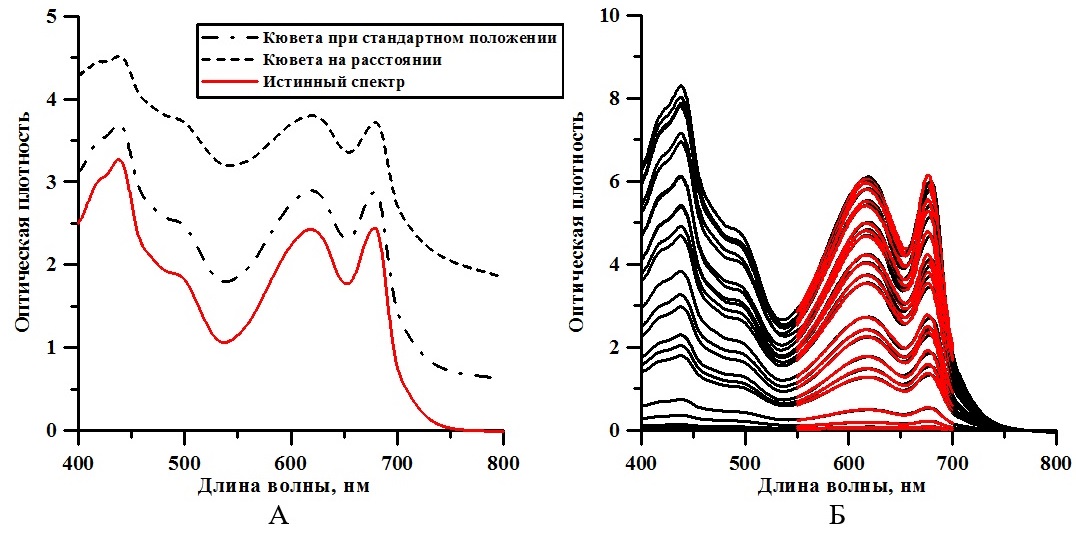
Экспоненциальная фаза роста продолжалась первые трое суток. Этот участок кривой роста характеризуется постоянством максимальной скорости роста культуры μm = 0,5 сут-1 (Тренкеншу, 2005) и описывается выражением (2): где μm – максимальная удельная скорость роста культуры, которая составила 0,5 сут-1; Линейная фаза роста описывается уравнением (3) (Тренкеншу, 2005) и характеризуется постоянством максимальной продуктивности культуры: где Pm – максимальная продуктивность, значение которой составило 0,17 г СВ·л-1·сут-1; Вl – значение биомассы в момент начала линейного роста tl. Для определения интегрального коэффициента поглощения света α регистрировали спектры ослабления нативной культуры A. platensis. Используемый спектрофотометр не позволяет получить спектры истинного поглощения, так как кювета с образцом находится вне интегрирующей сферы, что приводит к частичному светорассеянию и к ненулевым значениям оптической плотности в дальней красной области. Для определения истинного спектра поглощения использовали подход, предложенный в (Merzlyak, Naqvi, 2000): где D(λ;r) – оптическая плотность образца, расположенного на некотором расстоянии r от ИС; На рис. 3А представлен пример расчёта истинного спектра поглощения. Согласно методике (Merzlyak, Naqvi, 2000), необходимо записать спектры при стандартном положении кюветы и на расстоянии 1 см от входного окна ИС, рассчитать Lосл-е(r;0), используя выражение (4), определить истинный спектр. Отметим, что в течение экспоненциальной фазы значение поправочного коэффициента ослабления света Lосл-е(r;0) варьировало от 1,37 до 1,45, а на линейной фазе – от 1,49 до 1,55. Расчёт Lосл-е(r;0) проводился в область длин волн, в которой фотосинтетические пигменты не поглощают (т.е. к области 750–800 нм видимого диапазона).
Рис. 3. А – пример расчёта истинного спектра культуры A. platensis по выражению (4). Fig. 3. A – example of calculating the true spectrum of A. platensis culture by expression (4). B – change in the true spectrum of A. platensis batch culture, red lines – approximation by expression (1)
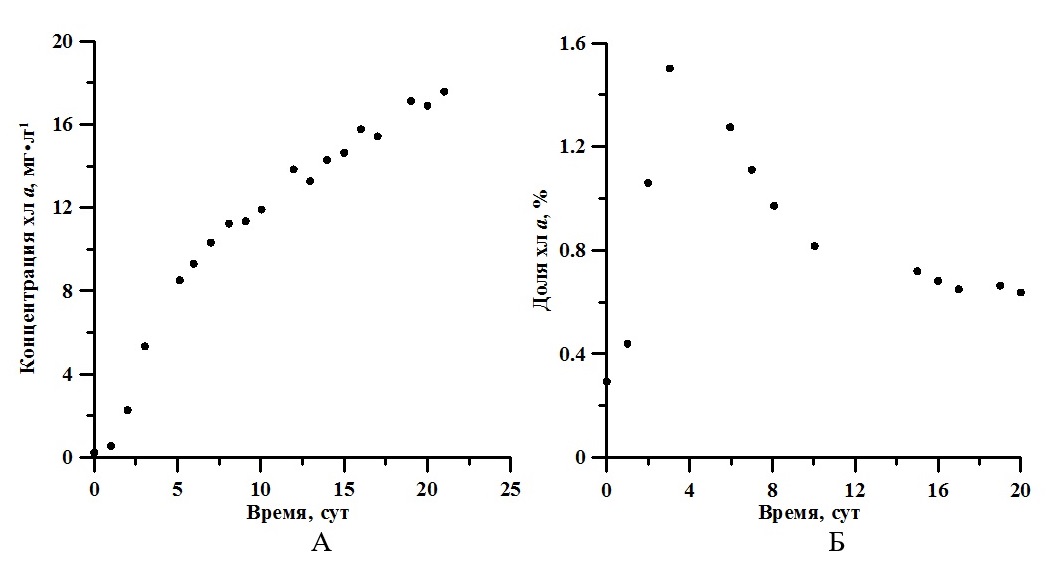
На рис. 3Б показано изменение истинного спектра в течение эксперимента. С помощью аппроксимации выражением (1) получены значения концентрации хлорофилла а, которые изменялось от 0,23 мг·л-1 до 17,58 мг·л-1 (рис. 4А). Максимальная удельная скорость синтеза хлорофилл а составила 1,15 сут-1, продуктивность 0,77 мг·л-1·сут-1.
Рис. 4. Динамика концентрации (А) и доли хлорофилл а (Б) накопительной культуры A. platensis Fig. 4. Dynamic of Chl a concentration (A) and the Chl a ratio (B) A. platensis batch culture
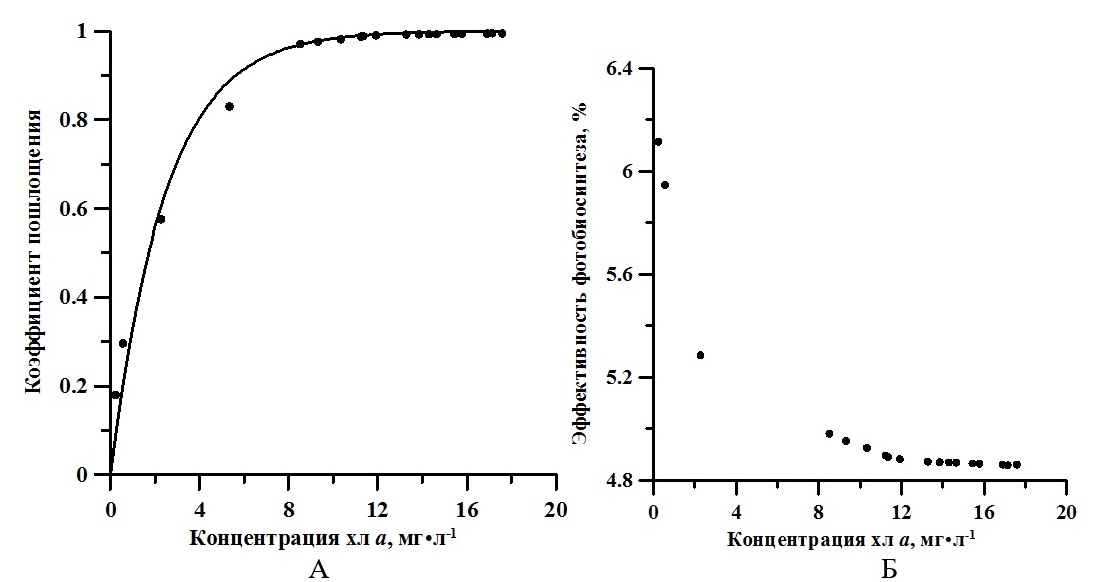
Использование эталонного справочного коэффициента экстинкции (Jeffrey et al., 1997) в культурах вызывает множество вопросов, которые обусловлены наличием «эффекта упаковки» пигментов в нативной форме. По нативным спектрам поглощения и экстрактам хлорофилла в ацетоне для 38 различных видов микроводорослей экспериментально показано, что коэффициент экстинкции хлорофилла а в нативной форме составляет 76 л·г-1·см-1 (Myers et al., 1978). Отметим, что полученные значения концентрации и относительного содержания хлорофилла а, рассчитанные по экстинкции 76 л·г-1·см-1, находятся в пределах, характерных для данного вида (Заворуева и др., 2011). По истинным спектрам определены значения интегрального коэффициента поглощения света (α). Для расчёта использовали выражение, предложенное в (Геворгиз, Шматок, Лелеков, 2005). Полученные результаты представлены на рис. 5А. В течение экспоненциальной фазы роста спирулина поглощала примерно от 18 до 83% падающего света. В линейной фазе – интегральный коэффициент поглощения принимал значения близкие к единице. Эффективность (КПД) фотобиосинтеза рассчитывали по формуле (5) (Белянин и др., 1980). На экспоненциальном участке кривой продуктивность определялась как произведение максимальной удельной скорости роста на биомассу, а на линейном – по аппроксимации из (3). Результаты представлены на рис. 5Б. где R – калорийность, кДж; P – продуктивность, г·л-1·сут-1; V – объём, л; E0 – облучённость, Вт·м-2; S – площадь поверхности фотобиореактора, м2; t – время, с; α – коэффициент поглощения.
Рис. 5. Зависимость интегрального коэффициента поглощения (А) и эффективности утилизации световой энергии (Б) от концентрации хлорофилл а. Линия – аппроксимация данных выражением (6) Fig. 5. The dependence of the integral absorption coefficient (A) and the efficiency of utilization of light energy (B) on the concentration of chlorophyll a. The line is an approximation of data by expression (6)
Обсуждение Известно, что для накопительной культуры A. platensis с увеличением поверхностной облучённости продукционные характеристики (удельная скорость роста и продуктивность) увеличиваются. При этом по литературным данным доля хлорофилла а в биомассе для многих видов микроводорослей уменьшается с ростом интенсивности света (MacIntyre et al., 2002). Как указано в (Заворуева и др., 2011) при 40 Вт·м-2 ФАР удельная скорость роста спирулины равна 0,07 ч-1, что составляет половину от ее максимально возможной удельной скорости роста. В данной работе в экспоненциальной фазе роста μm равняется 0,5 сут-1 (около 0,02 ч-1) при облучённости 17 Вт·м-2. Таким образом, полученное нами значение коррелирует с полученными ранее литературными данными. Согласно (Белянин и др., 1980), насыщающая облучённость, при которой удельная скорость роста полупоглощающей культуры A. platensis достигает максимума 0,1 ч-1, составляет 100 Вт·м-2. Следовательно, поверхностная облучённость в нашем эксперименте составляла около 17% от насыщающей. На рис. 4Б представлена динамика изменения доли хлорофилла а со временем. Экспериментально показано, что эта величина достигает максимума (1,5%) в конце экспоненциальной фазы. Далее в течение линейной фазы роста доля хлорофилла а уменьшилась примерно в 2,5 раза. Для сравнения при промышленном культивировании в открытом бассейне максимальная доля хлорофилла а составила 1,4% и далее уменьшилась примерно в 2 раза (до 0,8%) (Wu et al., 2021). Это может быть связано с постепенным понижением количества биогенных элементов в среде, а также с уменьшением количества света, приходящееся на одну клетку в плотной культуре. Анализируя изменение КПД фотобиосинтеза (см. рис. 5Б), можно заметить, что эффективность утилизации световой энергии в процессе роста сначала уменьшается (с 6,11 до 4,92%), а потом практически не изменяется (примерно 4,87%). Согласно выражению (5), КПД в большей степени будет определяться калорийностью биомассы водорослей, продуктивностью и интегральным коэффициентом поглощения света, которые, в отличие от поверхностной облучённости, площади и объёма фотобиореактора, будут изменяться в процессе роста культуры. В работе (Wu et al., 2021) представлена динамика изменения биохимического состава спирулины с ростом плотности накопительной культуры. Согласно этим данным, содержание жиров в клетках A. platensis практически не изменялось, углеводов – увеличивалось, а белков – уменьшалось. Зная, сколько энергии содержится в 1 грамме каждого биохимического компонента биомассы (белки – 5,6 ккал; жиры – 9,3 ккал; углеводы – 4,2 ккал) (Геворгиз, Шматок, Лелеков, 2005), можно рассчитать калорийность биомассы спирулины в целом. Для этого необходимо просуммировать отдельные вклады калорийности. Полученное значение R варьировало от 4907 кал до 4492 кал, или от 20,5 кДж до 18,8 кДж. То есть, можно сказать, что в процессе роста накопительной культуры калорийность биомассы A. platensis практически не изменяется. Проведённые расчёты подтверждаются прямыми измерениями калорийности биомассы A. platensis в лабораторных условиях (Zanolla et al., 2021), которая составила 22–24 кДж · г-1. Поэтому для расчёта КПД фотобиоситеза можно использовать среднее значение 22 кДж на грамм сухой биомассы. Как было указано выше, для первоначального периода роста (экспоненциальной фазы) характерно увеличение биомассы культуры по экспоненциальному закону (2). Удельная скорость роста остаётся неизменной, так как при малых плотностях культуры клетки не затеняют друг друга (Тренкеншу, 2005). Однако продуктивность на этой фазе будет возрастать с увеличением биомассы. Далее в линейной фазе скорость роста постоянна, а биомасса растёт согласно формуле (3). Это объясняется тем, что увеличение концентрации клеток культуры будет компенсироваться уменьшением удельной скорости роста из-за лимитирования по количеству световой энергии, приходящейся на одну клетку. За счёт самозатенения клеток в растущей накопительной культуре количество падающей на клетку энергии ФАР снижается. То есть, в течение всего роста, продуктивность сначала экспоненциально растёт, а потом не изменятся, что можно объяснить ростом количества поглощённой энергии. Зависимость интегрального коэффициента поглощения в диапазоне ФАР от концентрации хлорофилла а представлена на рис. 5А. Данные с высокой точностью (R2 = 0,99) описываются законом Бугера-Ламберта-Бера: где Схл – концентрация хлорофилла а, мг·м-2; k = 0,017 – удельный показатель поглощения, м2·мг-1. Анализ выражения (6) показывает, что при поверхностной концентрации хлорофилла а 1 мг·м-2 клетки культуры A. platensis поглощают 2% падающего света. Практически 100 процентное поглощение наблюдается при концентрации хлорофилла а выше 250 мг·м-2. Для сравнения в работе (Тренкеншу, Лелеков, Новикова, 2018) определено значение удельного показателя поглощения для зелёных морских водорослей, которое составило 0,008 м2·мг-1. По литературным данным известно, что данный параметр определяется спектральным составом света, и варьирует от 0,005 до 0,03 м2·мг-1 для различных систематических групп низших фотоавтотрофов (Ефимова, 2021).
Заключение В работе исследована динамика продуктивности, удельной скорости роста, калорийности с ростом накопительной культуры A. platensis в условиях светолимитирования. Показано, что интегральный коэффициент поглощения света увеличивается с ростом плотности культуры, достигая максимального значения в начале линейной фазы. Зависимость α от поверхностной концентрации хлорофилла а с высокой точностью описывается законом Бугера-Ламберта-Бера. Величина удельного показателя поглощения составила 0,017 м2·мг-1, что примерно в два раза выше, чем у зелёных водорослей. КПД фотобиосинтеза также зависит от концентрации хлорофилла а на экспоненциальной фазе роста, в то время как на линейной фазе она не изменяется и составляет 4,9%.
Работа выполнена в рамках Госзадания ФИЦ «Институт биологии южных морей имени А. О. Ковалевского РАН», № гос. регистрации 121030300149-0. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Поступила в редакцию 10.02.2022
Об авторах Клочкова Виктория Сергеевна – Viktoriya S. Klochkova студент, Севастопольский государственный университет, Севастополь, Россия Sevastopol State University, Sevastopol, Russia); кафедра «Физика» viki-iki@mail.ru Лелеков Александр Сергеевич – Alexander S. Lelekov кандидат биологических наук a.lelekov@yandex.ru Корреспондентский адрес: Россия, 299011, г. Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ РАН; тел. +7 (869)255-07-95.
ССЫЛКА: Клочкова В.С., Лелеков А.С. Исследование эффективности фотобиосинтеза накопительной культуры Arthrospira (Spirulina) platensis // Вопросы современной альгологии. 2022. №1 (28). С. 13–24. URL: http://algology.ru/1775 DOI – https://doi.org/10.33624/2311-0147-2022-1(28)-13-24 EDN – HOFGVH При перепечатке ссылка на сайт обязательна
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Study of photobiosynthesis efficiency of Arthrospira (Spirulina) platensis batch culture Viktoria S. Klochkova1, Alexander S. Lelekov2 1Sevastopol State University (Sevastopol, Russia)
Key words: integral absorption coefficient; Gaussian function; chlorophyll a concentration; photobiosynthesis efficiency
References
Authors Klochkova Viktoriya S. ORCID – https://orcid.org/0000-0002-2120-9589 Sevastopol State University, Sevastopol, Russia viki-iki@mail.ru Lelekov Alexander S. ORCID – https://orcid.org/0000-0002-3876-3455 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia a.lelekov@yandex.ru
ARTICLE LINK: Klochkova V.S., Lelekov A.S. Study of photobiosynthesis efficiency of Arthrospira (Spirulina) platensis batch culture.Voprosy sovremennoi algologii (Issues of modern algology). 2022. № 1 (28). P. 13–24. URL: http://algology.ru/1775 DOI – https://doi.org/10.33624/2311-0147-2022-1(28)-13-24 EDN – HOFGVH When reprinting a link to the site is required Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||