|
|
|
|
с международным участием «Водоросли: проблемы таксономии, экологии и использование в мониторинге», посвященной памяти Веры Ивановны Есыревой (Нижний Новгород) Новый род почвенных зеленых микроводорослей Edaphochloris gen. nov. (Chlorellaceae, Trebouxiophyceae)
Темралеева А.Д.1, Кривина Е.С.1, Болдина О.Н.2 Anna D. Temraleeva, Elena S. Krivina, Olga N. Boldina 1ФИЦ «Пущинский научный центр биологических исследований РАН» (Пущино, Россия) УДК 582.263
Проблема изучения видового разнообразия одноклеточных зеленых коккоидных микроводорослей (Chlorophyta) до сих пор актуальна, поскольку относительно простая морфология их клеток чрезвычайно затрудняет точную идентификацию. В настоящее время наилучшим подходом для создания новой, более естественной классификации «маленьких зеленых шариков» считается подход, сочетающий морфологические, экофизиологические и молекулярно-филогенетические методы. Штаммы ACSSI 104 и ACSSI 144 были выделены из солонца и каштановой почвы (Волгоградская область, Россия). Их клетки имеют типичное Nannochloris-подобное строение: одиночные шаровидные или широкоовальные, с пристенным чашевидным хлоропластом без пиреноида, но с присутствием зерен крахмала. Старые клетки накапливают липидные капли в цитоплазме. Размножение осуществляется 2–4 автоспорами равного размера, которые высвобождаются при разрыве клеточной стенки материнского спорангия. Зооспоры и половое размножение не обнаружены. Оба штамма являются частью кластера, тесно связанного с родами Marvania, Pumiliosphaera, Nannochloris и Gloeotila. Анализ гена 18S рРНК показал, что исследуемые штаммы вошли в состав самостоятельного кластера, сестринского родам Marvania, Pumiliosphaera, Nannochloris и Gloeotila. Сравнительный анализ морфологических (размер клеток, тип хлоропласта) и ультраструктурных характеристик (строение клеточной стенки и ламеллярной системы), особенностей размножения (бесполое размножение только автоспорами), среды обитания (почва) с другими представителями клады Nannochloris, а также результаты анализа гена 18S рРНК и вторичной структуры ITS2 изученных штаммов, позволили нам предложить новый род Edaphochloris с типовым видом – E. andreyevae. Подготовлено по материалам V Всероссийской научной конференции с международным участием «Водоросли: проблемы таксономии, экологии и использование в мониторинге», 2021 г. Ключевые слова: экология; световая микроскопия; Nannochloris-подобные водоросли; филогенетический анализ; размножение; таксономия; TEM
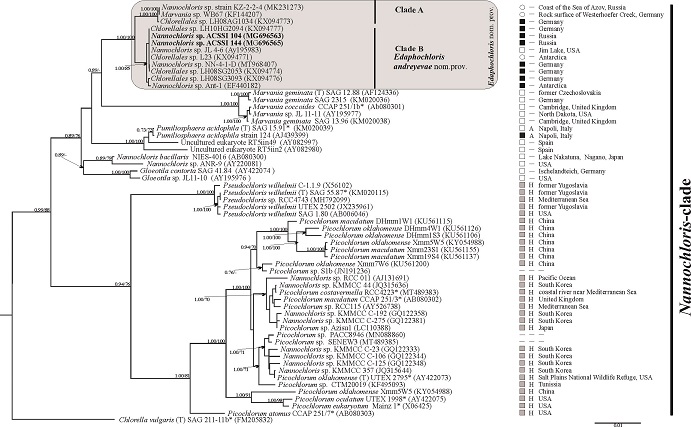
Исследование видового разнообразия одноклеточных коккоидных зеленых водорослей до сих пор весьма проблематично из-за их относительно простой морфологии. На сегодняшний день для разработки новой, более естественной классификации так называемых «маленьких зеленых шариков» наилучшим считается подход, объединяющий морфологические, экофизиологические и молекулярно-филогенетические методы. Создание такой классификации все еще продолжается, и на сегодняшний день существует значительное количество «проблемных групп» организмов, которые нуждаются в тщательном изучении (Somogyi et al., 2014; Darienko, Pröschold, 2015; Krasovec et al., 2018). Род Nannochloris впервые был описан E. Naumann в 1921 году и изначально включал 2 вида – N. bacillaris и N. coccoides (Naumann, 1921). К сожалению, аутентичные штаммы типовых видов утеряны, следовательно, молекулярная информация для них отсутствует. В дальнейшем к данному роду было отнесено еще пять видов (Butcher, 1952; Droop, 1955; Tschermak-Woess, 1981; Menzel, Wild, 1989). Однако молекулярно-генетические исследования показали, что род Nannochloris является полифилетичным (Somogyi et al., 2014; Krasovec et al., 2018). На данный момент род Nannochloris включает только один вид – N. bacillaris, а в состав клады Nannochloris входит шесть родов – Gloeotila (Kützing, 1843), Nannochloris (Naumann, 1921), Marvania (Hindák, 1976), Picochlorum (Henley et al., 2004), Pseudochloris (Somogyi et al., 2014) и Pumiliosphaera (Darienko, Pröschold, 2015). Все они являются свободноживущими организмами из пресноводных, морских и наземных экосистем (Guiry, Guiry, 2021). Цель данной работы – комплексное исследование двух штаммов зеленой Nannochloris-подобной микроводоросли на основе данных морфологии, ультраструктуры, экологии и филогении. Объектом исследования стали штаммы ACSSI 104 и ACSSI 144, выделенные из солонца и каштановой почвы соответственно (Волгоградская область, Россия) в августе 2014 г. и депонированные в Альгологическую коллекцию Института физико-химических и биологических проблем почвоведения РАН (Algal Collection of Soil Science Institute, ACSSI, http://acssi.org/). Культивирование штаммов, световая микроскопия, выделение ДНК, амплификация и очистка ампликонов проводились по стандартным протоколам, описанным ранее (Кривина, Темралеева, 2020). Для электронной микроскопии использовался протокол подготовки образцов, приведенный в работе Egorova et al. (2018). Филогенетический анализ выполнили с использованием последовательностей гена 18S рРНК в качестве молекулярного маркера. Выборка последовательностей для филогенетического анализа была составлена с помощью алгоритма BLASTn в GenBank (https://blast.ncbi.nlm.nih.gov) на основе критериев максимального сродства (сходство ≥95%), качества считывания (без вырожденных и неизвестных нуклеотидов), длины считывания (не менее 1600 п.н.), а также принадлежности к аутентичным и коллекционным штаммам. Интроны, обнаруженные в гене 18S рРНК, были удалены из выравнивания. Набор данных содержал 59 последовательностей представителей Trebouxiophyceae, включая Chlorella vulgaris в качестве аутгруппы. Множественное выравнивание было выполнено в BioEdit 7.2.5 с использованием алгоритма ClustalW. На основе AIC в jModelTest модель замещения нуклеотидов GTR+I+G была выбрана в качестве оптимальной модели для ML и BI. Реконструкцию филогенетических взаимосвязей осуществляли с помощью метода максимального правдоподобия (ML) в программе PhyML и с помощью метода Байеса (BI) с использованием BEAST v.1.8.0. Расчет генетических расстояний проводился в программе MEGA 6.0. Для уточнения филогенетического положения и таксономического статуса новых микроводорослей был проведен анализ вторичной структуры ITS2 и поиск компенсаторных замен (CBC). Фолдинг ITS2 проводили с помощью веб-сервера RNAfold web server (http://rna.tbi.univie.ac.at//cgi-bin/RNAWebSuite/RNAfold.cgi) в соответствии с принципом минимальной энергии. При оценке правильности предсказания вторичной структуры ITS2 ориентировались на работы А. Coleman (2015) и Caisová с соавт. (2013). Сравнение вторичной структуры спейсеров между штаммами, поиск консервативных мотивов и CBC осуществляли в программе 4SALE. Штаммы ACSSI 104 и ACSSI 144 имели сходную морфологию. Они не продуцировали щетинки и не формировали колонии. Вегетативные клетки шаровидные или широкоовальные диаметром 2,0–5,5 мкм, слизь отсутствовала. Клеточная стенка толщиной 40–110 (170) нм, с двумя различными слоями: наружный триламеллярный слой (около 15 нм) и довольно толстый фибриллярный внутренний слой. Внешний слой имеет более темную внутреннюю ламеллу и волнистые контуры. Внутренний слой неоднороден. В молодых клетках он очень плотный и почти сливается с внутренней ламеллой наружного слоя, тогда как в зрелых клетках он более прозрачный; наряду с ростом его наружной толстой части проявляется периплазматическое пространство, прилегающее к плазмалемме. В вегетативных клетках внутренний слой обычно равномерно окружает протопласт. Плазмалемма более или менее волнистая. Хлоропласт пристенный, чашевидный, без пиреноида, занимает большую часть клетки. В клетках иногда присутствуют зерна крахмала. Цитоплазма зернистая, заполнена многочисленными рибосомами. Ядро одно, со слабо агрегированным хроматином. Расположено в центре, субцентрально или редко базально. Одна или две митохондрии и одно тело Гольджи обычно располагаются вблизи ядра. Гигантское тело, напоминающее большую вакуоль с неодинаковой плотностью, располагается ближе к периферии. В старых вегетативных клетках довольно крупные липидные глобулы представлены как субцентрально, так и на периферии цитоплазмы. Размножение осуществляется 2–4 автоспорами равного размера, высвобождение которых происходит при разрыве клеточной стенки материнского спорангия. Половое размножение не обнаружено. В настоящее время идентификация и классификация видов и родов Nannochloris-подобных водорослей основаны преимущественно на анализе гена 18S рРНК, поскольку информации о нуклеотидных последовательностях ITS2 крайне мало (Yamamoto et al., 2007; Krienitz, Bock, 2012; Somogyi et al., 2014). По данным 18S рРНК-анализа изученные штаммы вошли в состав кластера, объединяющегося с родами Marvania, Pumiliosphaera, Nannochloris и Gloeotila (PP 0,89, BP 76%), которые не являются галофилами (рис. 1). В то время как представители родов Picochlorum и Pseudochloris были выделены с высокой статистической поддержкой в особую группу, в которую вошли в основном обитатели морских/солоноватых водоемов, размножающиеся только автоспорами. Сам кластер состоял из 2 подгрупп. Первая подгруппа (клада А) включала 3 штамма: LH08AG1034, выделенный из почвы; WB 67 и KZ-2-2-4, изолированные из биопленок со скал и почвы соответственно. Вторая подгруппа (клада В) содержала 9 штаммов: штаммы LH10HG2094, ACSSI 104, ACSSI 144, NN-4-1-D, LH08SG2053, LH08SG3093, изолированные из почвы; штамм Ant-1 – из вечной мерзлоты; штамм JL 4-6 – из прибрежной зоны пресноводного водоема, а штамм L23 – из содержимого кишечника беспозвоночного в Антарктиде. Уровень генетических различий между штаммами в кладе А составляли 0%, в кладе В – не более 0,1%, между кладами – 0,4–0,5%. Уровень генетических различий между кластером, объединяющим клады A и B, и представителями других родов варьировал в пределах 1,5–2,9%. Кластер, содержащий изученные и близкородственные штаммы (клады А и В), имел ряд существенных различий, подтверждающих его независимый таксономический статус от других членов группы: 1) Размеры клеток ACSSI 104 и ACSSI 144 (2,0–5,5 мкм) были выше, чем у представителей сестринского рода Marvania (до 4 мкм). Клетки изученных штаммов всегда были только одиночными, хотя члены рода Marvania могут формировать короткие псевдонити из-за особенностей размножения (Hindák, 1976; Henley et al., 2004; Yamamoto et al., 2007; Eliáš, Neustupa, 2009). В отличие от штаммов нашей коллекции представители рода Pumiliosphaera имеют особый тип хлоропластов (двулопастной). Характерными чертами N. bacillaris NIES-4016 и Gloeotila contorta SAG 41.84 являлись цилиндрическая форма клеток и боковой хлоропласт. Кроме того, размер клеток G. contorta SAG 41.84 (более 6 мкм) значительно превышает размер клеток ACSSI 104 и ACSSI 144; 2) штаммы ACSSI 104 и ACSSI 144 в отличие от других представителей Nannochloris-клады размножаются исключительно автоспорами. Что касается других членов группы, то представители рода Marvania размножаются преимущественно почкованием и лишь иногда автоспорами, Pumiliosphaera размножается автоспорами и почкованием, N. bacillaris NIES-4016 и G. contorta SAG 41.84 – бинарным делением (Yamamoto et al., 2007; Eliáš, Neustupa, 2009; Darienko, Pröschold, 2015); 3) по сравнению с Picochlorum у штаммов ACSSI 104 и ACSSI 144 более толстая клеточная стенка с четко выраженным внутренним слоем, а также хорошо упорядоченная и более плотная организованная ламеллярная система хлоропласта. В отличие от Pseudochloris в триламеллярном слое клеточной стенки изученных штаммов ACSSI внутренняя пластинка темнее внешней. Оба штамма отличаются от Picochlorum и Pseudochloris накоплением крахмала в различных частях хлоропласта, особенно в старых клетках; 4) ACSSI 104 и ACSSI 144, как и большинство штаммов, вошедших с ними в один кластер, были обитателями почвы. Представители кластера имеют широкое географическое распространение – от солонцовых и каштановых почв Юга России до вечной мерзлоты Антарктиды. Типичным местом обитания сестринского рода Marvania, а также N. bacillaris NIES-4016 и G. contorta SAG 41.84 являются пресноводные водоемы (Hindák, 1976; Henley et al., 2004; Yamamoto et al., 2007). Среда обитания представителей близкородственного рода Pumiliosphaera – кислые водоемы и почва вблизи них (Darienko, Pröschold, 2015); 5) генетические различия между кластером, включающими наши и близкородственные штаммы (клады А и В), и представителями других родов варьировали в диапазоне 1,5–2,9%, что соответствует межродовому уровню для клады Nannochloris. Для сравнения, генетическая дистанция между родами Gloeotila и Nannochloris составляет 1,4%, между Gloeotila и Pumiliosphaera – 1,5%. При этом уровень генетических различий между кладами А и В – 0,4–0,5%, что соответствует межвидовому уровню, как и генетическая дистанция между видами M. coccoides и M. geminata, которая не превышает 0,2%. Исходя из этого мы можем предположить, что предлагаемый новый род, по-видимому, содержит два отдельных вида; 6) Сравнение вторичной структуры ITS2 ACCSI 104 с другими представителями кластера, для которых известны нуклеотидные последовательности ITS2, не выявило CBC. Однако были обнаружены различия в структуре IV шпильки и непарных областей I и II шпилек между членами клад A и B. Отметим, что в отличие от всех других членов группы негалофильных организмов, штаммы клады В имеют более длинный пиримидин-пиримидин мисматч во II шпильке. Штаммы клады A имеют 1 CBC в консервативном регионе II шпильки по сравнению со штаммами Marvania SAG 13.96 и SAG 12.88, а штаммы клады B – 1 CBC в вариабельной области I шпильки. Между исследуемыми штаммами и представителями Pumiliosphaera обнаружено 4 CBC в консервативных регионах II и III шпилек. Хотя между членами изученных клад А и В не выявлено CBC, уровень генетических различий указывает на то, что они могут быть отдельными видами в рамках одного рода, но для окончательного решения, на наш взгляд, требуются дополнительные исследования.
ПОСМОТРЕТЬ УВЕЛИЧЕННОЕ ИЗОБРАЖЕНИЕ Рис. 1. Укорененное филогенетическое дерево клады Nannochloris (Trebouxiophyceae, Chlorophyta), построенное методом Байеса (BI), на основе последовательностей гена 18S рРНК (1761 п.н.). В качестве статистической поддержки узлов дерева указаны значения для метода Байеса и бутстреп-значения ML (PP/BP); значения <0.7 для BI и <70% для ML не показаны. Модель нуклеотидных замен: GTR + I + G. Обозначения: жирным шрифтом выделены исследуемые штаммы ACSSI, * − аутентичные штаммы; T – типовой вид; серый фон – члены Edaphochloris nom. prov.; черный квадрат – почвенная среда обитания, белый квадрат – пресноводные водоемы, серый квадрат – морские водоемы, белый круг – другие среды обитания; A – ацидофил, H – галофил; «–»– отсутствие данных
Обобщая все вышесказанное, сравнительный анализ морфологических, экологических и молекулярно-генетических характеристик членов клады Nannochloris однозначно подтверждает, что изученные штаммы ACSSI 104 и ACSSI 144 являются представителями нового рода – Edaphochloris nom. prov. Название рода происходит от преимущественно почвенной среды обитания. В качестве типового вида данного рода мы предлагаем E. andreyevae nom. prov., представителями которого являются аутентичный штамм ACSSI 104 и близкие к нему штаммы клады В (LH10HG2094, ACSSI 144, NN-4-1-D, LH08SG2053, LH08SG3093, Ant-1, JL 4-6, L23). Данный вид назван в честь альголога В.М. Андреевой (Россия), которая внесла большой вклад в изучение почвенных зеленых коккоидных микроводорослей. Штаммы клады А (KZ-2-2-4, WB67, LH08AG1034), очевидно, принадлежат к другому виду того же рода, но нуждаются в более детальном изучении. Подробный таксономический диагноз выше названных рода и вида почвенных водорослей, а также более детальное исследование членов Nannochloris-клады представлено в статье Temraleeva et al. (2022). Подготовлено по материалам V Всероссийской научной конференции с международным участием «Водоросли: проблемы таксономии, экологии и использование в мониторинге», 2021 г.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Статья поступила в редакцию 20.06.2021
Об авторах Темралеева Анна Дисенгалиевна – Anna D. Temraleeva кандидат биологических наук temraleeva.anna@gmail.com Кривина Елена Сергеевна – Elena S. Krivina кандидат биологических наук pepelisa@yandex.ru Болдина Ольга Николаевна – Olga N. Boldina кандидат биологических наук olgab1999@mail.ru Корреспондентский адрес: 142290, Россия, г. Пущино, пр-т Науки, 3, ФИЦ ПНЦБИ РАН; тел. +7(496)773-86-33.
ССЫЛКА: Темралеева А.Д., Кривина Е.С., Болдина О.Н. Новый род почвенных зеленых микроводорослей Edaphochloris gen. nov. (Chlorellaceae, Trebouxiophyceae) // Вопросы современной альгологии. 2022. № 1 (28). P. 94–101. URL: http://www.algology.ru/1805 DOI – https://doi.org/10.33624/2311-0147-2022-1(28)-94-101 EDN – UJNEBI
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
A new genus of soil green microalgae Edaphochloris gen. nov. (Chlorellaceae, Trebouxiophyceae) Anna D. Temraleeva1, Elena S. Krivina1, Olga N. Boldina2 1Federal Research Center ‘Pushchino Scientific Center for Biological Research of RAS
Keywords: ecology; light microscopy; Nannochloris-like algae; phylogenetic analysis; reproduction; taxonomy; TEM.
References
Authors Temraleeva Anna D. ORCID ID – https://orcid.org/0000-0002-3445-0507 Federal Research Center “Pushchino Scientific Center for Biological Research of the Russian Academy of Sciences”, Pushchino, Russia temraleeva.anna@gmail.com Krivina Elena S. ORCID ID – https://orcid.org/0000-0002-0849-5832 Federal Research Center “Pushchino Scientific Center for Biological Research of the Russian Academy of Sciences”, Pushchino, Russia pepelisa@yandex.ru Boldina Olga N. ORCID – https://orcid.org/0000-0002-1354-2410 Komarov Botanical Institute of the RAS, Saint-Petersburg, Russia olgab1999@mail.ru
ARTICLE LINK: Temraleeva A.D., Krivina E.S., Boldina O.N. A new genus of soil green microalgae Edaphochloris gen. nov. (Chlorellaceae, Trebouxiophyceae). Voprosy sovremennoi algologii (Issues of modern algology). 2022. № 1 (28). P. 94–101. URL: http://www.algology.ru/1805 DOI – https://doi.org/10.33624/2311-0147-2022-1(28)-94-101 EDN – UJNEBI
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
На ГЛАВНУЮ

|
|||
|
| ||