|
|
|
|
Экология водорослей. Загрязнение и охрана окружающей среды Оценка действия бурового растворa на зостеру Zostera noltii
Руднева И.И.1, Шайда В.Г.2, Медянкина М.В.3, Шайда О.В.1 Irina I. Rudneva, Valentin G. Shaida, Maria V. Medyankina, Oleg V. Shaida
1Морской гидрофизический институт (Севастополь, Россия)
УДК 54.057+541.183.12
Развитие нефтегазового комплекса в шельфовой зоне морей и океанов связано с применением веществ, используемых при бурении скважин. Эти препараты состоят из многих компонентов, некоторые из которых обладают токсическими свойствами, которые могут оказать негативное действие как на водную растительность, так и на здоровье людей, употребляющих в пищу морепродукты. Возникает необходимость оценить токсичность буровых растворов и их воздействие на гидробионтов. Исследовали влияние бурового раствора в широком диапазоне концентраций 0,004; 0,02; 0,05; 1; 5; 10; 62,5; 125; 250; 500 и 1000 мг/л на показатели роста зостеры Zostera noltii в течение 30 суток. Установлено неоднозначное влияние вещества на зостеру, зависящее от концентрации и времени воздействия. Ключевые слова: буровой раствор; токсичность; стимулирующий эффект; зостера Zostera noltii
Введение Нефть является одним из основных загрязнителей водной среды, ее токсическое действие на морские организмы достаточно полно изучено. Нефть и ее продукты поступают в моря и океаны в результате аварий судов и танкеров, сбросов балластных и технических вод, с речным стоком и атмосферными осадками, а также при разработке нефтяных и газовых месторождений в прибрежной зоне моря (Патин, 2015; Beyer et al., 2016). Для бурения скважин при добыче нефти и газа на шельфе моря применяются специальные компоненты – буровые растворы, которые попадают в морскую среду и оказывают негативное действие на экосистему и ее обитателей. Буровые растворы – это сложные многокомпонентные смеси, состоящие из воды, органических растворителей, тяжелых металлов, которые оказывают токсическое, мутагенное и канцерогенное воздействие на гидробионтов (Antia et al., 2022; Pereira et al., 2022). В связи с интенсивным развитием нефтегазового комплекса на шельфе оценка токсичности буровых растров и установление их допустимых концентраций для морской среды имеет важное практическое и теоретическое значение. При проведении буровых работ в прибрежной зоне моря в наибольшей степени страдают бентосные сообщества, включая макрофиты и высшую водную растительность, которая в прибрежных донных биоценозах в основном представлена зостерой (Olsen et al., 2016). Это уникальная группа растений, которая широко распространена в морях и океанах и адаптирована к широким вариациям солености. Сообщества зостеры играют важнейшую роль в структуре и функционировании прибрежных экосистем, так как служат кормом и убежищем для многих морских обитателей, в том числе имеющих промысловое значение (Short et al., 2007). Зостера отличается высокой продуктивностью (York et al., 2015) и наряду с другими морскими макрофитами участвует в процессах утилизации биогенов, включая углерод, что имеет важное значение в биосферном обмене и биогеохимических циклах этих элементов (Short et al., 2016). В то же время интенсивная антропогенная деятельность крайне негативно влияет на заросли зостеры, в результате чего около 29% мирового запаса считается исчезнувшим (Short et al., 2016). Активное накопление растением загрязнителей важно учитывать при разработке тест-систем, использующих в качестве тест-объектов морские водоросли и растения, подвергающиеся действию токсических веществ. При этом следует принимать во внимание концентрации токсикантов, которые могут вызывать неоднозначные эффекты, что было показано на примере нефтяного загрязнения (Bejarano et al., 2023). Цель работы заключалась в оценке влияния различных концентраций бурового раствора на основе гемицеллюлозы на некоторые показатели роста черноморской зостеры Zostera noltii в экспериментальных условиях.
Материалы и методы исследований Зостеру отбирали в прибрежной части Черного моря в Казачьей бухте (район Севастополя) и немедленно доставляли в лабораторию. Растения отмывали от загрязнений и эпифитной флоры, адаптировали к условиям эксперимента в морской воде в течение 3 суток при температуре +22 ± 2°С. Растения в количестве трех экземпляров помещали в 1,5 л сосуды. Опыты проводили в трехкратной повторности в течение 30 суток. Контролем служила естественная морская вода соленостью 18‰ без добавления вещества. Эксперименты проводили в соответствие со стандартными методами (Методические рекомендации, 2009). Действие вещества исследовали в концентрациях 0,004; 0,02; 0,05; 1; 5; 10; 62,5; 125; 250; 500 и 1000 мг/л, для чего проводили три серии опытов: 1 – концентрация токсиканта составила 0,004–0,05 мг/л, 2 группа – концентрация вещества 1–10 мг/л, третья группа – 62,5–1000 мг/л. Воду меняли через каждые 6–7 суток с добавлением соответствующих концентраций вещества и проводили анализ растений по приросту биомассы, листьев и корней. Результаты обрабатывали статистически, вычисляли среднее значение, ошибку среднего. Сравнение результатов проводили с помощью критерия Стьюдента при уровне значимости p<0,05.
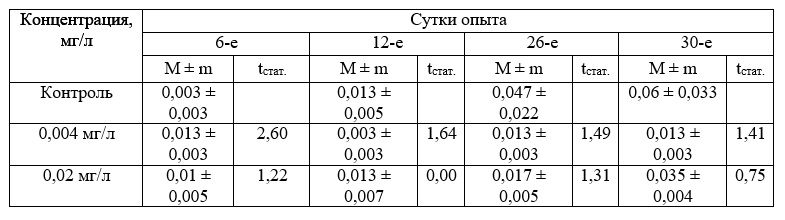
Результаты и обсуждение Результаты исследований показали влияние вещества на рост и развитие зостеры при разных концентрациях, однако эффекты были различны. Из представленных в табл. 1 данных можно видеть, что буровой раствор в заданных концентрациях не повлиял на прирост биомассы растения по сравнению с контролем.
Таблица 1. Прирост биомассы Zostera noltii при хроническом воздействии вещества в концентрации 0,004–0,02 мг/л (граммы, в пересчете на 1 растение, M±m)
Примечание: здесь и далее M – среднее значение показателя; m – доверительный интервал; Td – значение критерия Стьюдента
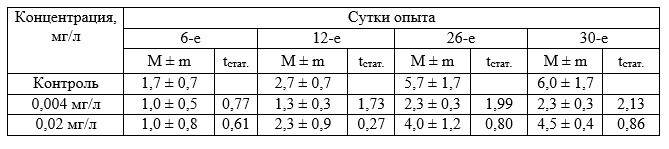
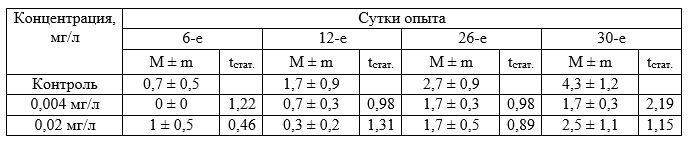
Не обнаружено существенных различий также в приросте листьев и корней при исследуемых концентрациях токсиканта (табл. 2 и 3).
Таблица 2. Прирост листьев Zostera noltii при хроническом воздействии вещества в концентрации 0,004–0,02 мг/л (экз., в пересчете на 1 растение)
Таблица 3. Прирост корней Zostera noltii при хроническом воздействии вещества в концентрации 0,004–0,02 мг/л (экз., в пересчете на 1 растение)
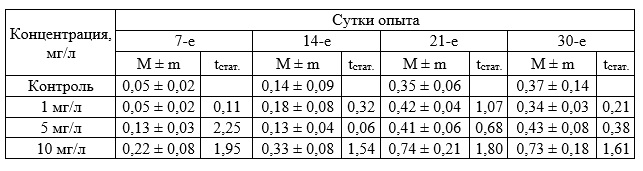
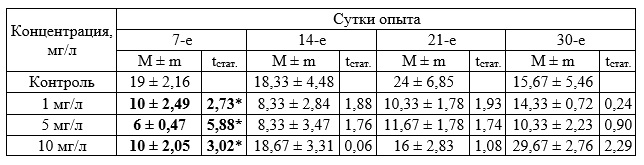
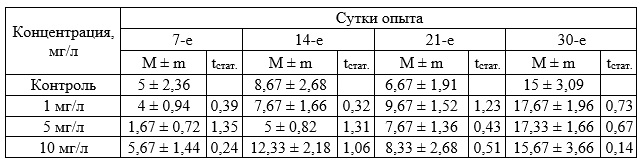
Исследования влияния бурового раствора в диапазоне концентраций 1–10 мг/л на зостеру (табл. 4–6) не выявили существенного различия на прирост биомассы и корней растения. Прирост листьев существенно превышал соответствующие показатели в контроле через 7 суток воздействия при всех исследуемых концентрациях (табл. 4), но затем эффект затухал и к концу эксперимента значимых отличий от контроля не обнаружено.
Таблица 4. Прирост биомассы Zostera noltii при хроническом воздействии вещества в концентрации 1–10 мг/л (граммы, в пересчете на 1 растение, M ± m)
Таблица 5. Прирост листьев Zostera noltii. при хроническом воздействии вещества в концентрации 1–10 мг/л (экз., в пересчете на 1 растение)
Таблица 6. Прирост корней Zostera noltii при хроническом воздействии вещества в концентрации 1 –10 мг/л (экз., в пересчете на 1 растение)
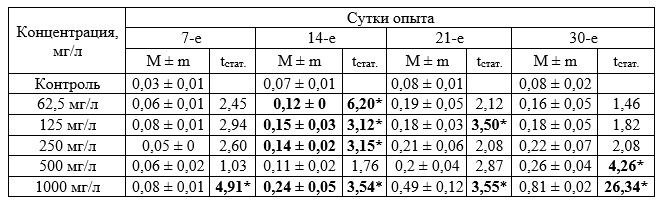
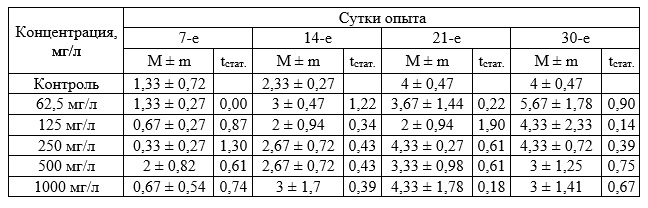
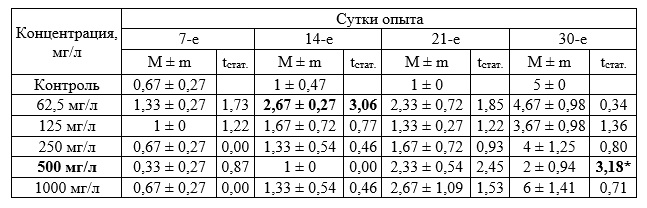
Дальнейшие исследования в диапазоне концентраций 62,5–1000 мг/л позволили установить определенные различия исследуемых показателей опытных и контрольных групп. При концентрации 1000 мг/л прирост массы зостеры был достоверно выше по сравнению с контрольными значениями во все периоды измерения (табл. 7). Значимые различия были отмечены также при концентрации 62,5; 125 и 250 мг/л на 14 сутки. Достоверные различия на 21 сутки установлены при концентрации 125 мг/л и 1000 мг/л, а на 30-е сутки отмечены при концентрации 500 и 1000 мг/л. Достоверных различий с контролем в приросте листьев растений отмечено не было. По приросту корней достоверные различия выявлены на 30-е сутки при концентрации 500 мг/л, в остальных случаях различий не установлено.
Таблица 7. Прирост биомассы Zostera noltii при хроническом воздействии вещества в концентрации 62,5–1000 мг/л (граммы, в пересчете на 1 растение, M ± m)
Таблица 9. Прирост корней Zostera noltii при хроническом воздействии вещества в концентрации 62,5–1000 мг/л (экз., в пересчете на 1 растение))
Таким образом, результаты исследований показали неоднозначные эффекты действия вещества на зостеру, которые зависели от концентрации и времени воздействия. Поскольку зостера широко используется в экотоксикологических исследованиях для анализа накопления и токсичности различных загрязнителей, информация о разнокачественных эффектах необходима для оценки состояния среды ее обитания и разработки критериев предельно допустимых доз. Образуя массивные заросли в прибрежной зоне, в наибольшей степени загрязненной тяжелыми металлами и органическими поллютантами (Girones et al., 2021; Qiao et al., 2022;), растение аккумулирует их и тем самым является хорошим фоторемедиатором коммунальных, сельскохозяйственных и индустриальных сточных вод. Зостера активно поглощает и накапливает фосфорорганические пестициды и в связи с этим может использоваться для очистки акваторий от этих загрязнителей (Olisah et al., 2021). Поскольку растение в больших количествах способно поглощать тяжелые металлы из воды, то оно применятся в качестве биоиндикатора загрязнения водных объектов этими компонентами, а также как фиторемедиант (Lee et al., 2019; Arici, Bat, 2020; Neshovska et al., 2021). Отклики зостеры на токсическое воздействия также характеризуются разнокачественными эффектами, которые по-разному проявляются для различных частей растения. В экспериментальных условиях было показано негативное влияние меди на физиологические и молекулярные показатели зостеры при инкубации ее в течение 7 дней в воде с концентрацией меди 250 и 500 мкг/л (соответственно 3,9 и 7,8 мкM Cu). Максимальное накопление меди в листьях произошло через 3 дня после начала эксперимента и привело к снижению активности фотосинтеза. Одновременно было отмечено увеличение свободнорадикального окисления (СРО) и активация генов ферментов защитной антиоксидантной системы супероксиддисмутазы (Cu/Zn-СОД), аскорбат пероксидазы (АРХ), каталазы (CAT) и глутатионпериоксидазы (GPX), что изменяло регуляцию генов, ответственных за синтез металлотионеинов (Buapet et al., 2019). При экспозиции зостеры в течение 7 дней в растворах с концентрацией меди 250 мг Cu/л и 500 мг Cu /л, наблюдали разрушение хлорофилла, степень которого зависела от дозы токсиканта (Mohammadi et al., 2019). Среднелетальная доза, при которой погибает 50% подопытных организмов (ЛК50), при интоксикации зостеры медью составила 28,9 мкмоль, а кадмием – 2246,8 мкмоль, что свидетельствует о большей токсичности меди для зостеры по сравнению с кадмием. Кроме того, одновременное действие Cu и Cd на фотосинтез имело выраженный синергический эффект. Через 14 дней инкубации в растворе меди ее концентрация в листьях и корнях была в 48 и 37 раз выше, чем в листовом влагалище, и в 14 и 11 раз выше, чем в корневище. Концентрация Cd убывала в последовательности корни > листья > корневище > листовое влагалище. Бóльшая часть различных металлов, таких как As, Cu, Fe, Pb Cd, Co, Zn, Hg накапливались в клеточных органеллах, а Cd также и в цитоплазме. Поскольку аккумуляция тяжелых металлов в зостере вызывала окислительный стресс, сопровождающийся индукцией антиоксидантных ферментов, было сделано заключение, что даже кратковременная интоксикация зостеры тяжелыми металлами в концентрации, ниже ЛК50, приводят к токсическим эффектам. Таким образом, полученные данные могут способствовать определению фоторемедиационных способностей растения (Qiao et al., 2022). При комбинированном воздействии нескольких стрессоров – гербицида иргалола 1051, недостаточном освещении и высокой температуры (27±1,0°C) отмечено угнетение роста растения через 114 дней экспозиции, однако фотосинтетическая активность сохранялась, но снижался общий метаболизм (Mochida et al., 2019). При одновременном действии биогенов, гипоксии и сульфида в течение 7 дней все сеянцы зостеры выжили, но при комбинации разных факторов были отмечены как синергетические, так и антагонистические эффекты, и взаимодействие между ними определяло степень выживаемости сеянцев зостеры (Zheng et al., 2023). В природных условиях также было показано, что зостера в больших количествах накапливает медь и кадмий (Hu et al., 2019) и тем самым может служить удобным биоиндикатором загрязненности вод тяжелыми металлами. В то же время растение является источником необходимых эссенциальных элементов для травоядных гидробионтов, в частности, гаммарусов, живущих в ее зарослях. Это было показано в экспериментальных условиях при содержании Zostera noltei в среде при pH 8,36 и 8,03 и в трех концентрациях меди (<3, 30 и 300 мкг Cu /л) в течение 21 дня (de los Santos et al., 2019). В наших исследованиях буровой раствор в широком диапазоне концентраций не оказал летального эффекта на заростки зостеры. Однако уже при концентрации вещества 1 мг/л происходило снижение прироста листьев растения на 7-ые сутки эксперимента по сравнению с контролем, но затем этот эффект в диапазоне концентраций 1–10 мг/л не проявлялся, что, вероятно, обусловлено развитием адаптивных реакций растения на присутствие в среде токсиканта. При этом прирост биомассы и прирост корней на протяжении всего эксперимента не имел достоверных различий с контрольными экземплярами. Из приведенных данных можно заключить, что наиболее уязвимыми компонентами зостеры к действию бурового раствора при данных концентрациях явились листья. В этом случае наши данные согласуются с данными других исследователей, которые показали, что при действии гербицида глифосфата в концентрациях в пределах 250–2200 мкг/л на рост, морфологию и пигменты фотосинтеза Zostera capensis наиболее чувствительными оказались листья растения. Через три недели экспозиции площадь листьев в среднем уменьшилась на 27%, а прирост биомассы снизился более, чем на 31% (p<0,05). Однако различий между пигментами фотосинтеза в экспериментальных и контрольной группах не установлено (van Wik et al., 2022). Результаты наших дальнейших исследований показали, что при повышении концентраций вещества в пределах 62,5–1000 мг/л происходит интенсивный прирост биомассы растения, начиная с 7 суток при 1000 мг/л и до конца эксперимента, а через 2 недели стимуляцию прироста биомассы наблюдали при всех концентрациях в данном диапазоне. Далее эффект затухал при концентрациях 62,5 и 250 мг/л через 3 недели, при концентрации 125 мг/л тот же эффект наблюдали к 30-м суткам. Интересно отметить, что при концентрации 500 мг/л проявлялась выраженная тенденция к увеличению биомассы зостеры во все периоды эксперимента, но достоверные по отношению к контролю величины отмечены только на 30-й день. Таким образом, на ростовые показатели растения при инкубации его в среде с буровым раствором обнаружен четкий стимулирующий эффект, что было отмечено и для отходов бурения на наземных сельскохозяйственных растениях (Седых и др., 2004). Низкие концентрации токсиканта 0,004–0,02 мг/л не оказали существенного эффекта на прирост листьев зостеры. Стимулирующий эффект на прирост корней растения обнаружен при концентрации 125 мг/л через 7 суток, а ингибирующий – при концентрации 500 мг/л на 30-е сутки эксперимента. Результаты проведенных исследований свидетельствуют о неоднозначном эффекте тестируемого бурового раствора, который оказал угнетающий эффект на прирост листьев зостеры при относительно невысоких концентрациях (1–10 мг/л), но при повышении содержания токсиканта проявилось выраженное стимулирующее действие прироста биомассы. Совершенно очевидно, что наблюдаемые различия явились следствием существенной модификации обменных процессов растения, которые могут привести как к усилению его защитных реакций и развитию компенсационных эффектов за счет нарастания биомассы, так и к токсическим в результате ингибирования прироста листьев. Следует отметить, что, поскольку в состав многих буровых растворов входят тяжелые металлы, то они могут оказать токсические эффекты на растения и способствовать угнетению его жизненных функций, но в комбинации с другими компонентами возможны синергетические и антагонистические эффекты. Определение токсичности буровых растворов с использованием бентосного растения зостеры позволит выявить наиболее безопасные препараты для морских сообществ, а также их допустимые концентрации для морской среды. Это важно при установлении ПДК морских вод, загрязнение которых в прибрежной шельфовой зоне носит комплексный характер на фоне все возрастающей антропогенной нагрузки и в условиях изменения климата.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Поступила в редакцию 13.04.2023
Об авторах Руднева Ирина Ивановна – Irina I. Rudneva доктор биологических наук, профессор svg-41@mail.ru Шайда Валентин Григорьевич – Valentin G. Shaida инженер-исследователь, ООО «ЭкоСервис-А», Москва, Россия («EcoService-A», Moscow, Russia) Svg1841@mail.ru Медянкина Мария Владимировна – Mariya V. Medyankina кандидат биологических наук mediankina@mail.ru Шайда Олег Валентинович – Oleg V. Shaida ведущий инженер, ФИЦ Морской гидрофизический институт РАН, Севастополь, Россия (Marine Hydrophysical Institute of RAS, Sevastopol, Russia), лаб. Инновационного морского приборостроения svg-41@mail.ru
Корреспондентский адрес: Россия, 299011, г. Севастополь, ул. Капитанская, 2, ФИЦ МГИ РАН; тел. (8692)54-52-41.
При перепечатке ссылка на сайт обязательна
Evoluation of biological effects of drilling fluid on marine seagrass Zostera noltii Irina I. Rudneva1, Valentin G. Shaida2, Maria V. Medyankina3, Oleg V. Shaida1 1Marine Hydrophysical Institute of RAS (Sevastopol, Russia)
The development of oil-gas complex in shelf zone of the seas and ocean is connected with the application of the specific chemicals, used in the processes of drilling. These components contain various chemicals, several of which are toxic and influence negative both on aquatic organisms and health of the people, using seafood. Therefore, it is important to evaluate the toxicity of of drilling fluids and their effects on the aquatic organisms inhabiting in the coastal areas of the seas and ocean. The aim of the present study was to analyze the effects of drilling fluid on marine eelgrass Zostera noltii exposed in wide spectrum of concentrations 0,004; 0,02; 0,05; 1; 5; 10; 62,5; 125; 250; 500 and 1000 mg/l. The results obtained demonstrated the non-uniform responses of the eelgrass on the tested drilling fluid, which was depended on its concentration and time of exposure. Key words: drilling fluids; toxicity; stimulate effect; seagrass Zostera noltii
Authors Rudneva Irina I. ORCID – https://orcid.org/0000-0002-9623-9467 Marine Hydrophysical Institute of RAS, Sevastopol, Russia svg-41@mail.ru Shaida Valentin G. «EcoService-A», Moscow, Russia Svg1841@mail.ru Medyankina Maria V. Razumovsky Moscow State University of Technologies and Management, Moscow, Russia mediankina@mail.ru Shaida Oleg V. Marine Hydrophysical Institute of RAS, Sevastopol, Russia svg-41@mail.ru
When reprinting a link to the site is required
К другим докладам Международной конференции
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||