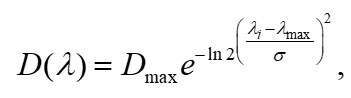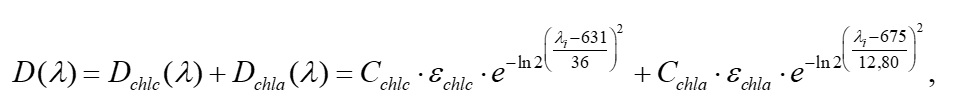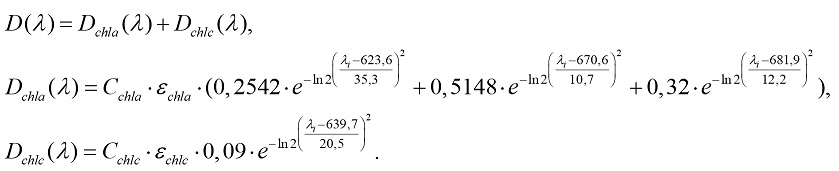|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» X Сабининские чтения - 2023 Моделирование спектра поглощения культуры Phaeodactylum tricornutum Bohlin в красной области
Чернышев Д.Н.1, Клочкова В.С.1, Лелеков А. С.2 Dmitriy N. Chernyshev, Viktoria S. Klochkova, Alexander S. Lelekov
1Севастопольский государственный университет (Севастополь, Россия)
УДК 579.017:57.033
Проведена математическая декомпозиция спектра поглощения культуры красной микроводоросли Phaeodactylum tricornutum Bohlin в области спектра от 550 до 750 нм. Спектры культуры фиксировались на спектрофотометре с интегрирующей сферой. Используя литературные данные, составлены математические модели спектров поглощения в красной области следующих пигментов: хлорофилла а и хлорофилла с. Математическая модель каждого пигмента представляла сумму кривых Гаусса. Полученные уравнения были взяты за основу при моделировании нативного спектра. Составлена общая модель спектра поглощения культуры в области 550–750 нм, состоящая из суммы отдельных пигментов. Используя полученную модель, возможно определить концентрации хлорофилла а и с непосредственно по спектру поглощения культуры. Ключевые слова: микроводоросли; спектры поглощения; хлорофилл а; хлорофилл с; математическое моделирование; кривые Гаусса
Введение Содержание фотосинтетических пигментов в биомассе микроводорослей является важным показателем физиологического состояния культуры. На сегодняшний день известно большое количество методов экстракции пигментов (Kadam et al., 2013; Poojary et al., 2016), которые подразумевают отбор биомассы микроводорослей из фотобиореактора, что приводит к вмешательству в процессы роста культуры. Кроме того, при работе с интенсивными культурами применение стандартных методик делает невозможным исследование динамики концентрации пигментов вследствие продолжительности таких анализов (Копытов и др., 2015). Морская диатомовая водоросль Phaeodactylum tricornutum является модельным объектом в гидроэкологических исследованиях. С практической точки зрения, благодаря способности накапливать полиненасыщенные жирные кислоты и фукоксантин, данный вид рассматривается как перспективный для получения препаратов лечения раковых заболеваний. Пигментный состав Ph. tricornutum представлен хлорофиллами а и с и пятью каротиноидами: β-каротин, фукоксантин, диадиноксантин, диатоксантин и диадинохром (Peng et al., 2011; Бородина, Ладыгина, 2013). Спектрофотометрическое определение концентрации пигментов является достаточно точным экспресс-методом, позволяющим исследовать быстрые изменения пигментного состава культуры, например при переносе клеток с низкой на высокую освещенность. Нативный спектр поглощения несет в себе информацию о количественном и качественном пигментном составе водорослей. Однако для получения такой информации необходима математическая обработка спектров (Чернышев, Клочкова, 2021). Общепринятым является подход по использованию кривых Гаусса при моделировании спектра поглощения культуры (Küpper et al., 2007). Решение оптимизационных задач повышения содержания пигментов в биомассе Ph. tricornutum предполагает использование экспресс-методов их расчета. В этом случае первым шагом является анализ и разделение перекрывающихся полос в красной области нативного спектра поглощения культуры Ph. tricornutum для вычисления концентраций хлорофиллов в чистом виде.
Материал и методы В качестве объекта исследования использовали культуру морской диатомовой водоросли Phaeodactylum tricornutum Bohlin 1898, полученную из коллекции ФИЦ Института биологии южных морей имени А.О. Ковалевского РАН, г. Севастополь. Спектры поглощения регистрировались в диапазоне от 400 до 800 нм с шагом 0,5 нм на двухлучевом спектрофотометре Lambda 365 Double Beam UV-Visible (производитель – Perkin Elmer, Индия), который оснащен интегрирующей сферой (ИС) диаметром 60 мм (внешнее покрытие – BaSO4). Кварцевые кюветы с длиной оптического пути 1 см располагали в стандартном положении и на расстоянии 1 см от входного окна ИС для последующего расчета истинного спектра поглощения, компенсированного на рассеяние по методике (Merzlyak, Naqvi, 2000; Клочкова и др., 2021). При анализе спектра поглощения культуры Ph. tricornutum использовался метод математического дифференцирования в программе SciDAVis. Разделение спектральных полос произведено в программе MagicPlot, в основе которой лежит анализ спектров с применением функции нормального распределения Гаусса. Разделение спектра поглощения на ряд отдельных кривых Гаусса наглядно и применяется рядом авторов (Brown, 2006; Barsanti et al., 2007; Massicotte, Markager, 2016). Адекватность данных моделей и экспериментального нативного спектра оценивали по критерию R2.
Результаты и обсуждение На первом этапе декомпозиции истинного спектра поглощения удобно рассматривать красную область (550–750 нм), где вкладом каротиноидов можно пренебречь. Модель представляет сумму кривых Гаусса, где каждый отдельный пик описан выражением (1): где D(l) – оптическая плотность, отн. ед; Dmax – амплитуда пика, отн. ед; li – длина волны, нм; lмах – положение максимума пика, нм; s – полуширина пика, нм. На рис. 1 представлена аппроксимация красной области спектра культуры Ph. tricornutum суммой двух гауссиан. На основании полученных данных модель спектра культуры поглощения представляет сумму спектров хлорофилла а и c:
где D(l) – общая оптическая плотность, отн. ед; Dchlc – оптическая плотность хлорофилла c; Dchla – оптическая плотность хлорофилла а; Cchlc – концентрация хлорофилла c (г/л); echlc – экстинкция хлорофилла c (л·г-1·см-1); Cchla – концентрация хлорофилла а (г/л); echla – экстинкция хлорофилла а (л·г-1·см-1). Аппроксимация проводилась методом доверительных областей с заданными ограничениями и начальными параметрами. Коэффициент детерминации R2 между экспериментальными и реконструированными спектрами составлял 0,97. Пример разделения спектра представлен на рис. 1.
Рис. 1. Аппроксимация спектра поглощения культуры микроводоросли Ph. tricornutum моделью (2) Fig. 1. Approximation of the absorption spectrum of Ph. tricornutum microalgae culture by model (2)
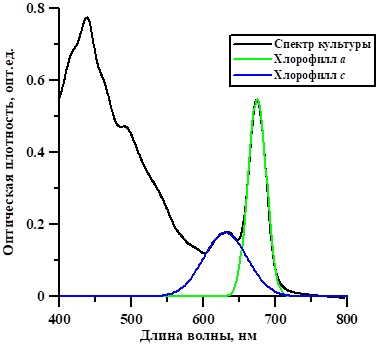
Анализируя рис. 1, отметим, что в пик хлорофилла а делает вклад хлорофилл с. Это необходимо учитывать при расчете концентрации данных пигментов. Кроме того, модель (2) является упрощённой. Она не учитывает вклад первой фотосистемы в области 710 нм. На начальном этапе аппроксимации к культуре были применены обобщённые кривые Гаусса для хлорофилла а и с из литературы (Hoepffner, Sathyendranath, 1991). Результаты представлены на рисунке 2. Оказалось, что данная модель описывает спектр поглощения недостаточно точно (R2 = 0,20). Разница между моделью и спектром представлена на этом же графике (остатки). Поэтому нами проведено разделение спектра для уточнения отдельных параметров модели, а именно максимумов положения пиков и полуширин.
Рис. 2. Разделение спектра поглощения культуры Ph. tricornutum в красной области по данным (Hoepffner, Sathyendranath, 1991). 1 – спектр культуры. Спектры в пиках поглощения: 2 – 700 нм; Fig. 2. Separation of the absorption spectrum of Ph. tricornutum culture in the red region according to (Hoepffner, Sathyendranath, 1991). 1 – spectrum of culture. Spectra in absorption peaks: 2 – 700 nm;
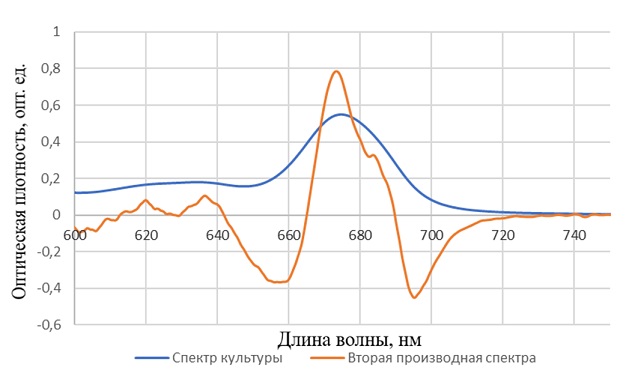
Для уточнения модели и достоверного выявления пиков была вычислена производная второго порядка. Контур второй производной похож на спектр поглощения, но его полосы имеют более тонкую организацию (Гуляев, Литвин, 1970). В производном спектре второго порядка была отмечена сложная структура, в которой прослеживались явные пики и плечи (рис. 3).
Рис. 3. Спектр поглощения и вторая производная (умноженная на -200) культуры микроводоросли Ph. tricornutum нормированный по значению D675 Fig. 3. Absorption spectrum and second derivative (multiplied by -200) of microalgae culture Ph. tricornutum normalized by D675 value
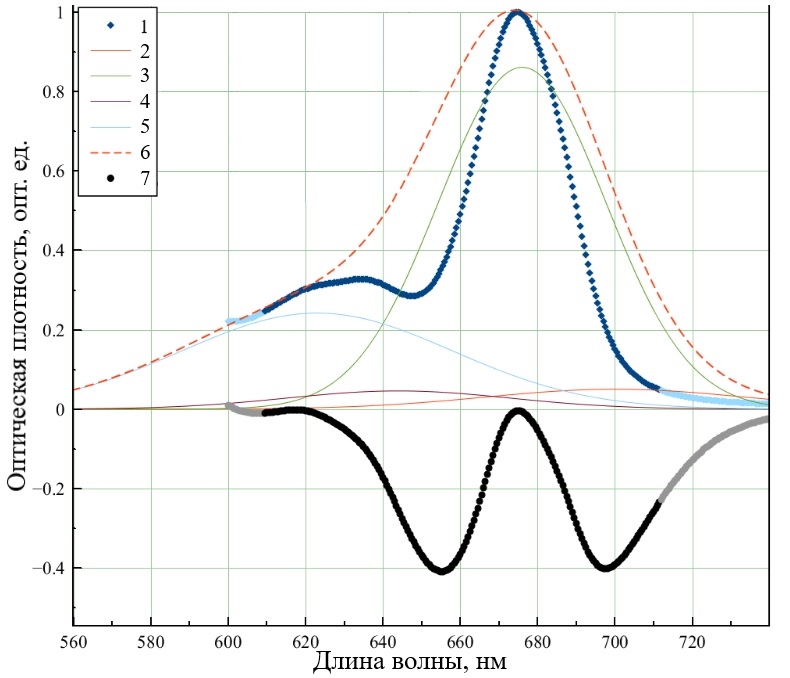
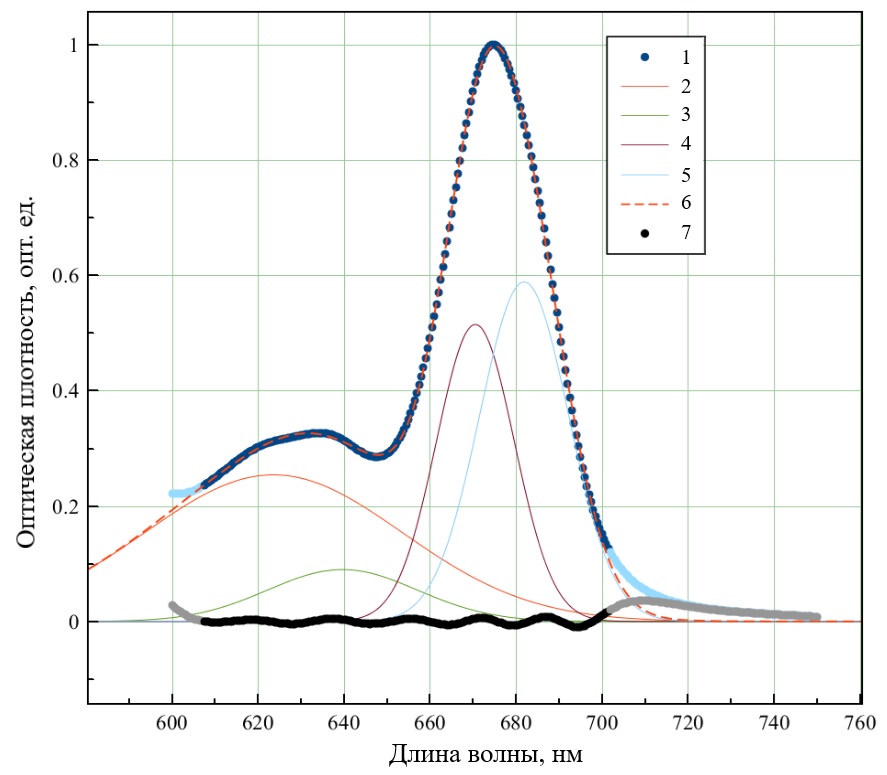
Ниже представлена модель спектра поглощения культуры Ph. tricornutum. Спектр культуры в красной области представляет сумму спектров хлорофилла а и с. То есть отдельный спектр хлорофилла а состоит из 3-х кривых Гаусса, а спектр хлорофилла с – из одной кривой Гаусса. В данной модели 2 неизвестных величины – концентрации хлорофилла а и с: где D(l) – общая оптическая плотность, отн. ед; Dchlc – оптическая плотность хлорофилла c; Dchla – оптическая плотность хлорофилла а; Cchlc – концентрация хлорофилла c (г/л); echlc – экстинкция хлорофилла c (л·г-1·см-1); Cchla – концентрация хлорофилла а (г/л); echla – экстинкция хлорофилла а (л·г-1·см-1). На рис. 4 представлена верификация модели (3) для красной области культуры Ph. tricornutum. Отметим, что по сравнению с моделью (2) модель (3) более адекватно (R2 = 0,99) описывает участок нативного спектра поглощения. Как было показано в предыдущих исследованиях, модель хлорофилла а в красной области представлена двумя пиками в области 620 и 680 нм (Чернышев, Клочкова, 2021). В настоящей модели хлорофилл а представлен тремя кривыми нормального распределения с максимумами – 620, 676, 711 нм, что хорошо согласуется с литературными данными 626, 676, 700 нм по (Hoepffner, Sathyendranath, 1991). Хлорофилл с в модели представлен одной кривой с максимальным значением оптической плотности в области 641 нм, что также соответствует литературным данным – 644 нм (Hoepffner, Sathyendranath, 1991).
Рис. 4. Декомпозиция спектра поглощения культуры микроводоросли Ph. tricornutum на отдельные спектры пигментов моделью (3). 1 – спектр культуры. Спектры в пиках поглощения: 2 – 623,6 нм; 3 – 639,7 нм; 4 – 670,6 нм; 5 – 681,9 нм. 6 – спектр суммарной модели; 7 – остатки Fig. 4. Decomposition of the absorption spectrum of Ph. tricornutum microalgae culture into individual pigment spectra by model (3). 1 – spectrum of culture. Spectra in absorption peaks: 2 – 623,6 nm; 3 – 639,7 nm; 4 – 670,6 nm; 5 – 681,9 nm. 6 – spectrum of the total model; 7 – residues
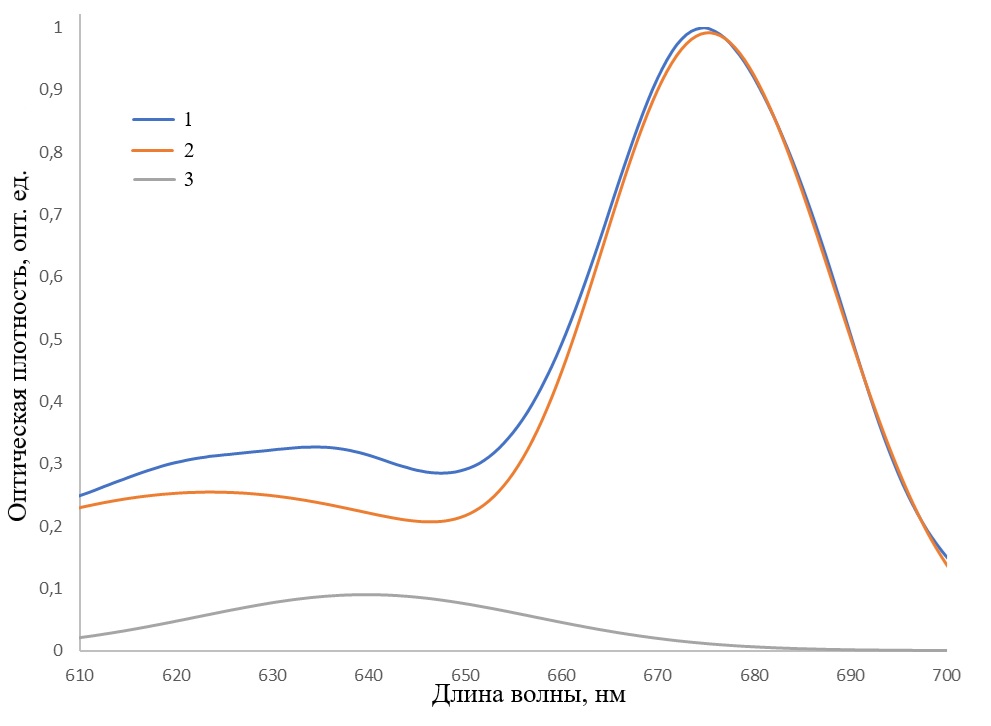
Затем проведено объединение кривых с максимумами 624, 671 и 682 в одну суммарную модель для хлорофилла а. Хлорофилл с описывался только одной кривой с максимумом 640 нм. Не смотря на отличающиеся значения полуширин значения максимумов достаточно близки к литературным данным. Данное разделение спектров представлено на рис. 5. Также на рис. 5 показана разница между спектром поглощения и моделью (3). (а)
(б)
Рис. 5. а) Декомпозиция спектра поглощения культуры микроводоросли Ph. tricornutum в красной области на отдельные спектры пигментов. 1 – спектр поглощения культуры; 2 – спектр поглощения хлорофилла а; 3 – спектр поглощения хлорофилла с. Fig. 5. а) Decomposition of the absorption spectrum of Ph. tricornutum microalgae culture in the red region into separate pigment spectra. 1 – absorption spectrum of the culture; 2 – absorption spectrum of chlorophyll a; 3 – absorption spectrum of chlorophyll c.
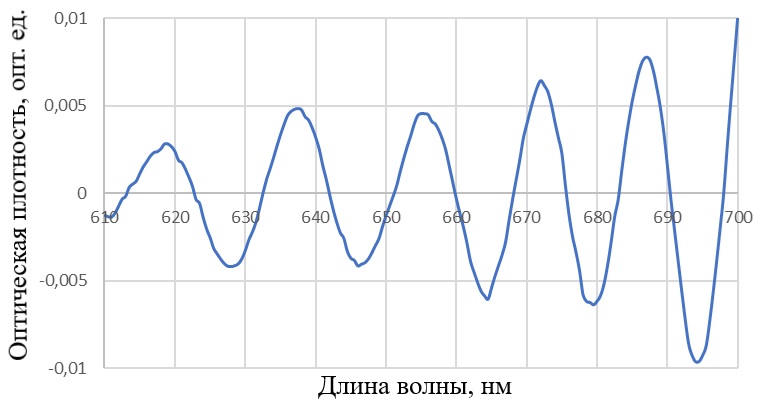
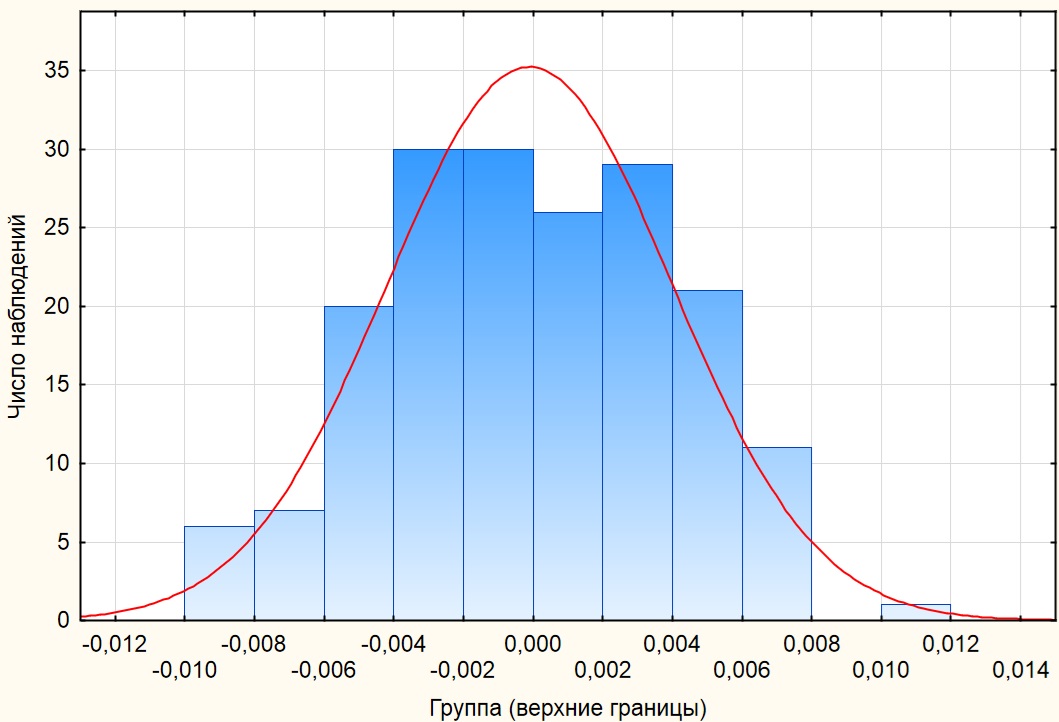
Из рис. 5 видно, что разница между спектром поглощения и его моделью невелика, и остатки описываются кривой нормального распределения, которая показана на рис. 6.
Рис. 6. График остатков, который описывается законом нормального распределения. Fig. 6. Graph of residuals, which is described by the law of normal distribution.
Коэффициенты экстинкции хлорофилла а и с по эталонным справочным данным составляют 88,15 л·г-1·см-1 и 39,2 л·г-1·см-1 соответственно (Jeffrey et al., 1997). Известно, что вследствие эффекта «упаковки» пигментов эти величины в нативной культуре могут изменяться, что требует отдельного исследования учёта этих изменений.
Заключение Предлагаемые способы декомпозиции спектра в красной области могут быть использованы как экспресс-метод определения концентрации хлорофилла а и с в культуре Ph. tricornutum без выделения пигментов в чистом виде. Сравнивая значения критерия R2, можно сделать заключение, что модель (3) наиболее адекватно описывает вклады пигментов в спектр поглощения, в то время как модель (2) оперирует меньшим количеством параметров, что значительно упрощает их программный расчёт.
Работа выполнена в рамках Госзадания ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН», № гос. регистрации 121030300149-0. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Поступила в редакцию 05.05.2023
Об авторах Чернышев Дмитрий Николаевич – Dmitriy N. Chernyshev заведующий лабораторией, Севастопольский государственный университет, Севастополь, Россия (Sevastopol State University, Sevastopol, Russia); кафедра «Физика» chernishevd@gmail.com Клочкова Виктория Сергеевна – Viktoriya S. Klochkova студент, Севастопольский государственный университет, Севастополь, Россия (Sevastopol State University, Sevastopol, Russia); кафедра «Физика» viki-iki@mail.ru Лелеков Александр Сергеевич – Alexander S. Lelekov кандидат биологических наук a.lelekov@yandex.ru Корреспондентский адрес: Россия, 299011, г. Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ РАН; тел. +7 (869)255-07-95.
ССЫЛКА: Чернышев Д.Н., Клочкова В.С., Лелеков А.С. Моделирование спектра поглощения культуры Phaeodactylum tricornutum Bohlin в красной области // Вопросы современной альгологии. 2023. №1 (31). С. 19–27. URL: http://algology.ru/2019 DOI – https://doi.org/10.33624/2311-0147-2023-1(31)-19-27 EDN – UMEQDS При перепечатке ссылка на сайт обязательна Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Modeling of the absorption spectrum of Phaeodactylum tricornutum Bohlin in the red area Dmitriy N. Chernyshev1, Viktoria S. Klochkova1, Alexander S. Lelekov2 1Sevastopol State University (Sevastopol, Russia)
Key words: microalgae; absorption spectra; chlorophyll a; chlorophyll c; mathematical modeling; Gaussian curves
References
Authors Chernyshev Dmitriy N. ORCID – https://orcid.org/0000-0002-8120-7382 Sevastopol State University, Sevastopol, Russia chernishevd@gmail.com Klochkova Viktoriya S. ORCID – https://orcid.org/0000-0002-2120-9589 Sevastopol State University, Sevastopol, Russia viki-iki@mail.ru Lelekov Alexander S. ORCID – https://orcid.org/0000-0002-3876-3455 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia a.lelekov@yandex.ru
ARTICLE LINK: Chernyshev D.N., Klochkova V.S., Lelekov A.S. Modeling of the absorption spectrum of Phaeodactylum tricornutum Bohlin in the red area. Voprosy sovremennoi algologii (Issues of modern algology). 2023. № 1 (31). P. 19–27. URL: http://algology.ru/2019 DOI – https://doi.org/10.33624/2311-0147-2023-1(31)-19-27 EDN – UMEQDS When reprinting a link to the site is required Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||