 |
№ 1 (34) 2024
Физиология и биохимия водорослей
Эмиссия оксида диазота микроводорослями (краткий обзор)
Nitrous oxide emissions by microalgae (mini review)
Тренкеншу Р.П.
Rudolf P. Trenkenshu
Федеральный исследовательский центр
«Институт биологии южных морей имени А.О.Ковалевского РАН»
(Севастополь, Россия)
УДК 581.1:57.032:57.033
В статье представлен краткий обзор зарубежной литературы о потенциальной генерации микроводорослями оксида диазота, который является парниковым газом, играющим существенную роль в разрушении озонового слоя Земли и изменении климата на планете. Анализ литературы показывает, что свойством эмиссии оксида диазота обладают практически все классы микроводорослей. Вместе с этим не удалось обнаружить данных об изучении этого явления на территории России и русскоязычных публикаций на эту тему.
Ключевые слова: микроводоросли; азотное питание; культивирование; озоновый слой; оксид диазота
Азот является важнейшим биогенным элементом, определяющим рост фитопланктона в природных водоемах и системах лабораторного или промышленного культивирования микроводорослей. Основным источником азота для микроводорослей являются растворенные в среде различные органические или минеральные соединения азота. К наиболее изученным формам азотных соединений, участвующих в метаболических реакциях клеток, относятся аминокислоты, аммоний и мочевина. Практически отсутствуют сведения о возможном использовании оксидов азота в минеральном питании микроводорослей, но имеются литературные данные об участии микроводорослей в эмиссии оксидов азота (Teuma et al., 2023).
Оксиды азота могут быть представлены в различных формах:

В экологическом отношении интерес представляет форма оксида диазота N2O (оксид азота (1), закись азота, веселящий газ). Это связано с тем, что оксид диазота является парниковым газом, разрушающим озоновый слой Земли (Ямшанов, 1989; Ravishankara et al., 2009).
В течение около двух тысячелетий наблюдалась относительно стабильная концентрация оксида диазота в атмосфере, но в последнее столетие наметился резкий рост концентрации (рис. 1).
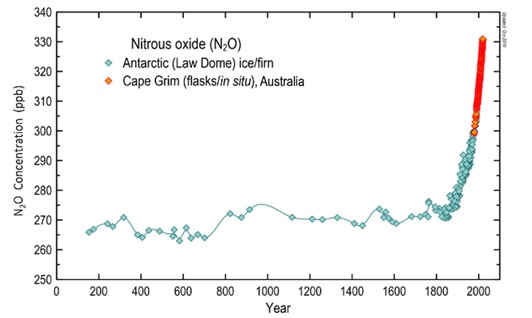
Рис. 1. Концентрация закиси азота в атмосфере за 2000 лет. Наблюдения, сделанные в атмосфере и из кернов льда (Источник: BoM / CSIRO / AAD).
Fig. 1. Concentration of nitrous oxide in the atmosphere over 2000 years.
Observations made in the atmosphere and from ice kern (Source: BoM / CSIRO / AAD).
Этот рост исследователи связывают с повышением антропогенной деятельности, в первую очередь, из-за значительного увеличения сельском хозяйстве азотных удобрений, которые смываются в водоемы (Tian et al., 2020). Это приводит к их эвтрофированию, массовому цветению и, соответственно, повышению эмиссии N₂O эвтрофными водоемами, включая эстуарии рек (Law et al., 1993; Teuma et al., 2023), очистные сооружения (Kampschreur et al., 2009) и системы массового культивирования микроводорослей (Batan et al., 2010; Fagerstone et al., 2011). Природными источниками эмиссии N₂O в атмосферу являются также микробиологические процессы в почвах (Кузнецова, Соловьева, 2015). Водоросли рассматриваются как источник или поглотитель закиси азота (Jun et al., 2023). Тем не менее роль оксидов азота в метаболизме микроводорослей изучена слабо.
Анализируя литературные источники по вопросам эмиссии оксида диазота в озерных и морских водоемах можно обратить внимание на отсутствие системных исследований этой проблемы в России, что проявляется в отсутствии публикаций на русском языке. Особенно это касается микроводорослей.
Целью предлагаемой статьи является привлечение внимания российских исследователей путем краткого обзора немногочисленных работ зарубежных авторов по этой важнейшей проблеме.
Впервые выделение оксида диазота лабораторными культурами микроводорослей было экспериментально обнаружено при использовании питательных сред с нитритной формой азотного питания (Weathers, 1984). Опыты проводились с четырьмя видами зеленых микроводорослей: Chlorella, Scenedesmus, Coelastrum и Chlorococcum spp. Особенностью исследований явилось использование аксенических культур. Параллельно производился абиотический контроль, что исключало другие возможные источники эмиссии N2O в опытах. Автором была сделана количественная оценка удельной продукции оксида диазота и его выделения в окружающую среду единицей биомассы (выраженной в сухом весе), которая увеличивалась в течение первых 20 часов после инкубирования клеток в нитритную среду (рис. 2).
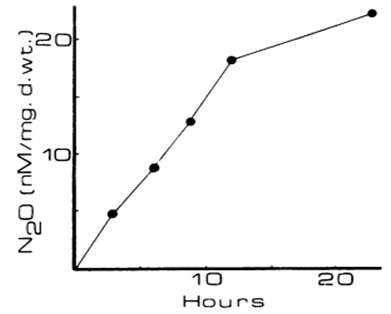
Рис. 2. Эмиссия N2O от Chlorella vulgaris. Газ в свободном пространстве был измерен
с помощью колонки Porapak Q в газовом хроматографе (Weathers, 1984).
Fig. 2. N2O emission from Chlorella vulgaris. Headspace gas was measured with a Porapak Q column
in a gas chromatograph with a thermal conductivity detector (Weathers, 1984).
Водоросли вырабатывали азот в форме N2O и аммиака с выходом 3% и 21% от доступного нитритного азота, соответственно. В случае нитратной среды выделения заметных количеств закиси азота не было обнаружено.
На основании полученных результатов автор предложила обязательно учитывать роль микроводорослей в эмиссии этого парникового газа при оценке его влияния на озоновый слой Земли.
После обнаружения факта эмиссии оксида диазота зелеными микроводорослями закономерно встал вопрос о том, все ли классы микроводорослей обладают этим эффектом. При дальнейших исследованиях оказалось, что сине-зеленые микроводоросли Nostoc spp., Aphanocapsa (PCC 6308) и Aphanocapsa (PCC 6714), но не Anacystis nidulans R-2 (PCC 7942), производят N2O и аммиак при выращивании на нитрите (Weathers, Niedzielski, 1986). Авторы полагают, что цианобактерии продуцируют N2O путем восстановления нитрита до аммиака, но эффект практически не наблюдался при азотном питании в виде нитратов или аммония. Процесс стимулировался глюкозой, но был безразличен как к присутствию ацетилена, так и к кислороду, вырабатываемому фотосинтетическим путем. Суммарный объем выделившейся закиси азота в культуральную среду инкубированных клеток Aphanocapsa (6714) и газовую фазу составил 14,8% от доступного нитритного азота (35 микромоль). Этот показатель значительно выше, чем у зеленых микроводорослей (2,9%) в аналогичных условиях (Weathers, 1984).
В работе (Fagerstone et al., 2011) приведены экспериментальные данные о выделении закиси азота системами культивирования микроводоросли Nannochloropsis salina (класс Eustigmatophyceae). Авторы обнаружили, что при высоких концентрациях нитратного азота в среде и освещении культуры эмиссия оксида диазота ниже, чем в аналогичных, но темновых условиях. В результате было показано, что продукция N2O была индуцирована бескислородными условиями в присутствии нитратов, что позволило авторам предположить, что N2O продуцировался денитрифицирующими бактериями в культуре. Наличие денитрифицирующих бактерий было подтверждено с помощью специальных тестов. После лечения антибиотиками оказалось, что аксенические культуры Nannochloropsis salina также выделяют оксид диазота в темноте, но в существенно меньшем количестве.
Участие диатомовых водорослей в эмиссии оксида диазота было показано на примере микроводоросли Staurosira sp., выращиваемой в промышленных масштабах на Гавайях (Ferrón et al., 2012). Схема и размерные характеристики культиватора, используемого для измерений N2O, показаны на рис. 3.
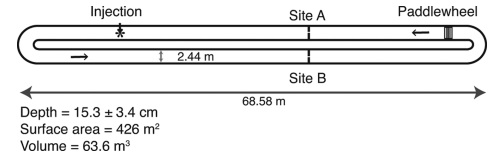
Рис. 3. Принципиальная схема, показывающая размеры пруда и расположение мест закачки и отбора проб. Черные стрелки указывают направление потока движения культуры
(Ferrón et al., 2012).
Fig. 3. Schematic diagram showing the dimensions of the raceway pond and the location of the injection and sampling sites. Black arrows indicate the flow direction of culture (Ferrón et al., 2012).
Концентрации растворенных O2, CH4 и N2O измеряли в течение 24-часового цикла. За это время было проведено четыре эксперимента для количественной оценки скоростей газопереноса в прудах, и они затем использовались для расчета потоков воздух–вода. Результаты экспериментов показаны на рис. 4.
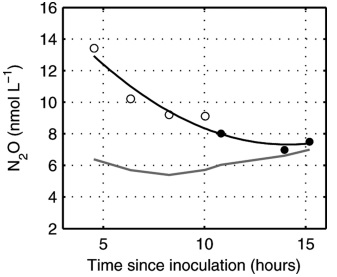
Рис. 4. Выделение растворенного N2O в течение первых 15 ч работы пруда, когда пруд был источником выделения N2O в атмосферу. Светлые кружочки взяты из образцов, взятых в другой прудовой культуре на более ранней стадии эксплуатации пруда. Темно-серая линия обозначает растворимость N2O. Черная линия представляет собой полиномиальную аппроксимацию второго порядка (y = –0,0001x2 + 0,0948x – 2,7668, R2 = 0,745) (Ferrón et al., 2012).
Fig. 4. Dissolved N2O evolution during the first 15 h of pond operation, when the pond was a source of N2O to the atmosphere. The open circles are from samples taken in a different pond culture at an earlier stage of pond operation. Dark-gray line represents N2O solubility. Black line represents a second order polynomial fit (y = −0.0001x2 + 0.0948x − 2.7668, R2 = 0.745) (Ferrón et al., 2012).
Более углубленно эмиссия оксида диазота эукариотическими микроводорослями была изучена и представлена в работе (Guieysse et al., 2013). Используя антибиотики и геномный анализ, авторы показали, что закись азота образуется из аксенических культур Chlorella vulgaris. Сравнительная оценка результатов измерения скорости выделения оксида диазота на свету и в темноте при различных источниках азотного питания показана на рис. 5.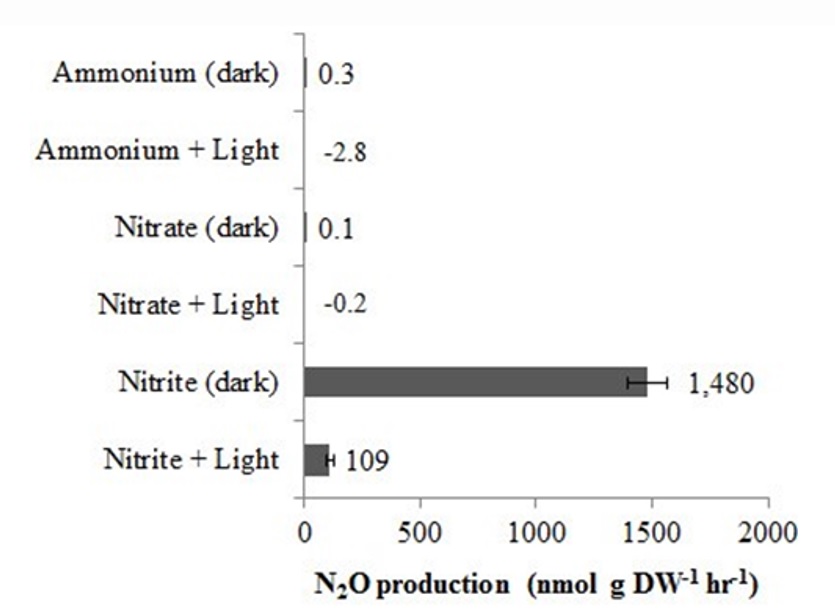
Рис. 5. Влияние источника азота и освещенности на удельную продукцию N2O C. vulgaris
(0,22 г АСВ−1 л−1). Показанные скорости представляют собой средние значения дубликатов ± погрешность и были определены между 2,9 и 21,5 ч после добавления азота (12 мкМ) (Guieysse et al., 2013).
Fig. 5. Influence of nitrogen source and illumination on N2O specific production by C. vulgaris (0.22 g DW−1·L−1). The rates shown represent averages from duplicates ± error and were deter-mined between 2.9 and 21.5 h after nitrogen addition (12 mM) (Guieysse et al., 2013).
На рис. 6 показаны результаты изучения зависимости скорости эмиссии закиси азота при различных величинах концентрации нитритной формы азотного питания в среде и плотности культуры (выражена в абсолютно сухом весе, АСВ).
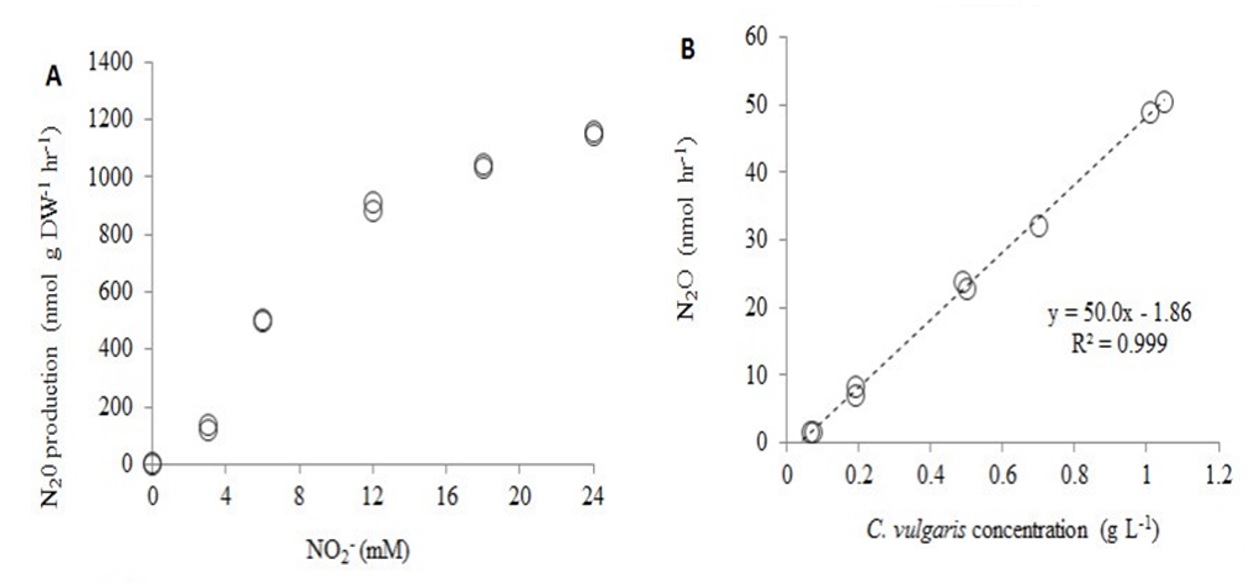
Рис. 6. Влияние концентрации нитритов (А) и концентрации C. vulgaris (В) на удельную скорость выделения N2O из культур C. vulgaris, инкубированных в темноте (n = 2). При варьировании концентрации нитритов концентрация C. vulgaris составляла 0,58 гл−1, при варьировании концентрации водорослей концентрация нитритов составляла 12 мМ. Показатели представляют собой данные дубликатов (т.е. не средние) и были определены между 1,5 и 3,5 ч после добавления нитритов (12 мМ) (Guieysse et al., 2013).
Fig. 6. Influence of nitrite concentration (A) and C. vulgaris concentration (B) on N2O specific production from C. vulgaris cultures incubated in darkness (n = 2). When nitrite concentration was varied, C. vulgaris concentration was 0.58 gL−1, when algae concentration was varied, nitrite concentration was 12 mM. The rates shown represent data from duplicates (e.g. not the average) and were determined between 1.5 and 3.5 h after nitrite addition (12 mM) (Guieysse et al., 2013).
Авторами было показано, что продукция парникового газа хлореллой усиливается в условиях, благоприятствующих внутриклеточному накоплению нитритов, но подавляется при ингибировании активности нитратредуктазы (NR). Эти наблюдения позволили предположить, что образование N2O у хлореллы может происходить через NR-опосредованное восстановление нитрита в оксид азота (NO), действующий как предшественник N2O, через путь, аналогичный образованию N2O в бактериальных денитрификаторах, хотя восстановление NO до N2O в присутствии кислорода оставалось недоказанным в растительных клетках. В качестве альтернативного пути авторы предположили возможность NR восстанавливать нитриты до нитроксила (HNO), который, как известно, димеризуется до N2O под действием кислорода.
Независимо от рассматриваемого прекурсора, NR-опосредованный путь восстановления нитритов обеспечивает унифицированное объяснение сообщаемых корреляций между выбросами N2O из экосистем на основе водорослей и активностью NR, концентрацией нитратов, концентрацией нитритов и фотосинтезом. Более того, эти результаты указывают на то, что, образование N2O опосредованное микроводорослями, может вносить значительный вклад в эмиссию оксида диазота в экосистемах, основанных на водорослях. По мнению авторов, эти результаты имеют глубокое значение для биотехнологии водорослей и понимания глобального биогеохимического круговорота азота.
На основании анализа литературных и экспериментальных данных предложена гипотетическая схема механизма генерации оксида диазота из нитрата и нитрита в растительных клетках при аноксии и гипоксии (Timilsina et al., 2020). Эта схема представлена на рис. 7.
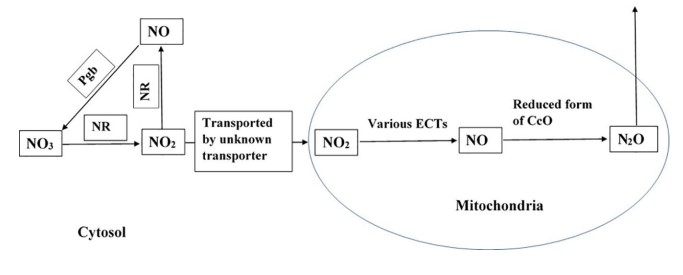
Рис. 7. Потенциальный путь образования N2O в растительных клетках. NR – нитратредуктаза,
Pgb – фитоглобин. Этот путь активен в присутствии NO3 и NO2, а также при гипоксии и аноксии растений (Timilsina et al., 2020).
Fig. 7. Potential pathway of N2O formation in plant cells. NR is nitrate reductase, Pgb is phytoglobin. The pathway is active in presence of NO3 and NO2, and when plants experience hypoxia and anoxia
(Timilsina et al., 2020).
К настоящему времени список видов микроводорослей, генерирующих оксид диазота, значительно расширен и представлен практически всеми классами микроводорослей: Chlorella vulgaris, C. rubescens, C. variabilis, Coelastrum sp., Chlorococcum vacuolarum, Neochloris sp., Scenedesmus dimorphus, S. obliquus, Chlamydomonas reinhardtii, Coccomyxa subellipsoidea, Tetraselmis subcordiformi, Nannochloropsis oculate, Skeletonema marinoi, Thalassiosira weissflogii, Staurosira sp., Aphanocapsa 6308, Aphanocapsa 6714, Nostoc sp., Microcystis aeruginosa (Bellido-Pedraza et al., 2022; Teuma et al., 2023; Jun et al., 2024). Отметим, что этим свойством обладают как пресноводные, так и морские виды.
Заключение
Анализ литературы показывает, что свойством эмиссии оксида диазота обладают практически все классы микроводорослей Chlorella vulgaris, C. rubescens, C. variabilis, Coelastrum sp., Chlorococcum vacuolarum, Neochloris sp., Scenedesmus dimorphus, S. obliquus, Chlamydomonas reinhardtii, Coccomyxa subellipsoidea, Tetraselmis subcordiformi, Nannochloropsis oculate, Skeletonema marinoi, Thalassiosira weissflogii, Staurosira sp., Aphanocapsa 6308, Aphanocapsa 6714, Nostoc sp., Microcystis aeruginosa (Bellido-Pedraza et al., 2022, Teuma et al., 2023, Jun et al., 2024). Этим свойством обладают как пресноводные, так и морские виды.
Представленный краткий обзор зарубежной литературы о потенциальной генерации микроводорослями оксида диазота иллюстрирует, что это явление вызывает серьезный интерес у иностранных ученых. Это связано с тем, что оксид диазота является парниковым газом, играющим существенную роль в разрушении озонового слоя Земли и изменении климата на планете. Вместе с этим не удалось обнаружить данных об изучении этого явления на территории России и русскоязычных публикаций на эту тему.
Работа выполнена в рамках госзадания ФИЦ «Институт биологии южных морей им. А.О. Ковалевского РАН» по теме «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации АААА-А18-118021350003-6).
Автор заявляет об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
- Кузнецова В.Л., Соловьева А.Г. Оксид азота: свойства, биологическая роль, механизмы действия // Современные проблемы науки и образования. 2015. №4. https://science-education.ru/ru/article/view?id=21037 (дата обращения: 25.11.2023).
- Ямшанов В.А. Нитрозосоединения в окружающей среде – угроза озоновому слою // Докл. АН СССР. 1989. Т.309. С.659-662.
- Batan L., Quinn J., Willson B., Bradley T. Environ Net energy and greenhouse gas emission evaluation of biodiesel derived from microalgae // Sci Technol. 2010. 44(20). P. 7975-7980. DOI: https://doi.org/10.1021/es102052y. PMID: 20866061
- Bellido-Pedraza C.M., Calatrava V., Llamas A., Fernandez E., Sanz-Luque E., Galvan A. Nitrous oxide emissions from nitrite are highly dependent on nitrate reductase in the microalga Chlamydomonas reinhardtii // Int J Mol Sci. 2022. V.23(16). ID 9412. DOI: https://doi.org/10.3390/ijms23169412
- Fagerstone K.D., Quinn J.C, Bradley T.H., De Long S.K, Marchese A.J. Quantitative measurement of direct nitrous oxide emissions from microalgae cultivation// Environ Sci Technol. 2011. V. 45(21). P. 9449-9456. DOI: https://doi.org/10.1021/es202573f
- Ferrón S., Ho D.T., Johnson Z.I., Huntley M.E. Environ Air-water fluxes of N₂O and CH₄ during microalgae (Staurosira sp.) cultivation in an open raceway pond // Sci Technol. 2012. V.46(19). P. 10842–10848. DOI: https://doi.org/10.1021/es302396j. Epub 2012 Sep 11. PMID: 22920714
- Guieysse B., Plouviez M., Coilhac M., Cazali L. Nitrous Oxide (N2O) production in axenic Chlorella vulgaris microalgae cultures: evidence, putative pathways, and potential environmental impacts // Biogeosciences. 2013. V.10. P. 6737–6746. DOI: https://doi.org/10.5194/bg-10-6737-2013
- Jun S.U.N., Ting G.U., Dai J.I.A., Yang F.U. Algae as a new source or sink of Nitrous Oxide // Advances in Earth Science. 2024. V.39(1). P. 12–22. DOI: https://doi.org/10.11867/j.
- Kampschreur M.J., Temmink H., Kleerebezem R., Jetten M.S., van Loosdrecht M.C. Nitrous oxide emission during wastewater treatment // Water Res. 2009. V.43(17). P. 4093-4103. DOI: https://doi.org/10.1016/j.watres.2009.03.001
- Law S., Rees A.P., Owens N.J.P. Nitrous oxide production by estuarine epiphyton // J. Limnology and Oceanography. 1993. V.38(2). P. 435–441. DOI: http://doi.wiley.com/10.4319/lo.1993.38.2.0435
- Ravishankara A.R., Daniel J S., Portmann R.W. Nitrous oxide (N2O): The dominant ozone-depleting substance emitted in the 21st century // Science. 2009. V.326. P. 123–125. DOI: https://doi.org/10.1126/science.1176985
- Teuma L., Sanz-Luque E., Guieysse B., Plouviez M. Are Microalgae New Players in Nitrous Oxide Emissions from Eutrophic Aquatic Environments? // Phycology. 2023. V. 3. P. 356–367. DOI: https://doi.org/10.3390/phycology3030023
- Tian H, Xu R., Canadell J.G., Thompson R.L, Winiwarter W., P. Suntharalingam, Davidson E.A., Ciais P., Jackson R.B., Janssens-Maenhout G., Prather M.J., Regnier P., Pan N. Pan S., Peters G.P., Shi H., Tubiello F.N., Zaehle S., Zhou F., Arneth A., Battaglia G., Berthet S., Bopp L, Bouwman A.F., Buitenhuis E.T., Chang J., Chipperfield M.P., Dangal S.R.S., Dlugokencky E., Elkins J.W., Eyre B.D., Fu B., Hall B., Ito A., Joos F., Krummel P.B., Landolfi A., Laruelle G.G., Lauerwald R,, Li W., Lienert S., Maavara T., MacLeod M., Millet D.B., Olin S., Patra P.K., Prinn R.G., Raymond P.A., Ruiz D.J., van der Werf G.R., Vuichard N., Wang J., Weiss R.F., Wells K.C., Wilson C., Yang J., Yao Y.A Comprehensive quantification of global nitrous oxide sources and sinks // Nature. 2020. 586(7828). P. 248–256. DOI: https://doi.org/10.1038/s41586-020-2780-0
- Timilsina A., Zhang C., Pandey B., Bizimana F., Dong W., Hu C. Potential Pathway of Nitrous Oxide Formation in Plants // Front. Plant Sci. 2020. V.11. ID 1177. DOI: https://doi.org/10.3389/fpls.2020.01177
- Weathers P. N2O Evolution by Green Algae // Appl. Environ. Microbiol. 1984. V.48. P. 1251–1253. DOI: https://doi.org/10.1128/aem.48.6.1251-1253.1984
- Weathers P.J.; Niedzielski J.J. Nitrous Oxide Production by Cyanobacteria // Arch. Microbiol. 1986. V.146. P. 204–206. DOI: https://doi.org/10.1007/BF00402352
Статья поступила в редакцию 27.02.2024
Статья поступила после доработки 24.06.2024
Статья принята к публикации 01.07.2024
Об авторе
Тренкеншу Рудольф Павлович – Trenkenshu Rudolf P.
кандидат биологических наук
ведущий научный сотрудник, заведующий Отделом биотехнологий и фиторесурсов, Федеральный исследовательский центр «Институт биологии южных морей им. А.О.Ковалевского РАН» (ФИЦ ИнБЮМ РАН), г. Севастополь, Россия (Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia)
r.trenkenshu@rambler.ru
Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИНБЮМ РАН; тел. (8692)-55-07-95.
ССЫЛКА НА СТАТЬЮ:
Тренкеншу Р.П. Эмиссия оксида диазота микроводорослями (краткий обзор) // Вопросы современной альгологии. 2024. №1 (24). С. 1–9. URL: http://algology.ru/2099
DOI - https://doi.org/10.33624/2311-0147-2024-1(34)-1-9; END – RFBMVF
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Адрес - info@algology.ru
При перепечатке ссылка на сайт обязательна
.
Nitrous oxide emissions by microalgae (mini review)
Rudolf P. Trenkenshu
Kovalevsky Institute of Biology of the Southern Seas RAS (Sevastopol, Russia)
The article provides a brief overview of foreign literature on the potential generation of diazote oxide by microalgae, which is a greenhouse gas that plays a significant role in the destruction of the Earth's ozone layer and climate change on the planet. An analysis of the literature shows that almost all classes of microalgae possess the diazote oxide emission property. At the same time, it was not possible to find data on the study of this phenomenon in Russia and Russian-language publications on this topic.
Key words: microalgae; nitrogen nutrition; cultivation; ozone layer; dinitrogen oxide
References
- Batan L., Quinn J., Willson B., Bradley T. Environ Net energy and greenhouse gas emission evaluation of biodiesel derived from microalgae. Sci Technol. 2010. 44(20). P. 7975-7980. DOI: https://doi.org/10.1021/es102052y. PMID: 20866061
- Bellido-Pedraza C.M., Calatrava V., Llamas A., Fernandez E., Sanz-Luque E., Galvan A. Nitrous oxide emissions from nitrite are highly dependent on nitrate reductase in the microalga Chlamydomonas reinhardtii. Int J Mol Sci. 2022. V.23(16). ID 9412. DOI: https://doi.org/10.3390/ijms23169412
- Fagerstone K.D., Quinn J.C, Bradley T.H., De Long S.K, Marchese A.J. Quantitative measurement of direct nitrous oxide emissions from microalgae cultivation. Environ Sci Technol. 2011. V. 45(21). P. 9449-9456. DOI: https://doi.org/10.1021/es202573f
- Ferrón S., Ho D.T., Johnson Z.I., Huntley M.E. Environ Air-water fluxes of N₂O and CH₄ during microalgae (Staurosira sp.) cultivation in an open raceway pond. Sci Technol. 2012. V.46(19). P. 10842–10848. DOI: https://doi.org/10.1021/es302396j. Epub 2012 Sep 11. PMID: 22920714
- Guieysse B., Plouviez M., Coilhac M., Cazali L. Nitrous Oxide (N2O) production in axenic Chlorella vulgaris microalgae cultures: evidence, putative pathways, and potential environmental impacts. Biogeosciences. 2013. V.10. P. 6737–6746. DOI: https://doi.org/10.5194/bg-10-6737-2013
- Jun S.U.N., Ting G.U., Dai J.I.A., Yang F.U. Algae as a new source or sink of Nitrous Oxide. Advances in Earth Science. 2024. V.39(1). P. 12–22. DOI: https://doi.org/10.11867/j.issn.1001-8166.2023.073
- Kampschreur M.J., Temmink H., Kleerebezem R., Jetten M.S., van Loosdrecht M.C. Nitrous oxide emission during wastewater treatment. Water Res. 2009. V.43(17). P. 4093-4103. DOI: https://doi.org/10.1016/j.watres.2009.03.001
- Kuznecova V.L., Solov'eva A.G. Oksid azota: svojstva, biologicheskaya rol', mekhanizmy dejstviya [Nitric oxide: properties, biological role, mechanisms of action]. Sovremennye problemy nauki i obrazovaniya. 2015. №4. https://science-education.ru/ru/article/view?id=21037 (date: 25.11.2023) (in Russ.)
- Law S., Rees A.P., Owens N.J.P. Nitrous oxide production by estuarine epiphyton. J. Limnology and Oceanography. 1993. V.38(2). P. 435–441. DOI: http://doi.wiley.com/10.4319/lo.1993.38.2.0435
- Ravishankara A.R., Daniel J S., Portmann R.W. Nitrous oxide (N2O): The dominant ozone-depleting substance emitted in the 21st century. Science. 2009. V.326. P. 123–125. DOI: https://doi.org/10.1126/science.1176985
- Teuma L., Sanz-Luque E., Guieysse B., louviez M. Are Microalgae New Players in Nitrous Oxide Emissions from Eutrophic Aquatic Environments? Phycology. 2023. V. 3. P. 356–367. https://doi.org/10.3390/phycology3030023
- Tian H, Xu R., Canadell J.G., Thompson R.L, Winiwarter W., P. Suntharalingam, Davidson E.A., Ciais P., Jackson R.B., Janssens-Maenhout G., Prather M.J., Regnier P., Pan N. Pan S., Peters G.P., Shi H., Tubiello F.N., Zaehle S., Zhou F., Arneth A., Battaglia G., Berthet S., Bopp L, Bouwman A.F., Buitenhuis E.T., Chang J., Chipperfield M.P., Dangal S.R.S., Dlugokencky E., Elkins J.W., Eyre B.D., Fu B., Hall B., Ito A., Joos F., Krummel P.B., Landolfi A., Laruelle G.G., Lauerwald R,, Li W., Lienert S., Maavara T., MacLeod M., Millet D.B., Olin S., Patra P.K., Prinn R.G., Raymond P.A., Ruiz D.J., van der Werf G.R., Vuichard N., Wang J., Weiss R.F., Wells K.C., Wilson C., Yang J., Yao Y.A Comprehensive quantification of global nitrous oxide sources and sinks. Nature. 2020. 586(7828). P. 248–256. DOI: 10.1038/s41586-020-2780-0
- Timilsina A., Zhang C., Pandey B., Bizimana F., Dong W., Hu C. Potential Pathway of Nitrous Oxide Formation in Plants. Front. Plant Sci. 2020. V.11. ID 1177. DOI: https://doi.org/10.3389/fpls.2020.01177
- Weathers P. N2O Evolution by Green Algae. Appl. Environ. Microbiol. 1984. V.48. P. 1251–1253. DOI: https://doi.org/10.1128/aem.48.6.1251-1253.1984
- Weathers P.J., Niedzielski J.J. Nitrous Oxide Production by Cyanobacteria. Arch. Microbiol. 1986. V.146. P. 204–206. DOI: https://doi.org/10.1007/BF00402352
- Yamshanov V.A. Nitrozosoedineniya v okruzhayushchej srede – ugroza ozonovomu sloyu [Nitroso compounds in the environment are a threat to the ozone layer [Nitroso compounds in the environment are a threat to the ozone layer]. Dokl. AN SSSR. 1989. T.309. P. 659–662. (in Russ.)
Author
Trenkenshu Rudolf P.
Orcid ID – https://orcid.org/0000-0003-3727-303X
Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia
r.trenkenshu@rambler.ru
ARTICLE LINK:
Trenkenshu R.P. Nitrous oxide emissions by microalgae (mini review).Voprosy sovremennoi algologii (Issues of modern algology). 2024. № 1 (34). P. 1–9. URL: http://algology.ru/2099
DOI - https://doi.org/10.33624/2311-0147-2024-1(34)-1-9; END – RFBMVF
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
Address - info@algology.ru
When reprinting a link to the site is required
На ГЛАВНУЮ
Карта сайта
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
 |
|

