|
|
|
Пути биосинтеза, локализация, метаболизм и функции каротиноидов в хлоропластах различных видов водорослей
Ладыгин В.Г. Vladimir G. Ladygin
Институт фундаментальных проблем биологии РАН
УДК 575.24:577.124:581.174.1
Рассмотрены современные представления о биосинтезе каротиноидов эукариот, как общие для высших растений и зеленых водорослей, так и специфические характерные для различных систематических групп водорослей. Описаны все гены и ферменты, участвующие на каждом этапе процесса биосинтеза каротиноидов, а также локализация мультиферментных комплексов в мембранах хлоропластов. Детально обсуждаются метаболизм и основные функции наиболее важных ксантофиллов: 1 – светособирающая, 2 – структурная и 3 – фотозащитная. Особое внимание уделено описанию механизмов фотозащиты, в том числе с участием специфических каротиноидов: 1 – виолаксантинового, 2 – лютеин-5,6-эпоксидного и 3 – диадиноксантинового циклов. Первый из них является характерным для большинства эукариот, а второй и третий встречаются только у отдельных групп водорослей. Рассмотрено участие каротиноидов в фототаксисе одноклеточных зеленых водорослей. Показано, что их светочувствительная органелла – глазное пятно содержит каротины. Причем, с помощью мутантов хламидомонады впервые удалось доказать возможность изменения состава каротинов в глобулах глазного пятна путем мутагенеза. Ключевые слова: водоросли; хлоропласты эукариот; каротиноиды; биосинтез каротинов и ксантофиллов; генетический контроль; локализация; светособирающая функция каротиноидов; фотозащитная функция каротиноидов; структурная функция каротиноидов; ксантофилловые циклы; виолаксантиновый цикл; лютеин-5,6-эпоксидный цикл; диадиноксантиновый цикл; глазное пятно; фототаксис.
Введение Из всех классов природных пигментов каротиноиды наиболее широко распространены в природе и, несомненно, принадлежат к числу очень важных соединений. Они обнаружены у всех представителей растительного царства как в фотосинтезирующих, так и в нефотосинтезирущих тканях. Эти пигменты часто встречаются у бактерий, грибов и в клетках многих животных, обусловливая их окраску, особенно птиц, рыб, ракообразных и насекомых. Каротиноиды и их производные имеют большое значение как для растений и водорослей, участвуя в организации и функционировании фотосинтетических мембран, так и для животных, являясь основой зрительных пигментов, ответственных за восприятие света и различение цветов. Они (особенно β-каротин) – ценный биотехнологический продукт, используемый в медицине, сельском хозяйстве, а также в пищевой, косметической и парфюмерной промышленности в качестве физиологически активных соединений, природных красителей и источника витаминов. Сейчас известно огромное разнообразие каротиноидов. Так, β-каротин содержится у бактерий, грибов и всех фотосинтезирующих организмов (Карнаухов, 2000), в то время как α-каротин и производные от него ксантофиллы синтезируются только в хлоропластах зеленых водорослей и высших растений, имеющих две фотосистемы (Emenhiser et al., 1996). Поэтому возникает большой интерес как к процессу биосинтеза этих соединений и генетическому контролю отдельных его этапов, так и к специфике их локализации и возможной функциональной роли в фотосинтетических мембранах. До сих пор таких сведений очень мало (Britton, 1998). В этой работе мы рассмотрим пути биосинтеза различных каротиноидов хлоропластов и участие в этом процессе ферментов, контролируемых различными генами. По химическому строению все известные каротиноиды можно разделить на соединения с открытой целью – ациклические, и соединения, содержащие на одном или обоих концах молекулы циклогексановые (иононовые) или циклопентановые кольца, – циклические. Как ациклические, так и циклические каротиноиды, молекулы которых имеют чисто углеводородное строение (например, С40Н56 – ликопин, α-, ε- и β-каротин), называются каротинами. Все кислородсодержащие каротиноиды (например, С40Н56O2 – зеаксантин, лютеин, лактукаксантин и др.) называются ксантофиллами. Атомы кислорода могут входить в состав молекул ксантофиллов в виде гидроксильной, карбонильной, кето-(оксо-), эпоксидной и других групп и выполнять в них различную функцию (Yamamoto, Bassi, 1996; Ладыгин, 2002).
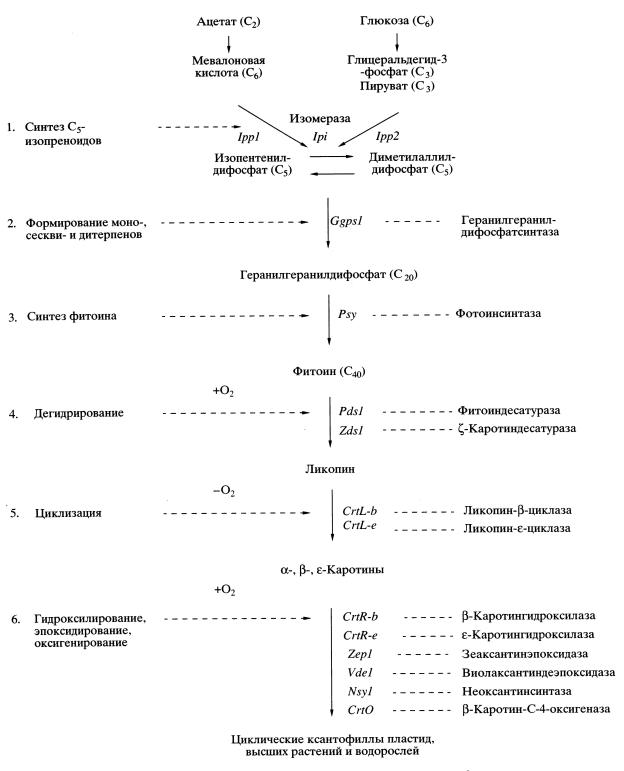
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ И ПУТИ БИОСИНТЕЗА КАРОТИНОИДОВ Биосинтез каротинов Синтез каротиноидов является сложным биологическим процессом. Он осуществляется в клетках бактерий, грибов, водорослей и высших растений и протекает с участием различных энзиматических систем, контролируемых многими генами (Cunningham, Gantt, 1998, 2001). Весь процесс биосинтеза условно можно разделить на несколько наиболее важных этапов (рис. 1): 1 – ранние этапы биосинтеза С5-изопреновых единиц изопентенилдифосфата; 2 – формирование моно- (С10), сескви- (С15) и дитерпенов (С20); 3 – синтез тетратерпена – фитоина (С40); 4 – дегидрирование (десатурация) фитоина до фитофлуина, ζ-каротина, нейроспорина и ликопина; 5 – циклизация и образование α-, β- и ε-каротинов; 6 – гидроксилирование, оксигенирование и эпоксидирование каротинов и формирование циклических ксантофиллов пластид водорослей и высших растений.
Рис. 1. Общая схема цепи биосинтеза каротиноидов в хлоропластах эукариот.
Традиционно в научной литературе и в этой статье мы использовали тривиальные названия каротиноидов, данные им в процессе первой идентификации и описания, как правило, с учетом объекта, из которого они впервые выделены. Они удобнее и менее громоздки, хотя и не отражают их химическую структуру. Химическую номенклатуру IUPAC (Weddon, Moss, 1995) мы использовали там, где было необходимо показать различия в химической структуре и формировании концевых групп. 1. Два пути биосинтеза изопентенилдифосфата Долгое время считали, что ацетат и мевалоновая кислота являются единственными предшественниками в биосинтезе всех изопреноидов, в том числе и каротиноидов (Пасешниченко, 1998). Однако недавно получены принципиально новые данные, предполагающие возможность существования двух альтернативных путей биосинтеза ключевых С5-изопреноидов (Lichtenthaler et al., 1997). Такими ключевыми С5-соединениями в биосинтезе всех терпеноидов, в том числе и каротиноидов, являются изопентенилдифосфат и диметилаллилдифосфат (рис. 1). Предполагается, что эти вещества в клетках высших растений и водорослей могут синтезироваться как в цитоплазме из ацетата (ацетатно-мевалонатный путь) и использоваться при формировании стеролов (Britton, 1998), так и в хлоропластах из глюкозы (глицеральдегид-3-фосфат-пируватный путь), являясь предшественниками каротиноидов (Lichtenthaler et al., 1997; Пасешниченко, 1998). В результате конденсации изопентенилдифосфата (С5) и диметилаллилдифосфата (С5) образуется монотерпен геранилдифосфат (С10). Эта реакция катализируется ферментом геранилгеранилдифосфатсинтазой. Он же катализирует дальнейшее последовательное присоединение еще двух молекул изопентенилдифосфата с образованием вначале фарнезилдифосфата (С15), а затем дитерпена геранилгеранилдифосфата (С20) (рис. 1) (Britton, 1998).
2. Синтез фитоина Последним звеном в цепи биосинтеза углеродного скелета каротиноидов, состоящего из 40 углеродных атомов, оказывается тетратерпен фитоин (рис. 1). Фитоин (С40) образуется путем конденсации двух молекул дитерпена геранилгеранилдифосфата (С20 + С20) по типу “хвост к хвосту”. Сейчас установлено, что продуктом этой реакции служит С40-фитоин, который имеет ненасыщенную двойную связь между центральными атомами углерода (С-15 и С-15'), а не С40-ликоперсен (Britton, 1998).
Исходя из структурной формулы фитоина, имеющего 3 + 6 = 9 ненасыщенных двойных связей, понятно, что для его превращения в ликопин с 11 + 2 = 13 двойными связями необходимо последовательное дегидрирование (десатурация) восьми углеродных атомов. Этот процесс должен идти по крайней мере через четыре промежуточных этапа, каждый из которых будет приводить к образованию одной двойной связи. Такая последовательная десатурация фитоина до ликопина приводит к образованию хромофорной системы каротиноидов (Britton, 1998). В настоящее время установлено, что в результате первой реакции дегидрирования образуется фитофлуин. Это первое промежуточное вещество в биосинтезе ликопина и последнее в цепи всех предшественников каротиноидов, имеющее 5 + 5 = 10 ненасыщенных двойных связей, которое, как и фитоин, является бесцветным и имеет максимумы поглощения в ультрафиолетовой области спектра 250–380 нм. Дальнейшее дегидрирование приводит к образованию ζ-каротина и хромофорной системы каротиноидов, включающей 7 + 4 = 11 и более ненасыщенных двойных связей, обусловливающих поглощение в видимой части спектра при 350–550 нм. Процесс образования все большего числа ненасыщенных двойных связей в ходе последовательного дегидрирования формирует хромофор каротиноидов, что обусловливает сдвиг максимумов поглощения в длинноволновую часть спектра (Britton, 1995).
Процесс циклизации каротинов, как правило, может осуществляться только в том случае, если одна или обе концевые группы имеют одну одинарную связь между С-3 и С-4 или С-3' и С-4' атомами углерода. Он не может происходить ни при наличии двух и более одинарных связей, ни при их отсутствии, как у 3,4,3',4'-тетрадегидроликопина (Britton, 1998; Cunningham, Gantt, 1998, 2001). Формирование циклических каротинов хлоропластов начинается с образования двух типов концевых групп: β- и ε-иононовых колец у β- и α-зеакаротинов соответственно. Механизм циклизации достаточно подробно исследован (Sandmann, 1994). Установлено, что первым продуктом циклизации каротинов является β-зеакаротин, который у водорослей образуется из нейроспорина (Sandmann, 1994; Armstrong, Hearst, 1996). Из нейроспорина формируется и первое ε-иононовое кольцо в процессе синтеза α-зеакаротина (Armstrong, 1994; Britton, 1998). В дальнейшем у водорослей в результате дегидрирования из α-зеакаротина образуется δ-каротин (ε,ψ-каротин), а из β-зеакаротина – γ-каротин (ε,ψ-каротин). С помощью радиоактивной метки было установлено, что у Scenedesmus (Britton, 1995) возможно формирование вначале ликопина (ψ,ψ-каротина), а затем его циклизация до δ- и γ-каротинов (Armstrong, 1994; Britton, 1998), так же, как это происходит в хромопластах красных плодов томатов (Sandmann, 1994) и хлоропластах Arabidopsis thaliana (Cunningham, Gantt, 1998, 2001). В результате циклизации второй концевой группы и образования ε-кольца или β-кольца из δ- и γ-каротинов синтезируются три типа каротинов: ε-каротин (ε,ε-каротин), α-каротин (β,ε-каротин) и β-каротин (β,β-каротин). В скобках дано название соединений по химической номенклатуре IUPAC (Weedon, Moss, 1995).
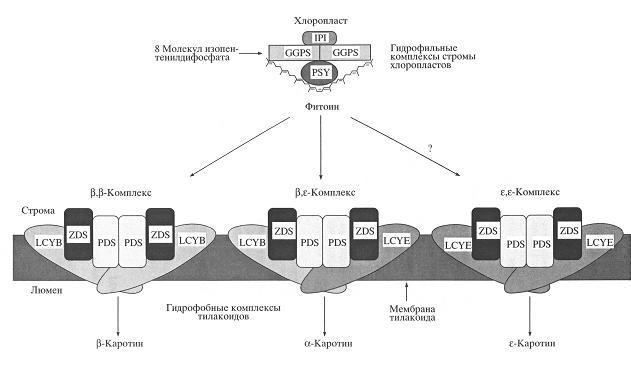
В настоящее время механизм функционирования ферментов, участвующих в биосинтезе каротиноидов, в клетках растений изучен очень слабо. Все больше накапливается сведений о том, что биосинтез каротиноидов осуществляется с помощью двух типов мультиферментных агрегатов или комплексов: а) гидрофильных, локализованных в строме хлоропластов и б) гидрофобных, ассоциированных с мембранами тилакоидов (Cunningham, Gantt, 1998). Первая группа ферментов исследована значительно лучше. Так, известно, что три водорастворимых фермента (рис. 2): изопентенилдифосфатизомераза, геранилгеранилдифосфатсинтаза и фитоинсинтаза (гены Iрр 2, Ggps 1 и Psy 1), которые катализируют путь биосинтеза предшественников каротиноидов от С5-изопреноидов до фитоина, – были изолированы вместе в составе мультиферментных комплексов. Предполагается, что гидрофобные ферменты: фитоиндесатураза (PDS), ζ-каротиндесатураза (ZDS) и ликопин-(β-и ε-)-циклазы (LCYB и LSYE) (гены Pds 1, Zds 1, Crt L-b и Crt L-e) – связаны с мембранами тилакоидов и также, вероятно, образуют мультиферментные комплексы (Cunningham, Gantt, 1998, 2001). Гипотетическая модель таких комплексов была предложена в 1998 г. (Cunningham, Gantt, 1998) и модифицирована нами (рис. 2).
Рис. 2. Схема структурной модели предполагаемых стромальных и тилакоидных мультиферментных комплексов в хлоропластах растений (Cunningham, Gantt, 1998). IPI – изопентенилдифосфатизомераза, GGPS – геранилгеранилдифосфатсинтаза, PSY – фитоинсинтаза, PSD – фитоиндесатураза, ZDS – ζ-каротиндесатураза, LCYB – ликопин-β-циклаза, LCYE – ликопин-ε-циклаза. Знак (?) означает возможность существования ε,ε-комплекса для синтеза ε-каротина.
Что касается гидрофобных ферментов, то пока нет никаких прямых доказательств того, что мембранно-связанные десатуразы, циклазы и гидроксилазы образуют подобные мультиферментные комплексы. Однако в 1998 г. была выдвинута гипотеза (Cunningham, Gantt, 1998) о том, что десатуразно-циклазные ферменты тоже должны формировать агрегаты или комплексы, содержащие по две копии фитоиндесатуразы (PDS), ζ-каротиндесатуразы (ZDS) и ликопин-β-циклазы (LCYB) или ликопин-ε-циклазы (LCYE). Учитывая, что в хлоропластах большинства водорослей и высших растений синтезируются только α-каротин (β,ε-каротин) и β-каротин (β,β-каротин), можно думать, что и в их пластидах, по-видимому, необходимо наличие только соответствующих двух типов десатуразно-циклазных ферментных комплексов (Cunningham, Gantt, 1998, 2001). Биосинтез ксантофиллов Все кислородсодержащие производные каротинов называются ксантофиллами. В пластидах эукариотических растений и водорослей они образуются путем энзиматического окисления ε-, α- и β-каротинов (рис. 1). Реакции протекают в аэробных условиях. Обычно большинство кислородсодержащих групп, обнаруженных в ксантофиллах хлоропластов, находятся в форме либо гидроксигрупп (–ОН) и связаны с 3-м углеродным атомом (С-3 или С-3'), либо оксогрупп (=O) и связаны с 4-м углеродным атомом (С-4 или С-4'), либо эпоксигрупп (–O–) в положении между 5-м и 6-м углеродными атомами (С-5,6 или С-5',6') иононовых колец. Известно, что все три типа кислородсодержащих групп образуются за счет реакций окисления с использованием молекулярного кислорода атмосферы (Britton, 1998). В результате первых реакций гидроксилирования α- и β-каротинов образуются зеиноксантин и α-криптоксантин (моногидрокси-α-каротин), а также β-криптоксантин (моногидрокси-β-каротин). Эта ступень превращения каротиноидов является типичной монооксигеназной реакцией (Sandmann, 1994). Поскольку α-каротин с его ε-иононовым кольцом синтезируется только в пластидах водорослей и высших растений, то и его производные зеиноксантин, α-криптоксантин, лютеин, лороксантин, сифонаксантин и фритшиеллаксантин накапливаются только у этих организмов (Sandmann, 1994; Thompson, 1996; Liaaen-Jensen, 1998). Напротив, β-криптоксантин и зеаксантин синтезируются как у бактерий и грибов, так и у растений и водорослей (Ладыгин, 2002). У зеленой водоросли Chlamydomonas reinhardtii обнаружены также лютеин-5,6-эпоксид, лютеоксантин и лороксантин. Лороксантин помимо Chlamydomonas был найден у Euglena, Chlorella, Scenedesmus и у харовых водорослей. И хотя, кроме лютеина и лороксантина, содержание других производных α-каротина незначительно, нельзя исключить очень важную функциональную роль этих каротиноидов в хлоропластах растений и водорослей (Ладыгин, 2002). Из наиболее широко распространенных ксантофиллов хлоропластов высших растений: зеаксантина, антераксантина и виолаксантина – образуются алленовые и ацетиленовые каротиноиды, которые встречаются почти у всех эукариот (Liaaen-Jensen, 1998). Из антераксантина и виолаксантина образуются соответственно деэпоксинеоксантин и неоксантин, а также другие алленовые ксантофиллы водорослей (Britton, 1995, 1998). Свое название они получили благодаря наличию у них характерной алленовой концевой группы, т.е. двух ненасыщенных двойных связей у 7-го атома углерода. В свою очередь из деэпоксинеоксантина и неоксантина синтезируются ацетиленовые ксантофиллы водорослей: диатоксантин и диадиноксантин (рис. 3), имеющие тройную ацетиленовую связь между 7-м и 8-м атомами углерода. Эти каротиноиды в хлоропластах водорослей могут осуществлять реакции эпоксидации в темноте и деэпоксидации на свету, подобно ксантофиллам виолаксантинового цикла высших растений (Britton, 1998). Кроме того, из диадиноксантина образуется аллоксантин (7,8,7',8'-тетрадегидро-3,3'-дигидрокси-β-каротин), один из характерных ксантофилов водорослей, содержащих две тройные ацетиленовые связи между 7-м и 8-м, а также 7'-м и 8'-м атомами углерода. Аналогичным образом формируются ацетиленовые концевые группы у каротиноидов, производных астаксантина: 7,8-дидегидро- и 7,8,7',8'-тетрадегидроастаксантина (Ладыгин, 2002). Астаксантин (3,3'-дигидрокси-4,4'-диоксо-β-каротин) – достаточно широко распространенный каротиноид водорослей, который, как и все перечисленные алленовые и ацетиленовые каротиноиды, является производным β-каротина. Другими оксокаротиноидами, производными β-каротина, являются эхиненон (4-оксо-β-каротин) и кантаксантин (4,4'-диоксо-β-каротин), характерные для цианобактерий и гетеротрофных бактерий. Они могут быть также обнаружены как вторичные каротиноиды у водорослей, растущих в различных условиях стресса, в частности при дефиците азота. У зеленых водорослей они, так же как фритшиеллаксантин, астаксантин, семиастацен и астацен, могут накапливаться в клеточной стенке зооспор (Thompson, 1996). В хлоропластах зеленых водорослей (Сhlоrоphyta) состав каротиноидов практически такой же, как и у высших растений, но иногда дополнительно встречается лороксантин (Ладыгин, 2000, 2002). В то жe время красные (Rhodophyta) , эвгленовые (Euglenophyta), а также бурые, золотистые, диатомовые и другие морские водоросли (относящиеся к Chromophyta) отличаются большим разнообразием каротиноидов. Так ε-каротин (ε,ε-каротин) в малых количествах накапливается у водорослей (Cryptophyceae, Diatomophyceae, Prasinophyceae и Chlorophyceae) (LiaaenJensen, 1998). Все каротиноиды локализуются в пластоглобулах или тилакоидных мембранах, где распределяются гетерогенно. Часть из них связывается со специфическими хлорофилл-белковыми комплексами фотосистемы I (ФС-I) и фотосистемы II (ФС-II). Распределение каротиноидов между ядровыми комплексами реакционных центров ФС-I и ФС-II, а также между светособирающими пигмент-белковыми комплексами I и II (LHC-I и LHC-II) внутренней и внешней антенны фотосистем очень неравномерно. Считается, что обогащение каротиноидами ксантофиллового цикла в большей степени присуще минорным компонентам светособирающих хлорофилл-а/b-белковых комплексов (СР29, СР26 и СР24), образующих внутреннюю антенну ФС-II, чем главному светособирающему комплексу ФС-II (тримеры LHC-II), формирующему внешнюю периферическую антенну (Ruban et al., 2001). В минорных комплексах локализуется до 80% пигментов ксантофиллового цикла, в то время как в состав главного периферического комплекса LHC-II входит лишь 20% этих пигментов (Gilmore et al., 1998). В отличие от хлорофилл-а/b-содержащих зеленых водорослей из отдела Chlorophyta среди морских и океанических хлорофилл-а/с-содержащих водорослей, относящихся к отделу Chromophyta, можно обнаружить значительно более разнообразный набор каротиноидов, в основном производных β-каротина (Liaaen-Jensen, 1998). Из них следует особо отметить ксантофиллы, содержащие алленовую или ацетиленовую группу. Это связано с тем, что наличие алленовой группы часто характерно для светособирающих ксантофиллов, таких как фукоксантин у диатомовых (Diatomophyceae), бурых (Fucophyceae, или Phaeophyceae) и гаптофитовых (Haptophyceae, или Prymnesiophyceae) водорослей, перидинин у динофлагеллят (Dinophyceae) или вошериаксантин у ксантофитов (Xanthophyceae) (Liaaen-Jensen, 1998). Ацетиленовая группа обнаружена у таких каротиноидов, как диатоксантин, его 5,6-моноэпоксид диадиноксантин, гетероксантин у эвгленовых (Euglenophyceae) и аллоксантин у криптофитовых (Cryptophyceae) (рис. 3).
ФУНКЦИИ КАРОТИНОИДОВ В ХЛОРОПЛАСТАХ 1. Светособирающая функция каротиноидов Каротиноиды в отличие от хлорофиллов поглощают свет в сине-зеленой области 350–550 нм. Это особенно важно для водных морских и океанических видов водорослей, которые в их естественной среде хорошо обеспечены сине-зеленым, но не красным светом вследствие его сильного поглощения водной средой. В сине-зеленой области спектра каротиноиды более эффективны в собирании света, чем хлорофиллы, что определяется их высокой концентрацией и эффективной миграцией энергии на хлорофилл. Будучи вспомогательными пигментами, каротиноиды передают поглощенную энергию на молекулы хлорофилла а, находящиеся на энергетически низком уровне синглетно-возбужденного состояния S1. У растений энергия квантов света с молекул ксантофиллов светособирающего комплекса ФС-II передается на молекулы хлорофилла а с эффективностью соответственно: от виолаксантина – 54%, лютеина – 62%, неоксантина – 85%, а от хлорофилла b – 97% (Gruszecki et al., 1999). 2. Фотозащитная функция каротиноидов В защите хлоропластов от повреждающего действия света наиболее существенную роль играют каротиноиды. Сейчас известно четыре основных фотозащитных механизма с участием каротиноидов. Каротиноиды действуют как фильтры, которые уменьшают количество синего и ближнего ультрафиолетового света, достигающего фотосинтетического аппарата. Такую же функцию они выполняют в нефотосинтезирующих организмах или тканях, например астаксантин у водоросли Hematococcus pluvialis (Kobayashi et al., 1991) и 9-cis и аll-trаns-β,β'-каротины у Dunaliella bardawil (BenAmotz et al., 1989), где большинство каротиноидов локализуется в органеллах типа “олеосом”. Эти водоросли продуцируют каротиноиды в таких количествах, что они используются как коммерческий источник для естественного астаксантина и β,β'-каротина соответственно (Ben-Amotz et al., 1989; Kobayashi et al., 1991). Каротиноиды могут действовать как тушители возбужденных синглетных состояний хлорофилла, так как нижний уровень энергии их синглетного возбужденного состояния находится ниже уровня энергии синглетного возбужденного состояния хлорофилла: 1Chl* + 1Car → 1Chl + 1Car*. Уровень энергии возбужденных состояний каротиноидов может изменяться при увеличении или уменьшении числа конъюгированных двойных связей, что приводит к изменению функций каротиноидов: доноров энергии (пигменты антенны), передающих поглощенную энергию на реакционные центры, и акцепторов энергии (тушители), абсорбирующих и рассеивающих избыточный свет. Такое изменение функций каротиноидов между собиранием света и рассеиванием энергии было подробно изучено в виолаксантиновом цикле растений, в котором виолаксантин превращается в зеаксантин. Светособирающий пигмент виолаксантин, содержащий девять конъюгированных двойных связей, дважды обратимо деэпоксидируется до зеаксантина, содержащего одиннадцать сопряженных двойных связей, путем прибавления двух двойных связей Δ5 и Δ5' (Scheer, 2003). Похожие циклы эпоксидации–деэпоксидации, участвующие в защите клеток от светоиндуцированного повреждения, были обнаружены в морских и океанических водорослях с участием диадиноксантина и диатоксантина (Lohr, Wilhelm, 1999; Lavaud et al., 2003). Деэпоксидированные зеаксантин и диатоксантин приобретают свойства тушителя и участвуют в нефотохимическом тушении флуоресценции хлорофилла. Следовательно, ксантофиллы виолаксантинового цикла в присутствии кислорода защищают хлорофиллы и липиды от разрушения и обеспечивают устойчивость тилакоидных мембран при высокой интенсивности света (Клячко-Гурвич и др., 2000).
3. Структурная функция каротиноидов и их локализация Каротиноиды являются обязательными структурными компонентами фотосинтетических мембран. Они входят в состав хлорофилл-белковых комплексов. В состав комплексов реакционных центров ФС-I и ФС-II входят 1–2 молекулы β-каротина. В стабилизации светособирающих хлорофилла/b-белковых комплексов важную роль играют ксантофиллы: лютеин, виолаксантин, неоксантин и зеаксантин (Tracewell, 2001).
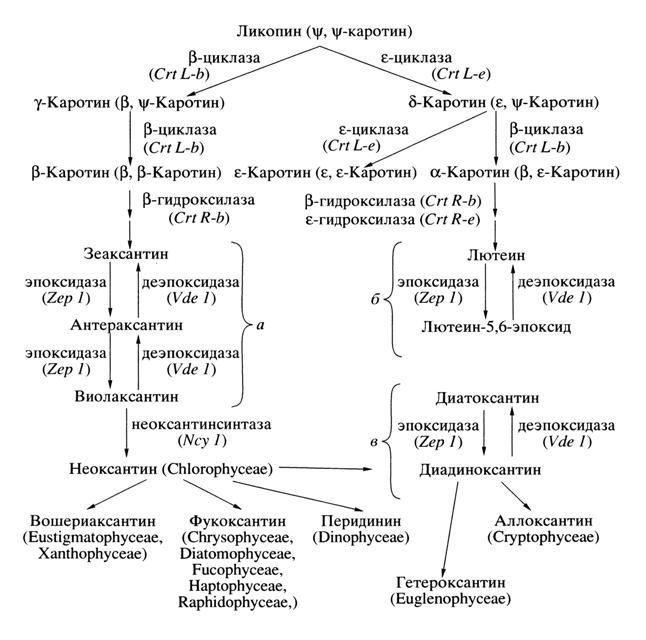
Ксантофилловые циклы В настоящее время известно, что некоторые ксантофиллы могут участвовать в обратимых светозависимых реакциях. Эти взаимопревращения каротиноидов осуществляются в реакциях ксантофилловых циклов, две из которых считают главными: эпоксидации и деэпоксидации. В хлоропластах различных эукариот сейчас известно три типа ксантофилловых циклов: виолаксантиновый, лютеин-5,6-эпоксидный и диадиноксантиновый (рис. 3). В растительном царстве ключевым и наиболее широко распространенным является виолаксантиновый цикл, в котором осуществляются обратимые превращения виолаксантина в зеаксантин. Этот цикл обнаружен практически у всех эукариотических водорослей и высших растений (DemmigAdams et al., 1996; Ладыгин, 2002). Второй тип ксантофиллового цикла, лютеин-5,6-эпоксидный, был недавно описан для паразитического растения Cuscuta reflexa, в листьях красного дуба Quercus rubra и в семействах Loranthaceae и Viscaceae. В этом цикле лютеин может превращаться в лютеин-5,6-эпоксид. Затем имеет место обратная реакция (Ладыгин, 2008). Третий тип ксантофиллового цикла, диадиноксантиновый, был обнаружен у морских и океанических планктонных водорослей. В этом цикле происходит взаимопревращение диадиноксантина в диатоксантин (Lohr, Wilhelm, 1999; Ладыгин, 2000, 2002). У некоторых морских водорослей при определенных условиях роста могут работать одновременно диадиноксантиновый и виолаксантиновый циклы (Lohr, Wilhelm, 1999).
1. Виолаксантиновый цикл Прямая реакция деэпоксидации виолаксантина до зеаксантина идет на сильном свету с выделением кислорода при участии фермента виолаксантиновой деэпоксидазы, который контролируется хлоропластным геном Vde1 (Cunningham, Gantt, 1998, 2001; Ладыгин, 2002). Деэпоксидаза виолаксантина – это водорастворимый фермент с молекулярной массой от 40 до 54 кДа у разных растений, который локализуется на внутренней (люменальной) стороне мембраны тилакоида (рис. 3). Он проявляет максимальную активность при рН 5.2 и использует аскорбат в качестве косубстрата (Hager, Holocher, 1994; Cunningham, Gantt, 1998, 2001). Обратная реакция эпоксидации зеаксантина до виолаксантина протекает на слабом свету или в темноте с использованием кислорода атмосферы, а не Н2O. Эта реакция осуществляется при оптимуме рН 7.5 с участием фермента НАДФ·H-зависимой зеаксантиновой эпоксидазы, который контролируется хлоропластным геном Zep1 и имеет молекулярную массу 72 кДа (Cunningham, Gantt, 1998, 2001; Ладыгин, 2002). Этот фермент является мембранно-связанным белком и локализуется на внешней (стромальной) стороне мембраны тилакоида (Hager, Holocher, 1994). Виолаксантиновая деэпоксидаза в отличие от постоянно мембранно-связанной зеаксантиновой эпоксидазы подвижна внутри тилакоидного люмена и при близком к нейтральному значению рН 6.8–7.2, которое встречается in vivo в темноте, может отделяться от мембраны. Однако при сильном освещении, когда внутри тилакоида внутрилюменальный рН падает ниже 6.5 вследствие образования протонного градиента, свойства деэпоксидазы изменяются, фермент вновь прикрепляется к мембране тилакоида, получая доступ к субстрату виолаксантину и достигая максимальной активности при рН 5.2 (Hager, Holocher, 1994).
2. Лютеин-5,6-эпоксидный цикл Впервые на возможность существования второго типа ксантофиллового цикла было указано в 1975 г. в исследованиях каротиноидов зеленых плодов томатов в начале созревания, но подробное описание нового цикла, названного лютеин-5,6-эпоксидным, было представлено лишь несколько лет назад при исследовании паразитического растения Cuscuta reflexa. В этом растении на сильном свету лютеин-5,6-эпоксид деэпоксидируется до лютеина без нарушения структурной целостности светособирающих комплексов фотосистем. Ферменты, катализирующие реакции лютеин-5,6-эпоксидного цикла, являются теми же самыми, что и для виолаксантинового цикла, т.е. виолаксантиновая деэпоксидаза и зеаксантиновая эпоксидаза (рис. 3). Рис. 3. Пути биосинтеза основных каротиноидов в хлоропластах эукариот. Показано три типа ксантофилловых циклов: виолаксантиновый (а), лютеин-5,6-эпоксидный (б) и диадиноксантиновый (в). В нижней части схемы перечислены основные ксантофиллы, выполняющие светособирающую функцию у разных таксонов водорослей (Ладыгин, 2002; Macpherson, Hiller, 2003; Scheer, 2003).
Появление лютеин-5,6-эпоксидного цикла наряду с виолаксантиновым циклом некоторые авторы объясняют мутацией зеаксантиновой эпоксидазы, которая в паразитических растениях приобретает способность катализировать эпоксидацию лютеина до лютеин-5,6-эпоксида (Matsubara et al., 2003). Возможно, что мутация изменила субстратную специфичность этого фермента так, что структура второго иононового кольца (ε-кольца) не препятствует взаимодействию фермента эпоксидазы с лютеином. Следовательно, в результате мутации зеаксантиновая эпоксидаза приобретает способность синтезировать лютеин-5,6-эпоксид из лютеина. Таким образом, вполне вероятно, что параллельная работа этих двух ксантофилловых циклов могла возникнуть путем вовлечения в их реакции виолаксантиновой деэпоксидазы, обычной зеаксантиновой эпоксидазы и/или модифицированной в результате мутации зеаксантиновой эпоксидазы (Ладыгин, 2008).
3. Диадиноксантиновый цикл У морских планктонных водорослей обнаружен третий тип циклических взаимопревращений ксантофиллов, названный диадиноксантиновым циклом. Эти фотосинтезирующие организмы обитают в нестабильных световых условиях, поскольку в глубине океана водоросли испытывают недостаток освещения для нормального процесса фотосинтеза. Поэтому им необходимо максимально эффективно собирать фотоны света. На поверхности моря эти водоросли получают сильный световой стресс, т.е. перенасыщение световой энергией, во много раз превосходящее тот уровень, который необходим для максимального фотосинтеза. В обеих ситуациях важную роль играют каротиноиды: как в собирании света, так и в защите от его избытка (Yamamoto, Bassi, 1996). В нескольких группах планктонных морских водорослей, таких; как диатомовые (Diatomophycea), динофитовые (Dinophyceae), гаптофитовые (Haptophyceae) и ксантофитовые (Xanthophyceae), наряду с широко распространенным у фотосинтезирующих организмов виолаксантиновым циклом функционирует другой ксантофилловый цикл, включающий взаимопревращения ацетиленовых (имеющих одну тройную связь) ксантофиллов: диадиноксантина и диатоксантина (Macpherson, Hiller, 2003). В этом ксантофилловом цикле, названном диадиноксантиновым (рис. 3), при избыточном освещении моноэпоксидное соединение диадиноксантин в процессе реакции деэпоксидации превращается в безэпоксидный диатоксантин (Ладыгин, 2002). Результаты, полученные по диадиноксантиновому циклу, показали, что этот цикл оказывает значительное влияние на тепловое рассеивание световой энергии, защищающее водоросли от фоторазрушения. В экспериментах на диатомовых водорослях показано, что диатоксантин тушит энергию возбуждения менее эффективно, чем зеаксантин. Однако более низкая эффективность может быть компенсирована большими размерами пула диадиноксантинового цикла у морских водорослей, чем виолаксантинового цикла у высших растений (Lohr, Wilhelm, 1999, 2001), и более быстрыми кинетиками деэпоксидации и эпоксидации в одноэтапном диадиноксантиновом цикле в сравнении с двухэтапным виолаксантиновым циклом (Ладыгин, 2002). Ферментом, катализирующим деэпоксидацию как виолаксантина, так и диадиноксантина, является виолаксантиновая деэпоксидаза. Экспериментально установлено, что с помощью этого фермента диадиноксантин деэпоксицируется в 2 раза быстрее, чем виолаксантин (Lavaud et al., 2002). У морских и океанических хлорофилл-а/с-содержащих водорослей, таких, как диатомовые, бурые, динофлагелляты, гаптофиты и ксантофиты, реакции взаимопревращений диадиноксантина и диатоксантина осуществляются при функционировании диадиноксантинового цикла, который является альтернативой виолаксантиновому циклу (Liaaen-Jensen, 1998). В дальнейшем было установлено, что у морских водорослей в определенных условиях оба эти цикла могут функционировать одновременно (Lohr, Wilhelm, 2001). Таким образом, нами детально охарактеризованы светособирающая, структурная и фотозащитная функции каротиноидов. Описаны механизмы функционирования и филогенетические особенности локализации трех ксантофилловых циклов. Однако многие аспекты происхождения, особенности функционирования этих циклов, а также значимость каротиноидов в филогенезе еще предстоит выяснить.
Участие каротиноидов в фототаксисе В последнее десятилетие активно изучается биохимический состав белков мембран глазного пятна (Wagner et al., 2008). Особое внимание уделяется исследованию родопсина и изомеров ретиналя (Renninger et al., 2001; Dieckmann, 2003). Недавно была описана редукция каротинов и глазного пятна у белого светочувствительного мутанта с блокировкой синтеза фермента фитоинсинтазы (Inwood et al., 2008). Эти результаты подтверждают наше заключение о том, что без каротиноидов не образуется глазное пятно (Ладыгин, Семенова, 2014). В зависимости от содержания каротиноидов в хлоропластах Chlamydomonas reinhardtii глазное пятно может содержать от 1 до 4 рядов липидно-каротиноидных глобул. Причем, каждый ряд липидно-каротиноидных глобул окружен мембранами, которые на продольном срезе имеют гексагональную структуру схожую с пчелиными сотами (Ладыгин, 2014). На поперечном срезе каждая глобула глазного пятна имеет овальную или округлую форму. Такую же структуру имеет глазное пятно у зеленой водоросли Spermatozopsis similis, в глобулах которого было обнаружено преобладающее накопление каротинов (Grung et al., 1994; Renninger et al., 2001). Рассмотрено участие каротиноидов в фототаксисе одноклеточной зеленой водоросли Chlamydomonas reinhardtii. Показано, что ее глазное пятно содержит каротины. Кроме того, с помощью мутантов хламидомонады впервые удалось доказать возможность изменения состава каротинов в глобулах глазного пятна (Ладыгин, 2014). В заключение следует сказать, что детальное описание всех этапов биосинтеза, генетического контроля, локализации, метаболизма и механизмов функционирования каротиноидов в хлоропластах растений и различных видов водорослей подробно обсуждается в монографии В.Г. Ладыгина «Пути биосинтеза, локализация, метаболизм и функции каротиноидов в хлоропластах различных видов водорослей», представленной на сайте Приложения к журналу «Вопросы современной альгологии» algology.ru в PDF-формате.
Список литературы Карнаухов В.Н. Функции каротиноидов – объект биофизических исследований // Биофизика. 2000. Т. 45. № 2. С. 364–384. Клячко-Гурвич Г.Л., Пронина Н.А., Ладыгин В.Г., Цоглин Л.Н., Семененко В.Е. Разобщенное функционирование фотосистем I и фотосистемы II. 1. Особенности и роль десатурации жирных кислот // Физиология растений. 2000. Т. 47. № 5. С. 688–698. Ладыгин В.Г. Биосинтез каротиноидов в пластидах растений // Биохимия. 2000. Т. 65. № 10. С. 1317–1333. Ладыгин В.Г. Современные представления о путях биосинтеза каротиноидов в хлоропластах эукариот // Журн. общей биологии. 2002. Т. 63. № 4. С. 299–325. Ладыгин В.Г. Лютеин-5,6-эпоксидный цикл – новый ксантофилловый цикл в хлоропластах растений // Биологические мембраны. 2008. Т. 25. № 3. С. 163–172. Ладыгин В.Г. Биогенез и возможности изменения состава каротиноидов глазного пятна у мутантов микроводоросли Chlamydomonas reinhardtii // Микробиология. 2014. Т. 83. № 2. С. 160–169. Ладыгин В.Г., Семенова Г.А. Ульраструктурная организация и состав каротиноидов глазного пятна у мутантов Chlamydomonas reinhardtii // Цитология. 2014. Т. 56. № 1. С. 48–56. Пасешниченко В.А. Новый альтернативный путь биосинтеза изопреноидов у эубактерий и растений // Биохимия. 1998. Т. 63. № 2. С. 171–182. Armstrong G.A. Eubacteria show their true colors: Genetics of carotenoid pigment biosynthesis from microbes to plants // J. Bacteriol. 1994. V. 176. № 16. Р. 4795–4802. Armsrong G.A., Hearst J.E. Genetics and molecular biology of carotenoid pigment biosynthesis // FASEB J. 1996. V. 10. № 2. Р. 228–237. Ben-Amotz A., Shaish A., Avron M. Mode of action of the massively accumulated β-carotene of Dunaliella bardawil in protecting the alga against damage by excess irradiation // Plant Physiology. 1989. V. 91. P. 1040–1043. Britton G. Structure and properties of carotenoids in relation to function // FASEB J. 1995. V. 9. № 15. P. 1551–1558. Britton G. Overview of carotenoid biosynthesis // Carotenoids: Biosynthesis and Metabolism / Eds Britton G., Liaaen-Jensen S., Pfander H. Basel; Boston; Berlin: Birkhauser Verlag, 1998. V. 3. P. 13–147. Camara B. Plant phytoene syntase complex: component enzymes, immunology, and biogenesis // Methods Enzymol. 1993. V. 214. № 3. P. 252–365. Cunningham F.X. Jr., Gantt E. Genes and enzyme of carotenoid biosynthesis in plants // Ann. Rev. Plant Physiol. Plant Mol. Biol. 1998. V. 49. № 4. P. 557–583. Cunningham F.X. Jr., Gantt E. One ring or two? Determination of ring number in carotenoids by lycopene ε-cyclases // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 5. P. 2905–2910. Demmig-Adams B., Gilmore A.M., Adams W.W. III. In vivo function of carotenoids in higher plants // FASEB J. 1996. V. 10. №4. P. 403–412. Dieckmann C.L. Eyespot placement and assembly in the green alga Chlamydomonas // BioEssays. 2003. V. 25. P. 410–416. Emenhiser C., Englert G., Sander L.C., Ludwig B., Schwartz S.J. Isolation and structural elucidation of the prodominant geometrical isomers of α-carotene // J. Chromatogr. 1996. V. 719. № 3. P. 333–343. Gilmore A.M., Shinkarev V.P., Hazlett T.L., Govindjee. Quantitative analysis of the effects of intrathylakoid pH and xanthophyll cycle pigments on chlorophyll a fluorescence lifetime distributions and intensity in thylakoids // Biochemistry. 1998. V. 37. № 39. P. 13582–13593. Grung M., Kreimer G., Calenberg M., Melkonian M., Liaaen-Jensen S. Carrotenoids in the eyespot apparatus of the flagellate green alga Spermatozopsis similes: Adaptation to the retinal-based photoreceptor // Planta. 1994. V. 193. P. 38–43. Gruszecki W.J., Grudzinski W., Banaszek-Glos A., Matula M., Kerner P., Krupa Z., Sielewiesiuk J. Xanthophyll pigments in light-harvesting complex II in monomolecular layers: localisation, energy transfer and orientation // Biochim. Biophys. Acta. 1999. V. 1412. № 2. P. 173–183. Hager A., Holocher K. Localization of the xanthophyll cycle enzyme violaxanthin deepoxidasa within the thylakoid lumen and abolition of its mobility by a (light-dependent) pH decrease // Planta. 1994. V. 192. № 4. P. 581–589. Inwood W., Yoshihara C., Zalpuri R., Kim K.-S., Kustu S. The ultrastructure of a Chlamydomonas reinhardtii mutant strain lacking phytoene synthase resembles that of a colorless alga // Molecular Plant. 2008. V. 1. № 6. P. 925–937. Kobayashi M., Kakizano T., Nagai S. Astaxanthin production by a green alga Haematococcus pluvialis accompanied with morphological changes in acetate media // J. Ferment. Bioeng. 1991. V. 71. P. 335–339. Lavaud J., Rousseau B., Etienne A.L. Enrichment of the light-harvesting complex in diadinoxanthin and implications for the nonphotochemical fluorescence quenching in Diatoms // Biochemistry. 2003. V. 42. № 19. P. 5802–5808. Lavaud J., Rousseau B., Gorkom H.J., van, Etienne A.L. Influence of the diadinoxanthin pool size on photoprotection in the marine planktonic diatom Phaeodactylum tricornutum // Plant Physiol. 2002. V. 129. P. 1398–1406. Liaaen-Jensen S. Carotenoids in chemosystematics // Carotenoids: Biosynthesis and Metabolism / Eds Britton G., Liaaen-Jensen S., Pfander H., Basel; Boston; Berlin: Birkhauser Verlag. 1998. V. 3. P. 217–247. Lichtenthaler H.K., Schwender J., Disch A., Rohmer M. Biosinthesis of isoprenoid in higher plant chloroplasts proceeds via a nevalonate-independent pathway // FEBS Lett. 1997. V. 400. № 3. P. 271–274. Lohr M., Wilhelm C. Algae displaying the diadinoxanthin cycle also possess the violaxanthin cycle // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 15. P. 8784–8789. Lohr M., Wilhelm C. Xanthophyll synthesis in diatoms: quantification of putative intermediates and comparison of pigment conversion kinetics with rate constants derived from a model // Planta. 2001. V. 212. P. 382–391. Macpherson A.N., Hiller R.G. Light-harvesting systems in chlorophyll c-containing algae // Light-Harvesting Antennas in Photosynthesis. / Eds Green B.R., Parson W.W. Dordrecht; Boston; London: Kluwer Acad. Publ. 2003. V. 13. P. 323–352. Matsubara S., Morosinotto Т., Bassi R., Christian A.-L., Fischer-Schliebs Е., Lüttge U., Orthen В., Franco А.С., Scarano F.R., Forster В., Pogson D.J., Osmond С.В. Occurrence of the lutein-epoxide cycle in mistletoes of the Loranthaceae and Viscaceae // Planta. 2003. V. 217. Р. 868–879. Renninger S., Backendorf E., Kreimer G. Sub fractionation of eyespot apparatuses from the green alga Spermatozopsis similis: isolation and characterization of eyespot globules // Planta. 2001. V. 213. P. 51–63. Ruban A.V., Pascal A.P., Robert B., Horton P. Configuration and dynamics of xanthophylls in light-harvesting antennae of higher plants. Spectroscopic analysis of isolated light-harvesting complex of photosystem II and thylakoid membranes // J. Biol. Chem. 2001. V. 276. № 27. P. 24862–24870. Sandmann G. Carotenoid biosynthesis in microorganisms and plants // Eur. J. Biochem. 1994. V. 223. № 1. P. 7–24. Scheer H. The pigments // Light-Harvesting Antennas in Photosynthesis. / Eds Green B.R., Parson W.W. Dordrecht; Boston; London: Kluwer Acad. Publ. 2003. V. 13. P. 29–81. Thompson G.A., Jr. Lipids and membrane function in green algae // Biochim. Biophys. Acta. 1996. V. 1302. № 1. P. 17–45. Tracewell C.A., Vrettos J.S., Bautista J.A., Frank H.A., Brudvig G.W. Carotenoid photooxidation in photosystem II // Arch. Biochem. Biophys. 2001. V. 385. № 1. P. 61–69. Wagner V., Ulmann K., Mollwo A., Kaminski M., Mittag M., Kreimer G. Phosphoproteome of Chlamydomonas reinhardtii eyespot fraction includes key proteins of light signaling pathway // Plant Physiol. 2008. V. 146. P. 772–788. Weedon B.C.L., Moss C.P. Structure and nomenclature // Carotenoids: Isolation and Analysis / Eds Britton G., Liaaen-Jensen S., Pfander H. Basel: Birkhauser, 1995. V. 1A. P. 27–70. Yamamoto H.Y., Bassi R. Carotenoids: localization and function // Advances in Photosynthesis. Oxygenic Photosynthesis: The Light Reactions. / Eds Ort D.R., Yocum C.F. Dordrecht: Kluwer Acad. Publ. 1996. V. 4. P. 539–563. опубликовано - декабрь 2014 г.
Ways of biosynthesis, localization, metabolism and functions of carotenoids in chloroplasts of different types of algae Vladimir G. Ladygin It has been considered current ideas on biosynthesis of eukaryotes’ carotenoids both general for higher plants and green algae, and specifically distinctive for different systematic groups of algae. It has been described all genes and enzymes participating at every stage of carotenoids’ biosynthesis, as well as localization of multi-enzyme complexes in chloroplasts’ membranes. Metabolism and main functions of the most important xanthophylls are being discussed in detail: 1 – light-harvesting, 2 – structural, and 3 – photoprotective. A special attention is paid to description of the mechanisms of photoprotection, including that ones with participation of specific carotenoids: 1 – violaxanthin, 2 – lutein-5,6-epoxide and 3 – diadinoxanthin cycles. The fist one from them is typical for the most eukaryotes, and the second and the third one are met only in separate groups of the algae. It has been considered participation of carotenoids in phototaxis of unicellular green algae. It has been shown that their light- sensitive organella, the eyespot, contains carotenes. Moreover, with the help of Chlamydomonas reinhardtii mutants we managed to prove first possible changes of carotenes’ composition in the globules of the eyespot by mutagenesis. Key words: algae; eukaryotes chloroplasts; carotenoids; biosynthesis of carotenes and xanthophylls; genetic control; localization; light harvesting function of carotenoids; photoprotective function of carotenoids; structural function of carotenoids; violaxanthin's cycle of xanthophylls; lutein-5,6-epoxide's cycle of xanthophylls; diadinoxathin's cycle of xanthophylls ; eyespot; phototaxis. Об авторе Ладыгин Владимир Георгиевич – Ladygin Vladimir Georgievich доктор биологических наук ladyginv@rambler.ru Корреспондентский адрес: Россия, 142290, Московская область, г. Пущино, ул. Институтская, д. 2, Институт фундаментальных проблем биологии РАН; телефон: (4967) 73-36-01
ССЫЛКА НА СТАТЬЮ: Ладыгин В.Г. Пути биосинтеза, локализация, метаболизм и функции каротиноидов в хлоропластах различных видов водорослей // Вопросы современной альгологии. 2014. № 2(6). URL: http://algology.ru/529
При перепечатке ссылка на сайт обязательна .. ОГЛАВЛЕНИЕ МОНОГРАФИИ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ВВЕДЕНИЕ………………………………………………………………………….. |
4 |
||
|
ГЛАВА I. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ И ПУТИ БИОСИНТЕЗА |
. |
||
|
|
ОБЩИЕ СВЕДЕНИЯ О КАРОТИНОИДАХ………………………………… |
4 |
|
|
|
БИОСИНТЕЗ КАРОТИНОВ…………………………………………………..... |
7 |
|
|
|
|
1. Два пути биосинтеза изопентенилдифосфата…….……....... |
7 |
|
|
|
2. Формирование моно-, сескви- и дитерпенов………….……….. |
10 |
|
|
|
3 Синтез фитоина……………………………………….………… |
12 |
|
|
|
4 Дегидрирование фитоина до ликопина…..…………….………… |
12 |
|
|
|
5. Циклизация каротинов…..………………………………................... |
17 |
|
|
БИОСИНТЕЗ КСАНТОФИЛЛОВ……….………………………………........... |
19 |
|
|
|
ЛОКАЛИЗАЦИЯ МУЛЬТИФЕРМЕНТНЫХ КОМПЛЕКСОВ…………......... |
28 |
|
|
ГЛАВА II. МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ КАРОТИНОИДОВ……...... |
30 |
||
|
|
ХАРАКТЕРИСТИКА КАРОТИНОИДОВ ЭУКАРИОТ…………………..... |
31 |
|
|
|
ЛОКАЛИЗАЦИЯ НАИБОЛЕЕ ВАЖНЫХ КСАНТОФИЛЛОВ.…………. |
34 |
|
|
|
ФУНКЦИИ КАРОТИНОИДОВ В ХЛОРОПЛАСТАХ…………………….… |
38 |
|
|
|
|
1 Светособирающая функция каротиноидов…………….………. |
38 |
|
|
|
2. Фотозащитная функция каротиноидов………………….……… |
39 |
|
|
|
3. Структурная функция каротиноидов и их локализация……. |
45 |
|
|
КСАНТОФИЛЛОВЫЕ ЦИКЛЫ………………………………………………... |
48 |
|
|
|
|
1. Виолаксантиновый цикл……………………………………………. |
48 |
|
|
|
2. Лютеин-5,6-эпоксидный цикл………………………………………… |
50 |
|
|
|
3. Диадиноксантиновый цикл…………………………………………… |
58 |
|
|
УЧАСТИЕ КАРОТИНОИДОВ В ФОТОТАКСИСЕ………………………….. |
60 |
|
|
|
|
1. Формирование ультраструктуры глазного пятна……………. |
62 |
|
|
|
2. Состав каротиноидов в глобулах глазного пятна…………... |
66 |
|
|
|
3. Изменение состава каротинов глазного пятна путем мутагенеза. |
67 |
|
ЗАКЛЮЧЕНИЕ……………………………………………………………………..... |
71 |
||
|
СПИСОК ЛИТЕРАТУРЫ………………………………………………………........ |
73 |
||
На ГЛАВНУЮ

КОНТАКТЫ
Email: info@algology.ru
Изготовление интернет сайта
5Dmedia
ЛИЦЕНЗИЯ
Эл N ФС 77-22222 от 01 ноября 2005г.
ISSN 2311-0147