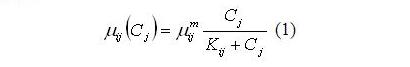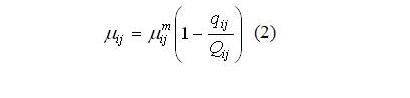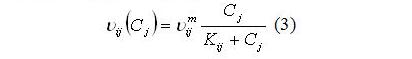|
|
|
Морфофизиологические стратегии фитопланктонных сообществ
Силкин В.А.1, Паутова Л.А.2, Лифанчук А.В.1, Федоров А.В.1 Vladimir A. Silkin, Larisa A. Pautova, Anna V. Lifanchuk, Aleksey V. Fedorov
1 Южное отделение Института океанологии им. П.П. Ширшова РАН (г. Геленджик)
УДК 574.583:574.522
Выявлены основные морфофизиологические стратегии фитопланктонных сообществ северо-восточной части Черного моря в течение годового цикла. В весенний период основную роль в формировании фитоцена играют такие морфофизиологические характеристики как максимальная удельная скорость роста и малый размер клеток диатомей (strategy of maximal growth rate). В конце весны – начале лета при лимитировании азотом доминирование обеспечивает низкая константа полунасыщения, характерная для кокколитофорид (affinity strategy). Летом преобладают крупноклеточные диатомовые, способные накапливать питательные элементы, но обладающие низкой скоростью роста (storage strategy). Ключевые слова: фитопланктон; кокколитофориды; диатомовые водоросли; максимальная удельная скорость роста; константа полунасыщения; северо-восточная часть Черного моря.
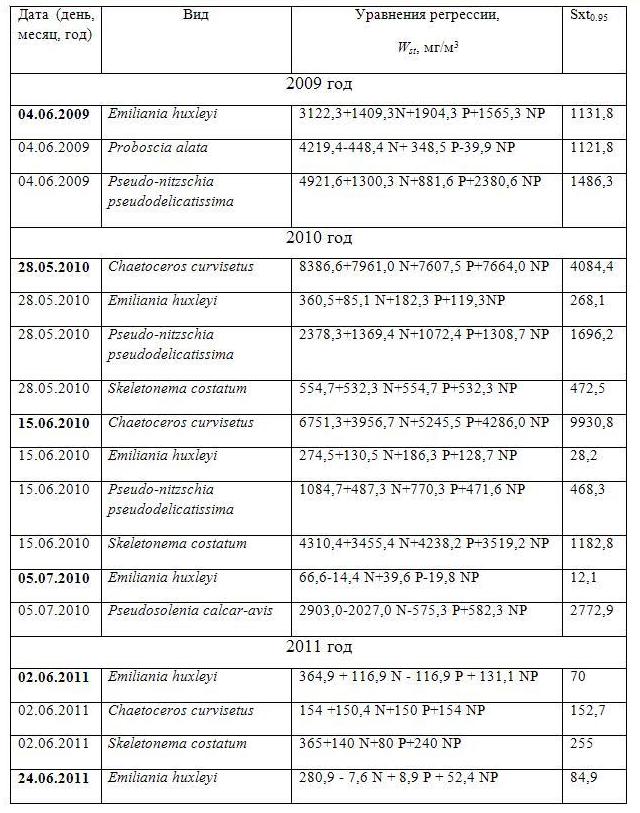
Фитопланктон Мирового океана играет важнейшую роль в формировании климата нашей планеты, ему принадлежит почти половина годового баланса углерода, усвоенного из атмосферы и депонированного на дне (Field et al., 1998; Falkowski et al., 2004). При этом биомасса фитопланктона составляет всего 0,2% от общей биомассы всех растений на планете. В свою очередь, климат влияет на структурно-функциональные показатели фитопланктона (Falkowski, Oliver, 2007). Фитопланктон участвует в биологической трансформации многих элементов питания (углерода, азота, фосфора, кремния и т.д.) и формирует биогеохимические циклы этих элементов. Предсказание изменений структуры фитопланктонных сообществ и их продуктивности невозможно без изучения всех сторон организации и функционирования фитопланктона. Прежде всего, возникает необходимость детального изучения структурной организации в пространственно-временных координатах. В данном случае речь идет о таксономической принадлежности и размерной структуре. Морской фитопланктон весьма разнообразен и включает около 5000 видов (Sournia et al., 1991) с характерным для каждого таксона пигментным составом. При этом размеры клеток его изменяются от менее 1 микрона до 1000 микрон (Falkowski et al, 2004; Jiang et al., 2005), а объем клетки варьирует в пределах девяти порядков от 0,1 мкм3 у мельчайшего пикопланктона до 108 мкм3 у крупноклеточных диатомей (Maranon, 2015). Клетки могут образовывать колонии, обладающие уже другими продукционными характеристиками. Функциональные свойства фитопланктона зависят от питания, наряду с чисто фотоавтотрофным способом получения энергии существуют виды с миксотрофным и чисто гетеротрофным типом питания. Все это усложняет задачу выявления закономерностей формирования структуры сообществ и механизмов функционирования фитопланктона в целом. Однако задача упрощается тем, что в сообществе обычно присутствуют доминирующие виды, которые определяют его биомассу и тем самым функционирование фитопланктона. Это сводит задачу к исследованию физиологических свойств доминирующих видов. В течение годового цикла в море происходит смена доминирующих видов, которая носит повторяющийся характер и этот цикл называется сукцессией. Структура фитопланктонного сообщества определяется факторами окружающей среды. В течение годового цикла происходит повторяющаяся динамика факторов среды, которая и приводит к смене доминирующих форм. Это предполагает наличие одних и тех же процессов (Tilman et al., 1982; Sommer et al., 2012). Изменение условий окружающей среды, в том числе смена лимитирующего фактора, отразится на видовой структуре сообщества, а также будет иметь последствия в виде изменения размерных показателей (López-Sandoval et al., 2014). Существуют две гипотезы, которые связывают приведенные нами морфологические параметры клетки (объем и отношение поверхности к объему) и их физиологические характеристики. Согласно первой гипотезе, биомасса вакуолей отражает способность клетки запасать элементы минерального питания в различных формах, и эта способность прямо пропорциональна объему клетки (Raven, 1998). С увеличением биомассы клетка с большей вероятностью переходит в разряд клеток-накопителей. Однако по другой закономерности с увеличением биомассы клеток снижается максимальная удельная скорость роста согласно экспоненциальному закону (Banse, 1976; Chisholm, 1992; Litchman, Klausmeier, 2008; Finkeletal., 2010). Вторая гипотеза связывает отношение поверхности и константы полунасыщения для поглощения элементов минерального питания (Smith, Kalff,1982; Grover, 1989; Litchman et al., 2007; Tambi et al., 2009). При повышении отношения поверхности к объему константа полунасыщения снижается, и виды с такими характеристиками клеток становятся более успешными конкурентами за элементы минерального питания в условиях ограничения. Цель настоящего исследования заключалась в нахождении основных морфофизиологических механизмов формирования структуры и продуктивности фитопланктонных сообществ на примере северо-восточной части Черного моря. Материалы и методы В данной работе использовали сочетания полевых наблюдений, экспериментальных исследований и численного моделирования. Полевые исследования В период с 2002 по 2014 гг. в рейсах НИС «Акванавт» и МНИС «Ашамба» были проведены исследования структуры фитопланктонного сообщества северо-восточной части Черного моря. Сбор проб морской воды проводили постоянно не реже одного раза в месяц, исключая зимний период, промежуток между взятием проб мог превышать один месяц из-за штормовой погоды. Во время интенсивного развития кокколитофорид число выходов в море увеличивали до трех и более раз. Пробы отбирали при помощи зонда-батометра «Rozett» и 5-литрового батометра Нискина после предварительного STD-зондирования на станциях стандартного разреза от Голубой бухты (район Геленджика) к центру моря. Пробы концентрировали двумя способами: методом обратной фильтрации через ядерный фильтр с диаметром пор 1 мкм и методом отстаивания. В качестве фиксатора применяли нейтрализованный бурой (Na2BO3) 40%-ный формалин до конечной 1%-ной концентрации в пробе. Идентификация видов и подсчет числа клеток проводились на световом микроскопе «Эргавал» при увеличении 16х20 и 16х40 в счетных камерах Ножотта объемом 0,05 мл для нано- и пикопланктона и Наумана объемом 1,0 мл для микропланктона. При расчете биомассы применяли метод «истинного объема» (Киселев, 1969), биомассу выражали в единицах сырой биомассы (мг/м3) и единицах углерода (мг С/м3). Перевод сырой биомассы в углеродные единицы осуществляли по формулам, учитывающим систематическую принадлежность водорослей (Menden-Deuer, Lessard, 2000). За уровень «цветения» принимали численность клеток, превышающую 1,0·106 кл./л. В вопросах номенклатуры руководствовались IdentifyingMarinePhytoplankton (1997), Throndsenetal. (2003); www.algaebase.org и www.marinespecies.org. Экспериментальные исследования В период 2009-2014 гг. проводили эксперименты с накопительной культурой фитопланктона в береговой лаборатории ЮО ИО РАН (г. Геленджик), в которых исследовали влияние нитратов и фосфатов на структуру фитопланктонного сообщества. Объектом исследования служила смешанная культура водорослей, полученная на основе природного сообщества фитопланктона. Пробы были собраны с борта малого научно-исследовательского судна «Ашамба». Отбор проб производили с горизонта 0 м на станции стандартного разреза от Голубой бухты к центру моря. Станция была расположена над глубиной 50 м (район срединного шельфа). Морскую воду отбирали пластиковой пятилитровой емкостью и разливали по бутылям с одновременной фильтрацией через два слоя мельничного газа № 36 для удаления зоопланктона. Выращивание проводили в колбах Эрленмейера емкостью 500 мл, где объем культуральной среды составлял 200 мл. В эксперименте использовали аппарат для культивирования (термолюминостат), где температура среды соответствовала температуре на поверхности моря. Интенсивность падающего света поддерживали на уровне 58–61 мкмоль/м2 ФАР, свето-темновой период соответствовал природному. Идентификацию видов и подсчет числа клеток проводили ежедневно на световом микроскопе в счетной камере Ножотта объемом 0,05 мл. Биомассу рассчитывали методом «истинного объема» (Киселев, 1969), при этом использовали данные собственных измерений. Определение таксономической принадлежности осуществляли с помощью Identifying Marine Phytoplankton (1997), Throndsen et al. (2003); www.algaebase.org и www.marinespecies.org. В экспериментах применяли периодический (накопительный) режим культивирования. Опыты ставили с применением метода планирования экспериментов, которые позволяют получать уравнения регрессии, отражающие действие выбранных факторов на изучаемый параметр (Максимов, Федоров, 1969). Добавку элементов минерального питания (нитратов в форме KNO3 и фосфатов в форме Na2HPO4) производили в начале эксперимента по единой схеме, представленной в таблице 1.
Таблица 1. План экспериментов по изучению влияния добавок элементов минерального питания на продукционные свойства
Результаты и обсуждение Для выявления механизмов формирования структуры сообщества и, прежде всего, для объяснения смены доминирующих видов в течение годового цикла, необходимо выбрать минимальный набор физиологических процессов и найти их математическое описание. Все это определяется принимаемой концепцией. Наиболее простой вариант основан на зависимости такого интегрирующего физиологического показателя как удельная скорость роста от факторов внешней среды, которые ограничивают продукционный процесс. Для олиготрофных и мезотрофных вод принято считать, что это концентрация азота, фосфора и кремния (Falkowski et al., 1998). Для северо-восточной части Черного моря наиболее вероятными будут концентрации азота и фосфора, поскольку концентрация кремния относительно высока (Yakushev et al., 2007). Так называемая концепция внеклеточного регулирования построена на зависимости удельной скорости роста от концентрации лимитирующего рост фактора в среде, и она выражается уравнением Моно: где: µij и µijm – соответственно удельная и максимальная удельная скорости роста j-го элемента питания i-ым видом; Kij – константа полунасыщения для j-го элемента питания у i-го вида, Cj – концентрация j-го элемента питания в среде. В этом уравнении только два физиологических параметра, а именно максимальная удельная скорость роста и константа полунасыщения. В другой более сложной концепции внутриклеточного регулирования рассматриваются два процесса – процесс поглощения лимитирующего рост элемента и рост как функция внутриклеточного содержания лимитирующего элемента питания. В общем виде зависимость удельной скорости роста от внутриклеточного содержания элемента подчиняется уравнению Моно. Было показано (Droop, 1968, 1974), что зависимость имеет вид: Где μij и μijm – соответственно удельная и максимальная удельная скорости роста i-го вида на j-ом элементе питания; Qij и qij – соответственно текущее и минимальное содержание j-го элемента питания в биомассе i-го вида. Удельная скорость поглощения элемента питания определяется его концентрацией в среде и описывается моделью Михаэлиса-Ментен: где: υij и υijm – соответственно удельная и максимальная удельная скорости поглощения j-го элемента питания i-ым видом; Kij – константа полунасыщения для j-го элемента питания у i-го вида. Рассматривая эти две концепции и соответственно две модели, принимается вторая модель, потому что разделение процесса на два этапа оказалось принципиальным для объяснения сукцессий фитопланктона, что будет показано ниже. Итак, второй подход подразумевает наличие четырех физиологических параметров, а именно максимальной удельной скорости роста (она не равна таковому параметру в уравнении Моно), минимального содержания (квоты) лимитирующего рост элемента, а также параметров процесса поглощения – максимальной скорости поглощения и константы полунасыщения для процесса поглощения. Минимальная квота лимитирующего рост элемента представляет собой минимальное содержание при удельной скорости роста, равной нулю, или, другими словами, это минимальное эссенциальное содержание элемента, при котором скорость синтеза макромолекул в клетке равна скорости их распада. Соотношение минимальных квот – видоспецифичный показатель, отражающий потребности водоросли в элементах минерального питания. Оказалось, что это соотношение весьма вариабельно (Geider, La Roshe, 2002; Klausmeyer et al., 2004; Raven, 2013). Изменение соотношения азота к фосфору приводит либо к синтезу, либо к выводу органических молекул, содержащих эти вещества, что указывает на биохимическую пластичность. Азот содержится в свободных аминокислотах, белках, нуклеиновых кислотах, фотосинтетических пигментах, и именно синтез этих веществ снижается при лимитировании роста азотом. Кроме того, у крупноклеточных форм диатомей, клетки которых занимает большой объем вакуоли, могут храниться нитраты как запасное вещество, поступление которых замедляется при лимитировании азотом. При ограничении роста азотом, в клетках происходит сдвиг в сторону преимущественного синтеза углеводов или нейтральных липидов и образуются клетки с минимальным содержанием белка. Что касается фосфора, то помимо неорганических полифосфатов он содержится в органических молекулах, таких как РНК, ДНК, фосфолипиды, АТФ, НАДФ и другие. Фосфолипиды составляют от 10 до 50% от общего содержания липидов (Geider, La Rosh, 2002), а фосфотриглицериды – необходимый структурный компонент клеточной мембраны. Свыше 30% общего фосфора в клетке содержится в фосфолипидах. При лимитировании роста фосфором они заменяются бесфосфорными молекулами (Raven, 2013). Что касается соотношения углерода азота и фосфора в клетке, то классическим соотношением, ставшим уже догмой для специалистов, является соотношение 106:16:1. Однако это не соответствует действительности, и соотношение Редфилда представляет некий усредненный показатель многочисленных измерений содержания этих элементов в планктоне (Geider, La Roche, 2002). Соотношение элементов в клетке определяется соотношением их минимальных квот, а эти параметры достаточно вариабельны (Droop, 1974; Силкин, Хайлов, 1988; Klausmeyer et al., 2004). Более того, минимальная квота зависит от уровня других факторов. В частности минимальная квота по фосфору увеличивается при повышении интенсивности света (Силкин, 1994). Т.е. при изменении энергетических потоков соотношение элементов минерального питания может измениться, что изменит оптимальные соотношения элементов в среде (Силкин, Хайлов, 1988). Клаусмейер с соавт. (Klausmeyer et al., 2004) делят клетки водорослей на 2 класса. Первый представляет собой клетки как сборочную машину с высоким содержанием рибосом и РНК соответственно, второй – машину, ориентированную на потребление материально-энергетических ресурсов. Сборочная машина содержит большое количество азота и фосфора, а потребляющая содержит белки, пигменты с высоким содержанием азота, но с небольшим количеством фосфора. Авторы следуют гипотезе, что скорость роста связана содержанием РНК и требует большего количества белка. Все это относят к двум экологическим сценариям: высокая скорость в экспоненциальной фазе накопительной культуры и конкурентные возможности при равновесии в условиях лимитирования азотом, фосфором и светом. В экспоненциальной фазе роста клетка работает как сборочная машина. Эти исследователи считают, что низкое отношение азота и фосфора характерно для экспоненциального роста, а большое – для условий конкуренции. В реальных условиях в экосистеме присутствуют как виды, которые находятся в экспоненциальной фазе роста, так и виды, находящиеся в состоянии конкуренции. Поэтому усредненные показатели по экосистеме находятся в середине и соответствуют соотношению Редфилда. Кроме межвидовых различий N:P существуют и внутривидовые вариации, которые обусловлены генетическим разнообразием и физиологической пластичностью. Основными детерминантами является биология и стехиометрия рибосом и белков и смесь фаз экспоненциального роста и фазы равновесия, тождество (одинаковость) лимитирующих ресурсов играет меньшую роль. Главная роль принадлежит соотношению минимальных квот, при этом основная роль принадлежит вариации минимальной квоты по фосфору, поскольку минимальные квоты по азоту примерно одинаковы. Следствием вышеописанных представлений является постоянная изменчивость N:P в океане в результате изменения экологических условий либо соотношения фаз экспоненциального роста и конкурентного равновесия. Исходя из этой гипотезы, соотношение минимальных квот будет определяющим для предсказания поведения вида в различные сезоны года. Кроме того, от этого соотношения зависят оптимальные условия для роста. Ранее было показано, что по критерию продуктивности оптимальное отношение азота к фосфору в среде равно соотношению их минимальных квот (Силкин, Хайлов, 1988).
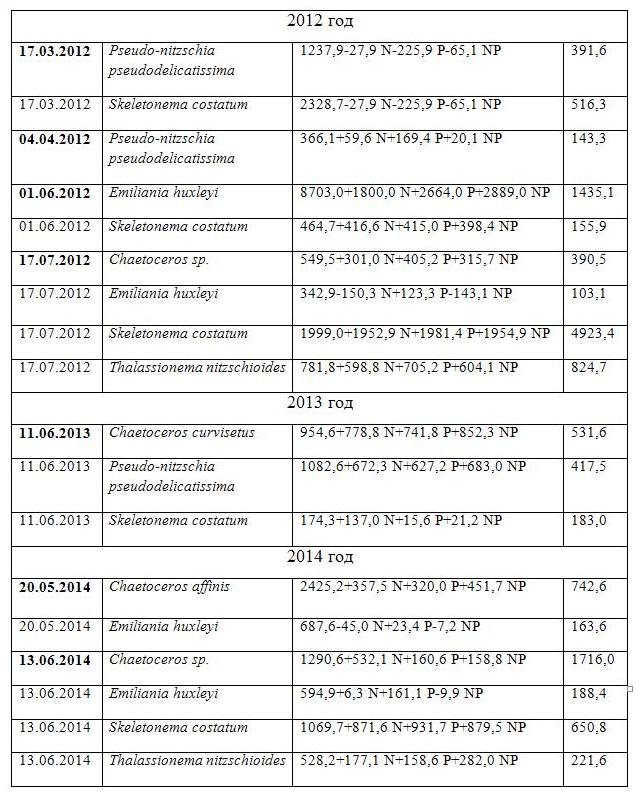
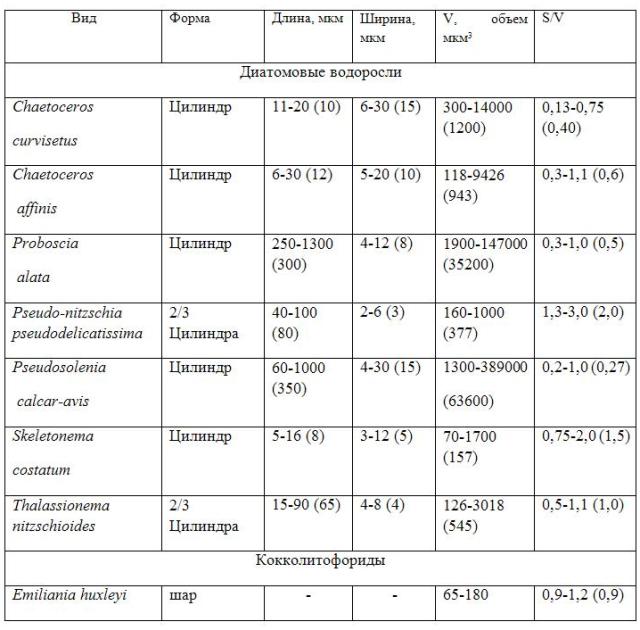
Особенности годового цикла фитопланктона в северо-восточной части Черного моря Весеннее цветение Весеннее цветение практически всегда присутствует в морях умеренных широт. Из литературных данных следует, что весеннее цветение – классический пример цветения в годовом сукцессионном цикле как пресноводных (Sommer et al., 1986), так и морских экосистем (Winder, Cloern, 2010; Barton et al., 2013; Sommer et al., 2012). Зимой в период конвективного перемешивания происходит накопление биогенных элементов и весной, когда отмечается усиление светового потока и стратификация водной толщи, происходит интенсивное развитие фотоавтотрофных форм (мелкоклеточных диатомей). В это время пресс хищников минимален (Behrenfeld et al., 2006; Taylor and Ferrari, 2011). Время цветения диатомей зависит от запасенного количества биогенных элементов (Dale et al., 1999). Далее биомасса диатомей снижается за счет седиментации и пресса хищников. В весенний период в северо-восточной части Черного моря развиваются мелкоклеточные формы диатомей (Chaetoceros curvisetus, Skeletonema costatum, Thalassionema nitzschioides и Pseudo-nitzschia pseudodelicatissima). В экспериментах с добавками элементов минерального питания показано, что в этот период не наблюдается реакции этих диатомей на изменение концентраций азота и фосфора, а также изменение их соотношений (Табл. 2). Это связано, по-видимому, с тем, что запасов этих элементов в среде достаточно для того, чтобы иметь не лимитированный по этим элементам рост. Но уже в апреле после весеннего цветения мелкоклеточные диатомеи показывают зависимость от концентрации элементов питания – при одновременной добавке азота и фосфора отмечается их интенсивный рост (Табл. 2). Таким образом, согласно уравнению (1) в весенний период происходит отбор видов по одному важному физиологическому параметру – максимальной удельной скорости роста (strategy of maximal growth rate). В весенний период доминанты имеют малый объем клетки и при этом относительно высокие показатели отношения поверхности к объему (Табл. 3). Какой морфологический критерий в этом случае является определяющим – объем или соотношение поверхности к объему? При высокой концентрации биогенных элементов клетки растут с максимальной удельной скоростью роста, затем, при снижении концентрации элементов в среде, соотношение поверхности к объему становится принципиальным для успешного освоения пространства. И это должно быть соединено в одном виде – весной, при высокой скорости процессов и кратковременности весеннего цветения нет времени для смены видов. Поэтому из большого числа видов выигрывает небольшое количество, удовлетворяющее этим двум критериям.
Таблица 2. Результаты факторного эксперимента по влиянию азота (N) и фосфора (Р)
Таблица 3. Форма, объемы и соотношение площади к объему Кроме того, поглощение света на единицу хлорофилла значительно меньше у крупных клеток, чем у мелких, что объясняется упаковкой пигментов. В этой связи преимущество в условиях низких освещенностей получают мелкоклеточные формы (Finkel, 2001; Finkel et al., 2004). Весеннее цветение может начинаться и в феврале, когда световые потоки еще далеки от максимума (Якубенко, 2011). Таким образом, сложившиеся в весенний период условия соответствуют физиологическому максимуму для мелкоклеточных диатомей. Конец весны – начало лета Кокколитофориды демонстрируют интенсивный рост в конце весны и начале лета. Это уникальная группа морского фитопланктона, которая характеризуется образованием оболочки из кокколит, строительным материалом для которых служит кальцит (Рис. 1). Клетка диаметром от 3 мкм и выше покрыта одним или несколькими слоями кокколит. Считается, что коколитофориды производят половину СаСО3 в океане (Milliman, 1993). Наиболее массовым видом кокколитофорид, образующим цветение как в океане (Brown, Yoder, 1994), так и в Черном море, является Emiliania huxleyi. В Черном море отмечается тенденция усиления роли кокколитофорид в формировании биомассы сообществ (Паутова и др., 2007). В конце весны и начале лета пространство, занимаемое кокколитофоридным цветением, может превышать половину поверхности моря (Cokacar et al., 2000, 2004; Kopelevich et al., 2014).
Рис. 1. Кокколитофрида Emiliania huxleyi (Lohmann) Hay & Mohler, 1967 из северо-восточной части Черного моря. Снимок с электронного сканирующего микроскопа.
Уравнения регрессии показывают, что рост кокколитофорид интенсифицируется при добавке только фосфора или при одновременной добавке азота и фосфора, при этом вклад фосфора в стимулирование роста кокколитофорид значительно превышает вклад азота. Учитывая то, что при одновременной добавке азота и фосфора соотношение этих элементов в среде близко к соотношению Редфилда, оптимальным для роста кокколитофорид будет соотношение азота и фосфора ниже соотношения Редфилда. В этот период рост мелкоклеточных диатомей невозможен из-за лимитирования их роста, прежде всего концентрацией азота. Кокколитофориды же способны расти при низких концентрациях азота, что связано с более низкой константой полунасыщения для поглощения азота. Согласно теории R-competition Тилмана (Tilman, 1977, 1981) константа полунасыщения является ключевым моментом при определении способности вида конкурировать за данный элемент питания. Выигрывает конкуренцию вид, способный расти при более низких концентрациях ресурса (affinity strategy). Простой и поэтому привлекательной является гипотеза низкой концентрации кремния, что становится причиной остановки роста диатомей, и кокколитофориды получают конкурентные преимущества (Egg, Aksnes, 1992; Egg, Heimdal, 1994; Paasche, 2002). Однако результаты прямых измерений в море показывают, что концентрация кремния относительно велика (Yakushev et al., 2007) и сопоставима с константой полунасыщения для поглощения кремния у диатомей (>4 мкM) (Krause et al., 2012). Другим подтверждением является получение высоких биомасс диатомовых в экспериментах с одновременным добавлением азота и фосфора, при наличии лимитирования их роста кремнием это было бы невозможно. Таким образом, относительно низкие концентрации фосфора и низкое отношение азота к фосфору – необходимые условия доминирования кокколитофорид. Одной из причин высокой эффективности Emiliania huxleyi является высокая устойчивость PSII к недостатку азота, при лимитировании этим элементом вид поддерживает работу системы в течение 38 дней, в то время как диатомеи – только 8-10 дней. При лимитировании фосфором фотосистема у кокколитофорид разрушается через 7 дней, у диатомей через 3 дня. У кокколитофориды эта система значительно быстрее восстанавливает свою работу после снятия лимитирования (Loebl et al., 2010). В природных условиях мелкоклеточные диатомеи не получают интенсивного развития в этот период. Но при добавлении одновременно азота и фосфора фиксируется интенсивный рост этих водорослей, что и указывает на лимитирование их роста этими элементами (Табл. 2). Летний период В летний сезон развиваются исключительно крупноклеточные формы диатомей (Proboscia alata и Pseudosolenia calcar-avis). Интересным фактом является то, что эти виды не показывают одновременно высокую численность. Они либо разделены в пространстве, либо во времени. К примеру, P. alata доминировала только в 2007-2009 гг., а во все остальные годы летней доминантой была P. calcar-avis. Отмечались случаи, когда P. alata интенсивно развивалась в прибрежных водах, а P. calcar-avis в центре моря. Обычно эти виды не реагируют на изменение концентраций азота и фосфора в среде (Табл. 2). Это связано с тем, что эти виды являются накопителями элементов питания. Благодаря большому объему клетки они имеют высокое содержание вакуолей, которые обладают свойством аккумулировать элементы питания (Raven, 1998). Азот накапливается в виде свободных аминокислот, фосфор в виде полифосфатов. В летнее время, по-видимому, внутриклеточный запас достаточно высокий, что и позволяет доминантам этого сезона не реагировать на добавки элементов питания (Табл. 2). Прежде всего эффект накопления сказывается на таком элементе как азот. Именно крупноклеточные формы водорослей способны накапливать азот в различных формах в вакуолях. Мелкоклеточные формы способны накапливать фосфор в виде таких простых соединений как полифосфаты. Например, клетка кокколитофориды способна произвести 30 делений за счет запасенного фосфора (Riegman, 2000). Отсутствие структур для накопления азота делает мелкоклеточные формы чувствительными для продолжительного голодания по этому элементу.
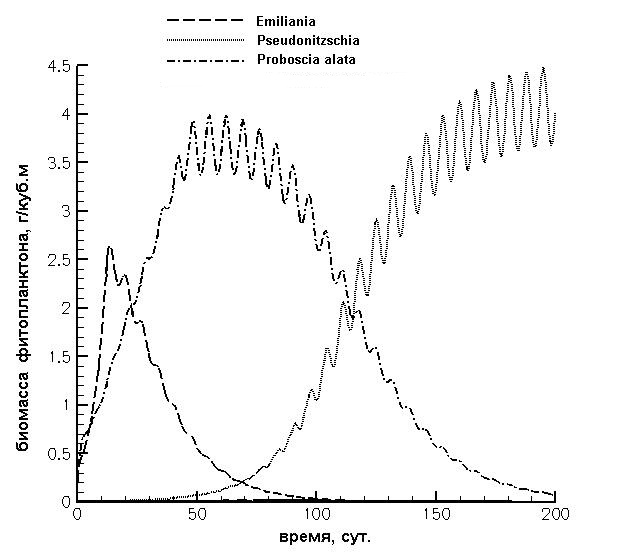
Рис. 2. Динамика биомассы кокколитофориды Emiliania huxleyi (1) и диатомовых водорослей Pseudo-nitzschia pseudodelicatissima (2), Proboscia alata (3) при скорости обмена среды D=0,1 сут-1, концентрации азота 0,024 г/м3 и фосфора 0,0009 г/м3 на входе с изменением последних по синусоидальному закону для моделирования периодического (период – неделя) ветроволнового перемешивания. Начальные биомассы E. huxleyi и P. pseudodelicatissima равны 0,2 г/м3, P. alata – 0,001 г/м3.
Крупноклеточные формы способны расти при периодическом пополнении запасов. Такое периодическое пополнение внутриклеточных запасов происходит при поступлении элементов питания за счет кратковременных штормов. Именно это и наблюдается в летний период, когда в основном штилевая погода нарушается кратковременным усилением ветра. Эта гипотеза была проверена с помощью вычислительных экспериментов на математической модели (Silkin et al., 2013). На рис. 2 показана динамика биомассы 3 видов: представителя весеннего сезона – мелкоклеточной диатомеи Pseudo-nitzschia pseudodelicatissima ; представителя сезона конца весны, начала лета – кокколитофориды Emiliania huxleyi и представителя летнего сезона – крупноклеточной диатомеи Proboscia alata. При начальных условиях, соответствующих концу мая, и при периодическом один раз в неделю пополнении запасов кокколитофорида способна доминировать около 20 дней, затем доминирование переходит к крупноклеточной форме диатомей P. alata, которая способна оставаться доминирующей формой в течение более чем двух месяцев, что и происходит в природных условиях. Таким образом, в летний период реализуется третья стратегия – способность клеток накапливать элементы питания (storage strategy), и эта способность связана с большим размером клеток. Кроме того, крупные клетки при высоких световых потоках менее восприимчивы к фотоингибированию (Key et al., 2010). Соответственно, способность клеток накапливать элементы минерального питания и низкая восприимчивость к световому ингибированию представляются ключевыми регуляторами формирования структуры фитопланктонного сообщества летом. Таким образом, в процессе адаптации к повторяющимся ежегодно факторам среды в фитопланктонном сообществе формируются определенные сезонные комплексы, которые характеризуются морфофизиологическими свойствами. Весенний сезонный комплекс состоит из мелкоклеточных диатомей с основным физиологическим свойством – максимальной удельной скоростью роста. В конце весны и начале лета доминантами сообщества становятся кокколитофориды с отличительным свойством – минимальной константой полунасыщения для процесса поглощения азота. Летний сезонный комплекс представлен крупноклеточными формами диатомей с уникальной способностью – накапливать элементы минерального питания. Это свойство позволяет определять биомассу и продуктивность сообщества в условиях периодического обеспечения элементами питания. Благодарности Работа выполнена при финансовой поддержке РФФИ (проект № 13-05-00618).
Список литературы 1. Вершинин А.О., Моручков А.А., Суханова И.Н., Камнев А.Н., Паньков С.А., Мортон С.Л., Рамсделл Дж. С. Сезонные изменения фитопланктона в районе мыса Большой Утриш Северо-Кавказского берега Черного моря в 2001-2002 гг. // Океанология. 2004. Т. 44. №3. С. 399-405. 2. Киселев И.А. Планктон морей и континентальных водоемов. Л.:Наука, 1969. Т. 1. 657с. 3. Максимов В.Н., Федоров В.Д. Применение методов математического планирования эксперимента при отыскании оптимальных условий культивирования организмов. М.: Изд-во МГУ, 1969. 128 с. 4. Микаэлян А.С., В.А. Силкин, Л.А. Паутова. Развитие кокколитофорид в Черном море: межгодовые и многолетние изменения // Океанология. 2011. Т. 51. №1. С. 45-53. 5. Паутова Л.А., Микаэлян А.С., Силкин В.А. Структура планктонных фитоценов шельфовых вод северо-восточной части Черного моря в период массового развития Emiliania huxleyi в 2002-2005 гг. // Океанология. 2007. Т. 47. №3. С. 408-417. 6. Силкин В.А. Кинетика роста одноклеточных водорослей при лимитировании элементами минерального питания. Эффект взаимодействия факторов // Физиология растений. 1994. T. 41. №2. С. 264–268. 7. Силкин В.А., Хайлов К.М. Биоэкологические механизмы управления в аквакультуре. Л.: Наука. 1988. 230 с. 8. Якубенко В.Г. Внутригодовая изменчивость потоков импульса, тепла, соли и плавучести через поверхность моря в северо-восточной части Черного моря // Комплексные исследования Черного моря. М: Научный мир. С. 75-85. 9. Banse K. Rates of growth, respiration, and photosynthesis of unicellular algae as related to cell size // A review, J. Phycol. 1976. V. 12. P. 135. 10. Barton A.D., Finkel Z.V., Ward B.A., Johns D.G. and Follows M.J. On the roles of cell size and trophic strategy in North Atlantic diatom and dinoflagellate communities // Limnol. Oceanogr. 2013. V. 58. № 1. P. 254–266. 11. Behrenfeld M.J. and others. Climate-driven trends in contemporary ocean productivity // Nature. 2006. V. 444. P. 752–755. 12. Brown C.W., Yoder J.A. Coccolithophorid blooms in the global ocean // Journal of Geophysical Research. 1994. V. 99. P. 7467-7482. 13. Chisholm S.W. Phytoplankton size // Primary productivity and biogeochemical cycles in the sea. Plenum, New York. 1992. P. 213–237. 14. Cokacar T., Kubilay N., Oguz T. Structure of E. huxleyi blooms in the Black Sea surface waters as detected by SeaWiFS imagery // Geophysical Research Letters. 2000. V. 28. P. 4607–4610. 15. Cokacar T., Oguz T., Kubilay N. Satellite-detected early summer coccolithophore blooms and their interannual variability in the Black Sea // Deep-Sea Research I. 2004. V. 51. P. 1017–1031. 16. Dale T., Rey F., Heimdal B. R. Seasonal development of phytoplankton at a high latitude oceanic site // Sarsia. 1999. V. 84. P. 419–435. 17. Droop M.R. The nutrient status of algal cells in continuous culture // J. Mar. Biol. Assoc. U.K. 1974.V. 54. P. 825–855. 18. Droop M.R. Vitamin B12 and marine ecology, IV: the kinetics of uptake, growth and inhibition in Monochrysis lutheri // J. Mar. Biol. Assoc. UK. V. 48. P. 689−733. 19. Egge J.K., Aksnes D.L. Silicate as regulating nutrient in phytoplankton competition // Mar. Ecol. Prog. Ser. 1992. V. 83. P. 281–289. 20. Egge J.K., Heimdal B.R. Blooms of phytoplankton including Emiliania huxleyi (Haptophyta). Effects of nutrient supply in different N:P ratios // Sarsia. 1994. V. 79. P. 333–348. 21. Falkowski P.G., Barber R.T., Smetacek V. Biogeochemical controls and feedbacks on ocean primary production // Science. 1998. V 281. P. 200–206. 22. Falkowski P.G., Katz M. E., Knoll A. H., Quigg A., Raven J. A., Schofield O., Taylor F. J. R. The evolution of modern eukaryotic phytoplankton // Science. 2004. V. 305. P. 354–360. 23. Falkowski P.G., Oliver M.J. Mix and match: how climate selects phytoplankton // Nature Reviews Microbiology. 2007. V. 5. P. 813–819. 24. Field C.B., Behrenfeld M.J., Randerson J.T. Primary production of the biosphere: integrating terrestrial and oceanic components // Science. 1998. V. 281. P. 237–240. 25. Finkel Z.V. Light absorption and size scaling of light-limited metabolism in marine diatoms // Limnol. Oceanogr. 2001. V. 46. P. 86–94. 26. Finkel Z.V., Beardall J., Flynn K.J., Quigg A., Rees T.V. and Raven J.A. Phytoplankton in a changing world: cell size and elemental stoichiometry // J. Plankton Res. 2010. V. 32. P. 119-137. 27. Finkel Z.V., Irwin A.J., Schofield O. Resource limitation alters the 3⁄4 size scaling of metabolic rates in phytoplankton // Mar. Eco. Prog. Ser. 2004. V. 273. P. 269–279. 28. Geider R. J., La Roche J. Redfeld revisited: variability of C:N:P in marine microalgae and its biochemical basis // Eur. J. Phycol. 2002. V. 37. P. 1-17. 29. Grover J.P. Influence of cell shape and size on algal competitive ability // J. Phycol. 1989. V. 25. P. 402–405. 30. http://www.algaebase.org. (Дата обращения 19.01.2015) 31. http://www.marinespecies.org. (Дата обращения 1.02.2015) 32. Jiang L., Schofield O. M. E., Falkowski P. G. Adaptive Evolution of Phytoplankton Cell Size // Am. Nat. 2005. V. 166. P. 496–505. 33. Key T., McCarthy A., Campbell D.A., Six C., Roy S., Finkel Z.V. Cell size trade‐offs govern light exploitation strategies in marine phytoplankton // Environmental Microbiology. 2010. V. 12. № 1. P. 95–104. 34. Klausmeier, C.A., Litchman, E., Daufresne, T., Levin, S.A. Optimal nitrogen-tophosphorus stoichiometry of phytoplankton // Nature. 2004. V. 429. P. 171–174. 35. Kopelevich O., Burenkov V., Sheberstov S., Vazyulya S., Kravchishina M., Pautova L., Silkin V., Artemiev V., Grigoriev A. Satellite monitoring of coccolithophore blooms in the Black Sea from ocean color data // Remote Sensing of Environment. 2014. V. 146. P. 113–123. 36. Krause J.W., Brzezinski M.A., Villareal T.A., Wilson C. Increased kinetic efficiency for silicic acid uptake as a driver of summer diatom blooms in the North Pacific subtropical gyre // Limnol. Oceanogr. 2012. V. 57. P. 1084–1098. 37. Litchman E, Klausmeier C.A. Schofield O.M., Falkowski P.G. The role of phytoplankton functional traits in structuring phytoplankton communities: scaling from cellular to ecosystem level // Ecol. Lett. 2007. V. 10. P. 1170–1181. 38. Litchman E., Klausmeier C.A. Trait-based community ecology of phytoplankton // Annu. Rev. Ecol. Evol. Syst. 2008. V. 39. P. 615–639. 39. Loebl M., Cockshutt A.M., Campbell D.A., and Finkel Z.V. Physiological basis for high resistance to photoinhibition under nitrogen depletion in Emiliania huxleyi // Limnol. Oceanogr. 2010. V. 55. № 5. P. 2150–2160. 40. López-Sandoval D.C., Rodríguez-Ramos T., Cermeño P., Sobrino C., Marañón E. Photosynthesis and respiration in marine phytoplankton: Relationship with cell size, taxonomic affiliation, and growth phase //Journal of Experimental Marine Biology and Ecology. 2014. V. 457. P. 151–159. 41. Maranon E. Cell size as a key determinant of phytoplankton metabolism and community structure // Annu. Rev. Mar. Sci. 2015. V. 7. P. 241-264. 42. Menden-Deuer S., Lessard E. J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol. Oceanogr. 2000. V. 45. № 3. P. 569-579 43. Milliman J. D. Production and accumulation of calcium carbonate in the ocean: budget of a non-steady state //Glob. Biogeochem. Cycles. 1993. V. 7. P. 927-957. 44. Paasche E. A review of the coccolithophorid Emiliania huxleyi (Prymnesiophyceae), with particular reference to growth, coccolith formation, and calcification–photosynthesis interactions // Phycologia. 2002. V. 40. P. 503–529. 45. Raven J.A. Small is beautiful: the picophytoplankton // Functional Ecology. 1998. V. 12. P. 503–513. 46. Raven J.A. The evolution of autotrophy in relation to phosphorus requirement // Journal of Experimental Botany. 2013. V. 64. N. 13. P. 4023–4046. 47. Riegman R., Stolte W., Noordeloos A.A.M., Slezak D. Nutrient uptake and alkaline phosphatase (ec 3:1:3:1) activity of Emiliania huxleyi (PRYMNESIOPHYCEAE) during growth under n and p limitation in continuous cultures // J. Phycol. 2000. V. 36. P. 87-96. 48. Silkin V.A., Pautova L.A., Lifanchuk A.V. Physiological regulatory mechanisms of the marine phytoplankton community structure // Russian Journal of Plant Physiology. 2013. V. 60. №. 4. P. 541–548. 49. Silkin V.A., Pautova L.A., Mikaelyan A.S. Role of phosphorus in regulation of Emiliania huxleyi (Lohm.) Hay et Mohl. (Haptophyta) blooms in the northeastern Black Sea // Int. j. on algae. 2009. V. 11. №3. P. 211-221. 50. Silkin V.A., Pautova L.A., Pakhomova S.V., Lifanchuk A.V., Yakushev E.V., Chasovnikov V.K. Environmental control on phytoplankton community structure in the NE Black Sea // Journal of Experimental Marine Biology and Ecology. 2014. V. 461. P. 267–274. 51. Smetacek V. Making sense of ocean biota: How evolution and biodiversity of land organisms differ from that of the plankton // J. Biosci. 2012. V. 37.P. 589–607. 52. Smith, R. E., Kalff J. Size-dependent phosphorus uptake kinetics and cell quota in phytoplankton // J. Phycol. 1982. V. 18. P. 275-284. 53. Sommer U., Adrian R., Domis L.D.S., Elser J.J., Gaedke U., Ibelings B., Jeppesen E., LЁurling M., Molinero J. C., Mooij W. M., van Donk E., Winder M. Beyond the plankton ecology group (PEG) model:mechanisms driving plankton succession // Annu. Rev. Ecol. Evol. Syst. 2012. V. 43. P. 429–448. 54. Sommer U., Gliwicz Z.M., Lampert W. & Duncan A. The PEG-model of seasonal succession of planktonic events in fresh waters // Arch. Hydrobiol. 1986. V. 106. P. 433–471. 56. Tambi, H., Flaten G.A.F., Egge J.K., Bodtker G., Jacobsen A. and Thingstad T.F. Relationship between phosphate affinities and cell size and shape in various bacteria and phytoplankton // Aquat. Microb. Ecol. 2009. V. 57. P. 311–320. 57. Taylor J.R. and Ferrari R. Shutdown of turbulent convection as a new criterion for the onset of spring phytoplankton blooms // Limnol. Oceanogr. 2011. V. 56. P. 2293–2307. 58. Throndsen J., Hasle G.R., Tangen K. Norskkystplanktonflora. Almater Forlag AS, Oslo, 2003. 341 pp. 59. Tilman D. Resource competition between planktonic algae: an experimental and theoretical approach // Ecology. 1977. V. 58. P. 338–348. 60. Tilman D., Kilham S.S., Kilham P. Phytoplankton community ecology: the role of limiting nutrients // Annual Review of Ecology and Systematics. 1982. V. 13. P. 349-372. 61. Tilman D., Mattson M., Langer S. Competition and nutrient kinetics along a temperature gradient: An experimental test of a mechanistic approach to niche theory // Limnol. Oceanogr. 1981. V. 26. № 6. P. 1020–1033. 62. Tomas C.R. Identifying Marine Phytoplankton. Academic Press. San-Diego. 1997. 858 pp. 63. Winder M., Cloern J.E. The annual cycles of phytoplankton biomass // Phil. Trans. R. Soc. B. 2010. V. 365. P. 3215–3226. 64. Yakushev E.V., Arhipkin V.S., Antipova E.A., Kovaleva I.N., Chasovnikov V.K., Podymov O.I. Seasonal and interannual variability of hydrology and nutrients in the Northeastern Black Sea // Chemistry and Ecology. 2007. V. 23. P. 29–41. Статья поступила в редакцию 6.02.2015.
Morphological and physiological strategies of phytoplankton communities Vladimir A. Silkin, Larisa A. Pautova, Anna V. Lifanchuk, Aleksey V. Fedorov The main morphological and physiological strategies of phytoplankton community structure of the north-eastern part of the Black Sea were revealed. In the spring, the main role in the formation of phytoplankton community plays morphological and physiological characteristics such as the maximum specific growth rate and the small cells size of diatoms (strategy of maximal growth rate). In late spring - early summer coccolithophores is dominant species which has low half-saturation constant for nitrogen uptake (affinity strategy). In summer prevail large cell species of diatom, which are able to accumulate nutrients but having a low growth rate (storage strategy). Key words: phytoplankton; coccolitophores; diatom algae; maximum specific growth rate; half-saturation constant; north-eastern part of the Black Sea.
Об авторах Силкин Владимир Арсентьевич - Silkin Vladimir Arsentyevitch доктор биологических наук
Паутова Лариса Альбертовна − Pautova Larisa Albertovna кандидат биологических наук
Лифанчук Анна Викторовна − Lifanchuk Anna Viktorovna младший научный сотрудник, Южное отделение ФГБУН «Институт океанологии им.П.П.Ширшова РАН», Геленджик, Россия (Southern branch of the P.P. Shirshov Institute of Oceanology RAS, Gelendzhik, Russia)
Фёдоров Алексей Владимирович − Fedorov Aleksey Vladimirovich инженер-исследователь, Южное отделение ФГБУН «Институт океанологии им.П.П.Ширшова РАН», Геленджик, Россия (Southern branch of the P.P. Shirshov Institute of Oceanology RAS, Gelendzhik, Russia)
Корреспондентский адрес: Россия, 353470, Краснодарский край, г. Геленджик, ул. Просторная 1-г. Телефон/факс 8-861-41-280-89.
ССЫЛКА НА СТАТЬЮ: Силкин В.А., Паутова Л.А., Лифанчук А.В., Федоров А.В. Морфофизиологические стратегии фитопланктонных сообществ // Вопросы современной альгологии. 2015. № 1 (8). URL: http://algology.ru/651
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮ
|
||||||||||||||||||
|
| |||||||||||||||||