Жизненный цикл, наследование, биогенез, биохимический состав, спектральные свойства и структурно-функциональная организация хлоропластов Chlamydomonas reinhardtii
The life cycle, inheritance, biogenesis, biochemical composition,
spectral properties and structural-functional organization
of chloroplasts Chlamydomonas reinhardtii
Ладыгин В.Г.
Vladimir G. Ladygin
Институт фундаментальных проблем биологии РАН
(г. Пущино Московской области)
УДК 575.24:581.132:581.174.1:582.264
Обзор посвящен актуальным и важным вопросам исследования генетического контроля, молекулярной организации и функционирования фотосистем в хлоропластах Chlamydomonas reinhardtii Dang. Показана наследственная непрерывность хлоропластов в процессе вегетативного и полового клеточных циклов. Изучены структурные изменения хлоропластной ДНК в процессе формирования дочерних клеток. С помощью пигментных мутантов впервые описаны все этапы биогенеза мембранной системы хлоропластов от единичных пузырьков до макрогран. В работе даны современные представления о биохимическом составе, структурной организации фотосистем I и II, их пространственной локализации в тилакоидах. Определены величины и число фотосинтетических единиц, изучена их функциональная активность. С помощью двойных и тройных мутантов впервые установлена закономерность распределения спектральных форм и максимумов флуоресценции хлорофилла для нативных комплексов фотосистем в клетках in vivo. Рассмотрены современные представления о молекулярной организации фотосистем в хлоропластах эукариот.
Обзор сделан на базе одноименной монографии (объемом 161 с.), опубликованной в Приложении к журналу «Вопросы современной альгологии» – http://algae.ru/634, которая будет полезна широкому кругу специалистов и ученых: генетиков, биохимиков, биофизиков и физиологов растений, а также преподавателям, аспирантам и студентам биологических вузов в качестве учебника.
Ключевые слова: Chlamydomonas reinhardtii; мутанты; биогенез; наследование; хлоропласты; пигменты; генетический контроль; биохимический состав; спектральные свойства; активность фотосистем; ультраструктура мембран; молекулярная организация ФС-I и ФС-II.
Введение
Одноклеточная гаплоидная гетероталличная изогамная зеленая водоросль Chlamydomonas reinhardtii является классическим модельным объектом для генетических, биохимических, биофизических, цитологических и физиологических исследований. Наличие одноклеточной вегетативной и зиготной стадий, легкость проведения генетического анализа мутантов дает возможность изучать тонкую структуру таких клеточных органелл как ядро, хлоропласт, митохондрии, пиреноид и глазное пятно (стигма). В настоящее время уже имеются пигментные, нефотосинтезирующие, морфологические, физиологические и ауксотрофные мутантные штаммы этого организма (Sager, 1955; Levine, Ebеrsold, 1960; Levine, 1968; Ладыгин, 1988, 1991, 1998, 2014; Harris, 1989, 2001, 2009).
Характеристика клеток Chlamydomonas reinhardtii
Вегетативные клетки водоросли имеют овальную слегка удлиненную форму 5–8 мкм в ширину и 8–15 мкм в длину (рис. 1). При выращивании в жидкой среде клетки подвижны. Они плавают при помощи пары жгутиков, расположенных на переднем конце клетки. Длина жгутиков у Chlamydomonas варьирует от 15 до 30 мкм. Две трети объема клетки занимает единственный зеленый чашеобразный хлоропласт. В центре его нижней части находится пиреноид – сферическое тело около 2 мкм в диаметре, окруженное одним рядом крахмалоносных пластинок (Ладыгин, 1998).
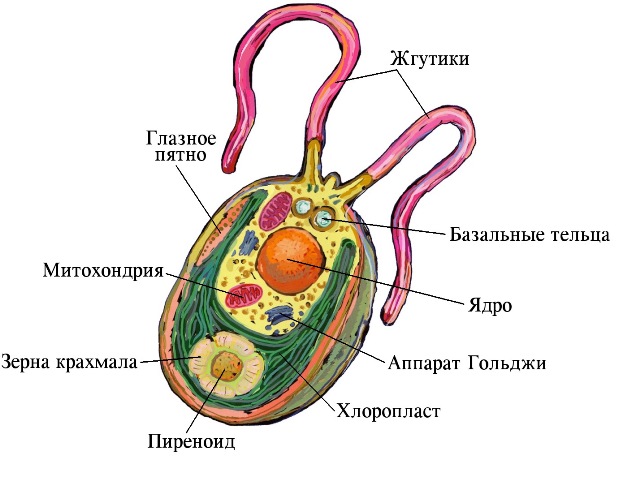
Рис. 1. Продольный срез вегетативной клетки Chlamydomonas reinhardtii (Ладыгин, 2014).
Глазное пятно расположено вблизи переднего края хлоропласта непосредственно под оболочкой и слегка выдается наружу хлоропласта, как маленькая выпуклость. Оно желтого или оранжевого цвета, состоит из 2–3 рядов гранул гомогенного липидно-каротиноидного вещества (Ладыгин, Семенова, 2013, 2014; Ладыгин, 2014). Сверху это тело дисковидной формы около 1 мкм в диаметре, а сбоку имеет палочковидную или эллипсовидную форму.
Между оболочкой клетки и хлоропластом, а также в цитоплазме около ядра, расположены митохондрии. Передняя треть клетки содержит ядро, аппарат Гольджи, сократительные вакуоли, рибосомы и другие включения цитоплазмы.
Систематическое положение одноклеточной зеленой водоросли Chlamydomonas reinhardtii следующее:
Тип Algae
Подтип Chlorophyta
Класс Euchorophyceae
Порядок Volvocales
Род Chlamydomonas
Вид Chlamydomonas reinhardtii Dang.
Полагают, что из Chlorophyta, по-видимому, произошли все высшие растения, а также и многие многоклеточные водоросли (Smith, 1950). Однако, как флагеллят, Chlamydomonas относят к примитивным Protozoa. Эта двойственность в классификации подтверждается цитологическими исследованиями. Водоросль содержит типичную органеллу растительной клетки – хлоропласт, внедренный в цитоплазму, которая по своей организации подобна цитоплазме животных клеток (хорошо развитые аппарат Гольджи, митохондрии, наличие светочувствительного органа – стигмы или глазного пятна и др.) (Sager, Palade, 1957). Кроме того, клетки обладают подвижностью за счет пары жгутиков (рис. 1).
Жизненный цикл Chlamydomonas reinhardtii
Жизненный цикл Chlamydomonas reinhardtii впервые описан Рейнхардом в 1876 году (цит. по Sager, Granick, 1953). Он состоит из двух стадий (рис. 2) – вегетативной (бесполой или митотической) и половой (зиготной или мейотической). Водоросль Chlamydomonas reinhardtii имеет два «половых» типа, условно обозначенных как (+) и (–) типы спаривания: (mating type) mt (+) и mt (–).
Вегетативные клетки хламидомонады гаплоидные. Они могут неограниченное время культивироваться, как на агаризованной, так и в жидких средах, размножаясь митотически.
Однако, в определенных условиях они могут вести себя как гаметы, спариваясь и сливаясь с клеткой противоположного «полового» типа с образованием диплоидной зиготы. Никаких морфологических различий между вегетативными клетками и гаметами не обнаружено, но по способности гамет к спариванию и слиянию можно сделать вывод о существовании биохимических различий между вегетативными клетками и гаметами.
В настоящее время известно, что вегетативные клетки Chlamydomonas reinhardtii могут дифференцироваться в гаметы только тогда, когда они израсходуют свои азотные запасы. Указанием на то, что дифференциация гамет может контролироваться путем изменения количества азота в среде, подтверждается двумя фактами.
1. Клетки, выращенные на свету и отобранные на логарифмической фазе роста, негаметичны. Если такие клетки, различающиеся по «половому» знаку, смешать, то они не сольются. Однако же, если клетки выращивать 2–4 суток на безазотной ацетатной среде или предварительно суспензировать их в бидистиллированной воде (каждый в отдельности), то после 3–5 часов пребывания на свету они, израсходовав свои азотные запасы, превращаются в гаметы, что подтверждается фактом слияния их при смешении с образованием зигот. У Chlamydomonas reinhardtii только клетки зиготы диплоидные, а вегетативные клетки, гаметы и дочерние зооспоры – гаплоидные.
Вегетативные клетки старых культур, помещенные в бидистиллированную воду, требуют значительно меньше времени освещения для превращения их в гаметы и, наконец, потребность в свете для клеток из весьма старых культур при формировании гамет может быть совсем утрачена. Очевидно, свет необходим не для копуляции, а для биохимических изменений в вегетативных клетках, которые превращаются затем в гаметы, так как потребность в свете может быть удовлетворена еще до смешения противоположных «половых» типов.
По-видимому, свет может действовать фотосинтетически в этом процессе, создавая «излишки» углеводов в виде крахмала, что связано с другими запасами, в частности, азотными. Это было хорошо показано с использованием сред с высоким и низким содержанием азота. В среде с низким содержанием азота или его отсутствием дифференциация гамет проходила гораздо быстрее, чем в среде с высоким его содержанием.
2). Ключевая роль азота была показана при изучении обратимости процесса гаметообразования. Когда активные (+) и (–) гаметы отдельно друг от друга суспензировали в минимальной азотсодержащей среде, то они быстро превращались в вегетативные клетки и теряли способность к копуляции при смешивании.
При испытании всех компонентов среды было показано, что только азотные соединения (любые), которые клетки могли использовать в качестве источника азота, обладают ингибирующим эффектом. Азотное ингибирование копуляции может быть снято путем отмывания и ресуспензирования клеток в безазотной среде на свету, что снова приводит к образованию гамет и возвращению способности к спариванию.
Таким образом, можно сделать вывод, что для формирования гамет необходимо азотное истощение. Свет, когда он требуется для гаметообразования, действует фотосинтетически. В азотно-истощенных клетках свет не требуется вообще ни на одном из звеньев процесса формирования зигот. Особо следует отметить, что в процессе формирования гамет вегетативные клетки всегда теряют клеточную стенку и остаются покрытыми только плазмалеммой, что облегчает слияние гамет. И обратный процесс, если гаметы покрываются клеточной стенкой, они превращаются в вегетативные клетки и теряют способность к образованию зигот.
Такие приемы стимулирования половых процессов известны и для других микроорганизмов и водорослей, в том числе, путем повышения концентрации ионов кальция в среде. Лучшие результаты для получения и развития зигот Chlamydomonas reinhardtii дает минимальная среда с 0.1%-ным ацетатом натрия, так как зиготы плохо растут на высоко фосфатной ацетатной среде.
Половой процесс у Chlamydomonas reinhardtii считается изогамным, так как гаметы обоих штаммов морфологически неотличимы. На наш взгляд было бы правильнее называть его гологамией на основании двух фактов: 1 – морфологическая неразличимость вегетативных и половых клеток и 2 – способность не только вегетативных клеток дифференцироваться в гаметы, но и (что особо стоит отметить) способность гамет превращаться в вегетативные клетки. Можно считать, что в половом процессе участвуют претерпевшие биохимические изменения и утратившие клеточную стенку вегетативные клетки (называемые гаметами, так как они участвуют в половом процессе), которые, сливаясь попарно, дают зиготы, как и в результате любого полового процесса. В данном случае слово «гамета» также несколько условно, так как оно отражает лишь биохимическую, физиологическую и функциональную способность клетки к слиянию.
При смешении гамет противоположных «половых» типов сразу же наблюдается группирование (+) и (–) гамет. Спустя короткое время они начинают спариваться, то есть склеиваться попарно и сливаться. Процесс этот продолжается 10–30 мин с момента начала спаривания. Слияние клеток заканчивается образованием двуядерных, четырехжгутиковых, диплоидных зигот (Ладыгин и др., 1975).
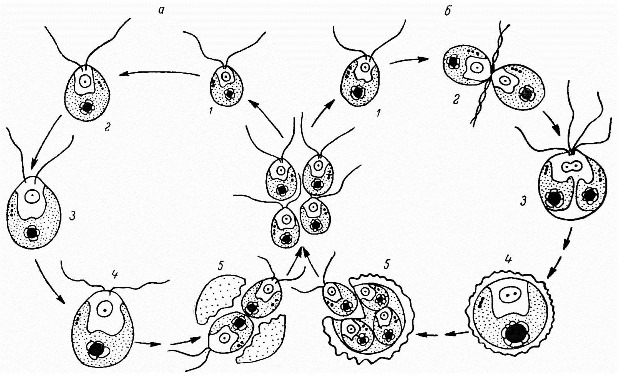
Рис. 2. Схема жизненного цикла Chlamydomonas reinhardtii, показывающая наличие двух типов размножения:
а – бесполое размножение, вегетативный или митотический клеточный цикл: 1–3 – рост вегетативной клетки, 4 и 5 – митотическое деление и выход дочерних зооспор.
б – половое размножение, зиготный или мейотический клеточный цикл: 1 – гамета, 2 – слияние (+) и (–) гамет, 3 – молодая, четырехжгутиковая зигота, 4 и 5 – мейотическое деление ядра и выход дочерних зооспор (Ладыгин и др., 1974, 1975).
Спаривание прекращается после посева клеток на минеральную агаризованную среду, и только те клетки, которые начали сливаться до посева, развиваются в зрелые зиготы.
Слившиеся клетки теряют жгутики, а затем и оболочки, и молодые зиготы оказываются окруженными первичной мембраной – плазмалеммой. Образование этой мембраны происходит до слияния ядер гамет при освещении 5–6 тысяч люкс. Освещение необходимо в первые 18–24 часа, так как только в условиях освещения начинает формироваться настоящая оболочка зиготы.
Одновременно с образованием оболочки зиготы идет ее рост, в результате которого зигота увеличивается в объёме более чем в два раза и оказывается покрыта плотной оболочкой. Она обладает грубой ретикулярной структурой и имеет целлюлозную перегородку. Толщина и плотность оболочки зависит от интенсивности освещения и ее продолжительности в процессе созревания зиготы. Зрелая зигота длительное время может переживать неблагоприятные условия среды обитания.
К моменту созревания зигота достигает 18–25 мкм в диаметре, что примерно вдвое больше ее исходного диаметра и диаметра одной вегетативной клетки. Продолжительность периода созревания зависит от температуры. При 25°С оно происходит в течение шести суток. Причем, только в первые 18–24 часа они нуждаются в освещении, а затем зиготы созревают в темноте. По окончании периода созревания зиготы могут быть вызваны к прорастанию путем переноса их на свежую агаризованную среду и помещением на свет. Время, необходимое для их прорастания, варьирует от 15 до 24 часов и зависит, в частности, от генотипа зигот. При прорастании оболочка зиготы разрывается, и освобождаются четыре или более, часто восемь, подвижных гаплоидных зооспор. Эти клетки представляют собой продукты мейоза и одного митотического деления и способны к неограниченному вегетативному росту.
Таким образом, жизненный цикл хламидомонады (Chlamydomonas reinhardtii) включает в себя два типа клеточных делений: бесполое – вегетативный или митотический клеточный цикл – и половое – зиготный или мейотический клеточный цикл (рис. 2). Мы детально исследовали ключевые периоды обоих клеточных делений, отмеченные на схеме двумя стрелками.
Наследственная непрерывность хлоропласта при вегетативном размножении Chlamydomonas reinhardtii
Электронно-микроскопическое исследование деления хлоропласта одноклеточной зеленой водоросли Chlamydomonas reinhardtii в процессе митотического деления клетки показало, что, до тех пор, пока деление ядра не завершилось, деление хлоропласта не наблюдается. Пиреноид, локализованный в центре пластиды, и глазное пятно могут делиться до начала деления хлоропласта (рис. 3). Однако были отмечены случаи, когда пиреноид делился одновременно с делением хлоропласта, предварительно увеличиваясь в размерах и удлиняясь в сторону, перпендикулярную образующейся клеточной перегородке. Никаких доказательств разрушения пиреноида или образования de novo обнаружено не было. Показано изменение плотности и месторасположения ДНК-содержащих областей пластиды, что может быть связано с функционированием и распределением генов пластома. Тот факт, что хлоропласт делится путем сжатия и разделения его центральной части задолго до того момента, когда клеточная перегородка сформируется в этом участке, указывает на наличие механизма, обеспечивающего четкое деление хлоропласта пополам и распределение полухлоропластов в дочерние клетки.
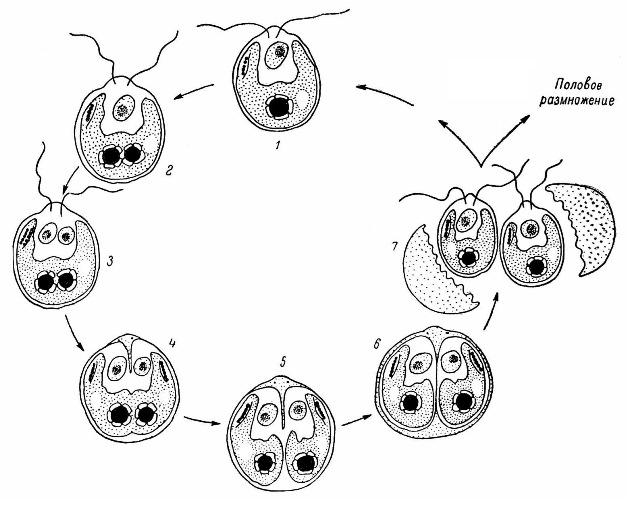
Рис. 3. Схема деления ядра и хлоропласта при вегетативном размножении.
1 – взрослая вегетативная клетка, 2 – начало митотического деления ядра и деление пиреноида в хлоропласте, 3–5 – цитокинез и формирование двух полухлоропластов, 6 и 7 – соответственно образование и выход зооспор (Ладыгин и др., 1974).
Наследственная непрерывность хлоропласта при половом размножении Chlamydomonas reinhardtii
Электронно-микроскопическим методом показано, что единственный хлоропласт зиготы Chlamydomonas reinhardtii образуется путём слияния двух пластид гамет (рис. 4). Слияние ядер происходит раньше начала слияния хлоропластов. Объединение хлоропластов начинается только тогда, когда слияние ядер почти закончено, что может указывать на важную роль генома ядра в процессе формирования хлоропласта зиготы. При формировании и созревании зиготы имеют место утилизация крахмала и полное восстановление мембранной организации хлоропласта зиготы, частично редуцированной в пластидах гамет в процессе азотного голодания. Мейотическое деление ядра зрелой зиготы сопровождается делением хлоропласта зиготы на число, кратное числу образующихся зооспор, что обеспечивает непрерывность хлоропласта в процессе полового размножения. Обсуждаются возможные пути регуляции ламеллярной системы фотосинтетического аппарата в процессе зооспорогенеза.
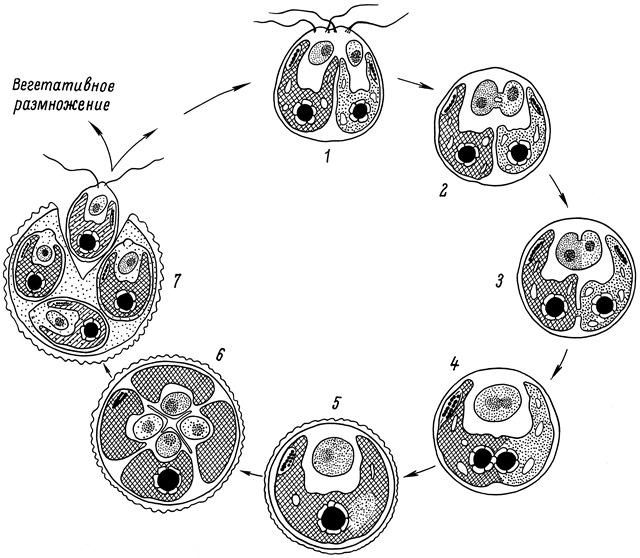
Рис. 4. Схема формирования «диплоидного» хлоропласта зиготы и гаплоидных пластид зооспор в процессе полового размножения.
1–5 – формирование одного диплоидного ядра зиготы из двух гаплоидных ядер родительских (+) и (–) гамет и «диплоидного» хлоропласта зиготы из зеленого хлоропласта (–) гаметы дикого типа К(–) и желтого хлоропласта (+) гаметы желтого мутанта Ж-4(+); 6 – редукционное деление ядра в процессе мейоза с образованием 4-х гаплоидных ядер дочерних зооспор, а также деление материнского хлоропласта зиготы с образованием 4-х «гаплоидных» хлоропластов дочерних зооспор; 7 – цитокинез материнской клетки и выход 4-х дочерних зооспор из оболочки зиготы (Ладыгин и др., 1975).
Установлено, что в вегетативных клетках и в зиготах Chlamydomonas reinhardtii ДНК-содержащая область хлоропласта претерпевает структурные изменения (спирализация и деспирализация ДНК) (Семенова и др., 1978).
В хлоропластах зигот хламидомонады обнаружено уплотнение фибрилл ДНК в плотные тела, подобные митотическим хромосомам, которые расположены в ДНК-содержащих областях свободных от мембран тилакоидов (рис. 5). Возможно, что уплотнение хлоропластной ДНК необходимо для упорядоченного расхождения копий ДНК пластома в дочерние хлоропласты. Ранее нами была описана конденсация ДНК в делящихся хлоропластах, как в вегетативных клетках, так и в зиготах Chlamydomonas reinhardtii (Семенова и др., 1978).
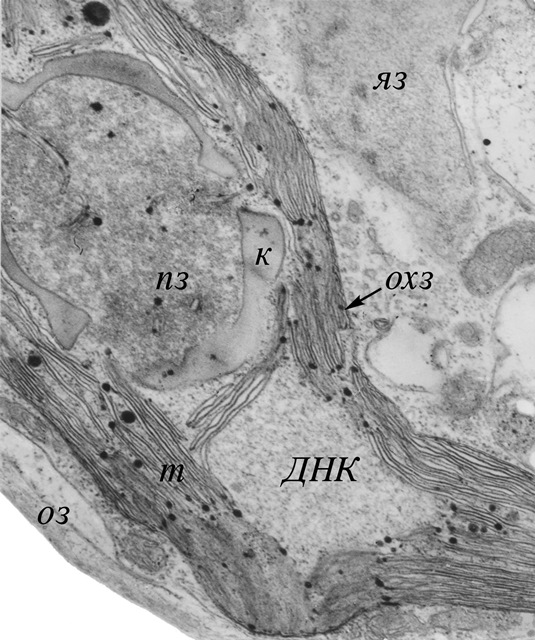
Рис. 5. Ультраструктурная организация зиготы после 6 суток созревания в темноте на минеральной среде. Зигота содержит одно диплоидное ядро, один «диплоидный» хлоропласт, содержащий ДНК (ДНК) от обеих родительских гамет, и сформированную толстую оболочку зиготы. Увеличение: 60000×.
яз – ядро зиготы, охз – оболочка хлоропласта зиготы, пз – пиреноид зиготы, ДНК – ДНК-содержащая область зиготы, т – тилакоиды, к – крахмал, оз – оболочка зиготы (Ладыгин и др., 1973).
Биогенез мембранной системы хлоропластов у мутантов Chlamydomonas reinhardtii
Мы провели исследования пигментов и структурной организации пластид четырех типов мутантов Chlamydomonas reinhardtii: белого, двух желтых, двух светло-зеленых и темно-зеленого. Показано, что пластида белого мутанта, по размерам мало отличающаяся от контрольной, заполнена только матриксом. Развитие ее ламеллярных структур блокировано на стадии формирования пузырьков в результате отсутствия пигментов. Накопление значительного количества каротиноидов у желтых мутантов сопровождается образованием большого числа пузырьков, по-видимому, без хлорофилла. Мутанты, восстанавливающие синтез хлорофилла на свету, в процессе зеленения вначале формируют проламеллярное тело, а затем – и тилакоиды. Уменьшение содержания пигментов в 2–3 раза у светло-зеленых мутантов сопровождается редукцией ламеллярной системы до стадии формирования единичных тилакоидов. Повышенное накопление пигментов у темно-зеленых мутантов по сравнению с контрольным сопровождается формированием большого числа тилакоидов, заполняющих практически весь матрикс хлоропласта (рис. 6). На основании обнаружения всех основных этапов формирования ламеллярной системы хлоропластов от единичных пузырьков до упаковки тилакоидов в стопки, свойственных высшим растениям, доказывается принципиальная идентичность организации мембранных структур хлоропластов изучаемой водоросли и высших растений.
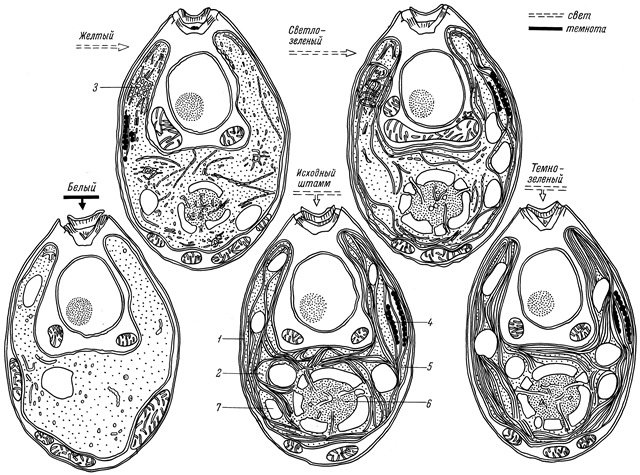
Рис. 6. Схема развития мембранной системы хлоропласта Chlamydomonas reinhardtii от образования единичных пузырьков у белого мутанта и проламеллярного тела у желтого мутанта, единичных тилакоидов и небольших гран у светло-зеленого мутанта, хорошо развитых гран у исходного дикого типа и полностью заполненного тилакоидами хлоропласта у темно-зеленого мутанта (Ладыгин и др., 1973).
1 – клеточная стенка, 2 – матрикс, 3 – проламеллярное тело, 4 – глазное пятно, 5 – тилакоиды, 6 – пиреноид, 7 – крахмал.
Локализация и функции каротиноидов в хлоропластах
Chlamydomonas reinhardtii
В настоящее время ведутся активные исследования по изучению функциональной роли каротиноидов и их локализации в мембранах хлоропластов. За предыдущие 10–15 лет были достигнуты значительные успехи в изучении процесса биосинтеза каротиноидов и его генетического контроля (Britton, 1998; Hirschberg, 1998; Ладыгин, 2002, 2014a, 2014b). Однако в вопросах локализации каротиноидов и их функционирования остается еще очень много неясного. Разноплановость полученных результатов и значительные успехи по отдельным вопросам обусловили необходимость обобщения этих результатов с целью освещения современного состояния функциональной значимости каротиноидов и участия их в фотохимических реакциях процесса фотосинтеза.
Каротиноиды являются широко распространенным классом пигментов, обнаруженных в природе. Они встречаются у бактерий, грибов, водорослей, растений и животных. В настоящее время известно более 800 видов каротиноидов (Карнаухов, 2000). Это большая группа желтых, оранжевых или красных пигментов, которые представляют собой полиеновые соединения преимущественно с 40 атомами углерода, построенные из изопреновых (С5) единиц (обычно из восьми). Различают две группы каротиноидов: каротины и ксантофиллы. Каротины – это углеводороды, которые содержат в своем составе только атомы углерода и водорода. Ксантофиллы – это кислород-содержащие производные каротинов, которые, помимо атомов углерода и водорода, имеют атомы кислорода в виде гидрокси- (–ОН), эпокси- (–O–) и оксо- (=O) групп (Ладыгин, 2000, 2002, 2014; Britton, 1998). Считается, что каротины принимают участие в организации и функционировании основных (core) комплексов реакционных центров фотосистем (Hashimoto, Koyama, 1990), в то время как ксантофиллы участвуют в организации вспомогательных светособирающих (антенных) комплексов фотосистем (Ладыгин, 2014; Ruban et al., 2001).
К основным функциям каротиноидов можно отнести светособирающую, структурную и фотозащитную. Важная фотозащитная роль каротиноидов связана с механизмом нефотохимического тушения флуоресценции хлорофилла и участием их в обратимых реакциях ксантофилловых циклов: виолаксантинового, лютеин-5,6-эпоксидного и диадиноксантинового (рис. 7) (Ладыгин, 2008; Ладыгин, Ширшикова, 2006). Анализу последних достижений по этим вопросам посвящена монография (Ладыгин, 2014) и данная работа. Кроме того, определенные каротиноиды, главным образом, каротины глазного пятна участвуют в фототаксисе Chlamydomonas reinhardtii (Ладыгин, Семенова, 2013, 2014; Ладыгин, 2014а).
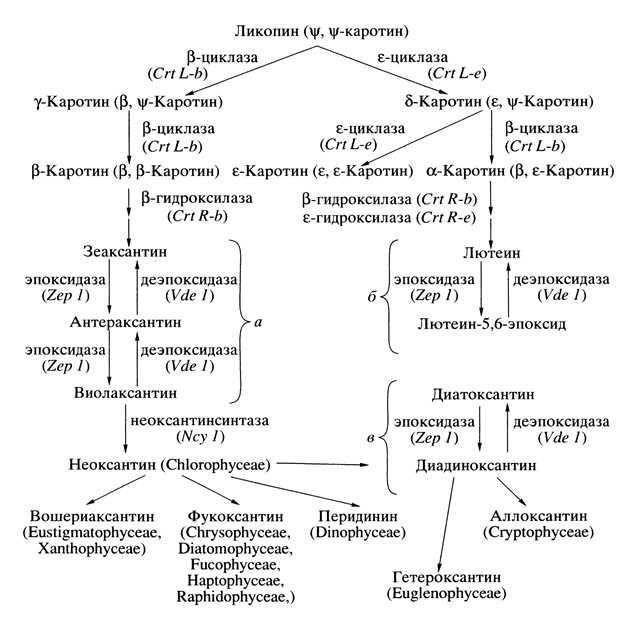
Рис. 7. Пути биосинтеза основных каротиноидов в хлоропластах эукариот. Показано три типа ксантофилловых циклов: виолаксантинового (а), лютеин-5,6-эпоксидного (б) и диадиноксантинового (в). В нижней части схемы перечислены основные ксантофиллы, выполняющие светособирающую функцию у разных таксонов водорослей (Ладыгин, 2002, 2014; Macpherson, Hiller, 2003; Scheer, 2003).
Биосинтез хлорофилла в клетках Chlamydomonas reinhardtii и других эукариот
Хлорофиллы – уникальные природные тетрапирролы, играющие ключевую роль не только в жизни фотосинтезирующих организмов, но и всей биосферы. Их биосинтез связан с морфогенезом растительной клетки и реакциями фотосинтеза – запасанием и использованием энергии света. Для изучения метаболизма хлорофиллов широко используются пигментные мутанты Chlamydomonas reinhardtii и высших растений (арабидопсиса, табака, ячменя) и фотосинтезирующих микроорганизмов. Применение методов генетического анализа, генной инженерии, геномики, протеомики и биоинформатики позволило не только идентифицировать гены, контролирующие ферменты, задействованные в этих процессах, но и установить механизмы их регуляции (Ладыгин, 2006; Чекунова, Ладыгин, 2013, 2014). Современное состояние генетических исследований и все этапы биосинтеза от глутаминовой кислоты до хлорофилла а и хлорофилла b коротко отражены в настоящем обзоре. Подробный анализ всей цепи биосинтеза хлорофилла рассмотрен в монографиях 2013 и 2014 годов (Чекунова, Ладыгин, 2013, 2014).
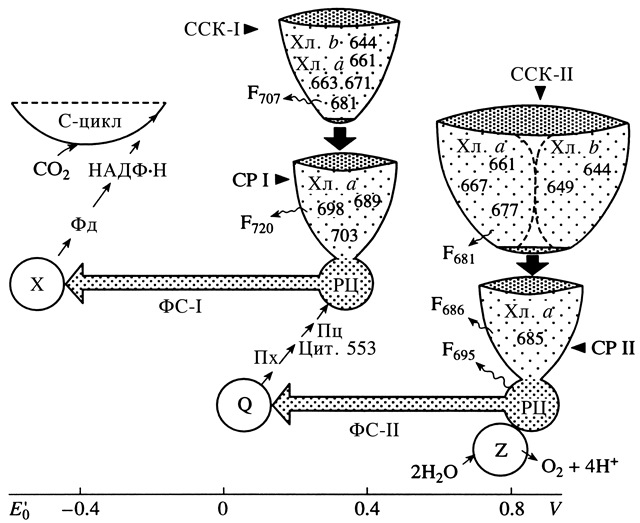
Рис. 8. Схема 4-х компонентной организации фотосистем, показывающая закономерность распределения спектральных форм хлорофилла между пигмент-белковыми комплексами и полосы излучения флуоресценции каждого из них. F – флуоресценция, Z – комплекс фотоокисления воды, Хл – хлорофилл, С-цикл – углеродный цикл (Ладыгин, 1998).
Биохимический состав, спектральные свойства, функциональная активность и структурная организация ФС-I и ФС-II Chlamydomonas reinhardtii
С помощью мутагенов (N-нитрозоэтилмочевины, УФ-С-излучения и гамма-радиации) были получены одинарные, двойные и тройные мутанты с нарушением синтеза одного, двух или трех пигмент-белковых комплексов фотосистем (Ладыгин, 1970; 1988; 1991; 1998). Установлены спектральные формы хлорофилла и полосы излучения флуоресценции (рис. 8), характерные для каждого из 4-х нативных хлорофилл-белковых комплексов: реакционных центров ФС-I, ФС-II и связанных с ними светособирающих комплексов I и II (ССК-I и ССК-II) соответственно (Ладыгин, 1998). Показано, что до 60–70% молекул хлорофилла входит в состав светособирающих комплексов и лишь 25–30% молекул хлорофилла а составляют антенну реакционных центров ФС-I и ФС-II. Изучены фотохимические свойства и проведена количественная оценка величины фотосинтетической единицы и числа реакционных центров ФС-I и ФС-II и обнаружено, что потеря светособирающих хлорофилл-белковых комплексов ССК-I и ССК-II не приводит к уменьшению числа реакционных центров ФС-I и ФС-II в расчете на хлоропласт (Ладыгин, 1998).
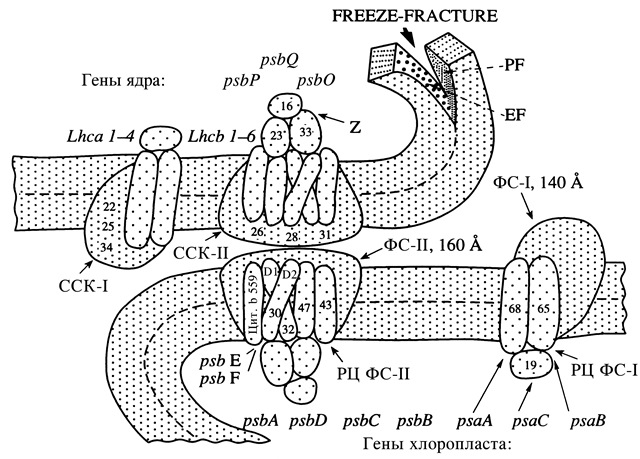
Рис. 9. Схема пространственной локализации хлорофилл-а-белкового комплекса реакционного центра ФС-II (СР-II) и ее светособирающего хлорофилл-а/b-белкового комплекса II (ССК-II) в 160Å частицах на ЕFs-поверхности гранальных участков тилакоидов, а также хлорофилл-а-белкового комплекса реакционного центра ФС-I и ее светособирающего хлорофилл-а/b-белкового комплекса I (ССК-I) в 140Å частицах на РFu-поверхности межгранных участков тилакоидов. Цифрами показаны молекулярные массы основных полипептидов, входящих в состав каждого из комплексов. В соответствии с последовательностью расположения полипептидов дан перечень генов, контролирующих их синтез (Ладыгин, 1998). Z – комплекс фотоокисления Н2О; EF (the exoplasmic face) – внутренняя гидрофобная поверхность скола, PF (the protoplasmic face) – внешняя гидрофобная поверхность скола мембран тилакоидов; freeze-fracture – метод замораживания-скалывания; Lhca 1–4 и Lhcb 1–6 – гены, контролирующие синтез полипептидов CCK-I и CCK-II соответственно.
Установлено, что каждый из 4-х хлорофилл-белковых комплексов может автономно принимать участие в образовании мембранной системы хлоропластов. Если мембраны тилакоидов формировались за счет двух или только одного из хлорофилл-белковых комплексов, например, ФС-II, то стехиометрическая плотность этих белковых частиц на 1 мм2 внутренней (ЕF) гидрофобной поверхности скола увеличивалась соответственно в 2 или 4 раза. Нами предложена принципиальная схема (рис. 8) организации фотосистем зеленых водорослей и высших растений (Ладыгин, 1998). Она основана на том, что хлорофилл-а-белковый комплекс реакционного центра ФС-II вместе со светособирающим хлорофилл-а/b-белковым комплексом II (ССК-II) входит в состав 160Å частиц, локализованных на внутренней (ЕF) гидрофобной поверхности скола мембран тилакоидов в области гран, а хлорофилл-а-белковый комплекс реакционного центра ФС 1 - вместе со светособирающим хлорофилл-а(или а/b)-белковым комплексом I (ССК-I) входит в состав 140Å частиц, локализованных на внешней (РР) гидрофобной поверхности скола мембран межгранных участков тилакоидов (рис. 9).
Молекулярная организация фотосистемы I и фотосистемы II
Учитывая, что биохимический состав мембран хлоропластов и их структурно-функциональная организация у зеленых водорослей и высших растений практически одинакова, поэтому результаты, полученные на реакционных центрах фотосистем высших растений, можно применить к фотосистемам зеленых водорослей.
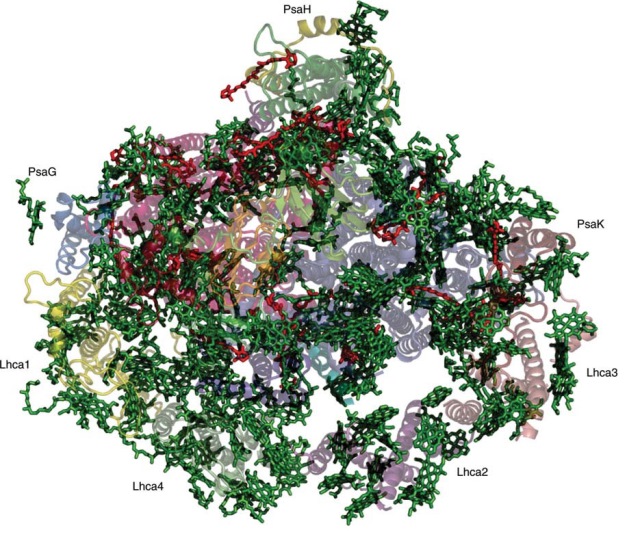
Рис. 10. Структура фотосистемы I растений (вид со стромальной стороны). Структурные координаты получены из теоретических расчетов (PDB) исходных структурных данных (PDB 1QZV) (Jolley et al., 2005). Зеленым цветом показаны молекулы хлорофилла, красным – рассчитанное расположение каротиноидов и липидов. Белковая основа, состоящая из 16 субъединиц, показана на заднем плане. Также показано расположение PsaG, PsaH, PsaK и Lhca1 – Lhca4 субъединиц (Nelson, Yocum, 2006).
За последние годы достигнуты значительные успехи в исследовании молекулярной организации компонентов фотосинтетического аппарата (Nelson, Ben-Shem, 2002; Merchant, Sawaya, 2005; Jensen et al., 2007). Последние результаты, полученные на фотосистеме II (Biesiadka et al., 2004; Ferreira et al., 2004; Kern et al., 2005) и на ССК-II (Liu et al., 2004; Standfuss et al., 2005), имеют более высокое разрешение, чем описанные ранее (Kuhlbrandt et al., 1994; Klukas et al., 1999; Zouni et al., 2001; Kamiya, Shen, 2003).
Сейчас получены более совершенные результаты и по структурной организации мембранного суперкомплекса реакционного центра ФС-I растений и связанного с ним антенного комплекса ССК-I (рис. 10) (Ben-Shem et al., 2003). Сходство в составе и расположении кофакторов в комплексах, разделенных миллиардами лет эволюции, поражает (Ben-Shem et al., 2004; Nelson, Ben-Shem, 2005; Jensen et al., 2007), а различия в белок-белковых взаимодействиях и новые функции, добавленные в течение длительной эволюции эукариотических комплексов, подчеркивают уникальность биологической адаптации к экологическим нишам и сохранение возникших изменений в этих сложных ферментных системах (Nelson, Ben-Shem, 2005; Jensen et al., 2007).
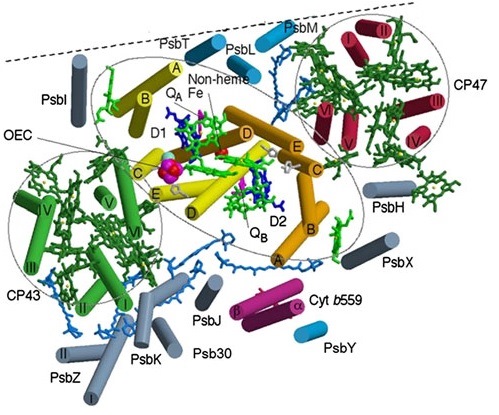
Рис. 11. Изображение мономера комплекса реакционного центра ФС-II вдоль мембраны со стороны внутритилакоидного пространства, показывающее расположение трансмембранных спиралей внутренних белковых субъединиц. Они связаны с теми же белками в другом мономере. Граница между мономерами показана пунктирной линией. Псевдо-ось, расположенная перпендикулярно плоскости мембраны, проходит через негемовое Fe, связанное с трансмембранными спиралями гетеродимера D1/D2, а субъединицы LMM, PsbI и PsbX, а также CP43 и CP47 выделены овальной и округлыми линиями (Pagliano et al., 2013). Рисунок составлен на основе работы Ferreira et al. (2004) с дополнениями из работ Guskov et al. (2009) и Umena et al. (2011).
Кристаллическая структура комплексов реакционного центра ФС-I растений показывает не только его архитектуру, но и возможный режим взаимодействия с ССК-I в результате чего образуются суперкомплексы (рис. 10). Их структура также обеспечивает новое понимание природы локусов взаимодействия между ФС-I и пластоцианином, ферредоксином, ферредоксин-НАДФ-редуктазой, а также с ССК-II. Следовательно, молекулярная структура ФС-I обеспечивает основу для исследования механизма светосбора и превращения энергии в процессе фотосинтеза, а также эволюционных связей, которые сформировали фотосинтетический аппарат зеленых водорослей и высших растений.
Такие модели являются удовлетворительными, потому что многие из их особенностей совпадают с предсказаниями, полученными биохимическими и спектроскопическими экспериментами. Вмести с тем, они позволяют сделать расширенные структурные толкования относительно размещения отдельных субъединиц и ориентацию пигментов, связанных с реакционными центрами и их антенных систем.
Сейчас модели димера структуры ФС-II представлены на основании данных, полученных Феррейра с соавторами (Ferreira et al., 2004; Nelson, Yocum, 2006).
В каждом мономере (рис. 11) основные интегральные субъединицы D1 (PsbA) и D2 (PsbD) связываются с большинством окислительно-восстановительных кофакторов, образующих цепь переноса электронов при участии антенных белков CP47 (PsbB) и CP43 (PsbC), а также двух субъединиц a и b (PsbE и PsbF) цитохрома b559 (Цит b559) (Pagliano et al., 2013).
Все перечисленные субъединицы у эукариот кодируются хлоропластными генами. Из этих субъединиц состоит реакционный центр ФС-II, одинаковый для всех О2-выделяющих фотосинтезирующих организмов.
Для полностью функциональной ФС-II требуется дополнительно ансамбль О2-выделяющего комплекса (OEC), содержащего Mn4CaO5 металло-кластер, который стабилизируется периферийными субъединицами (Nelson, Yocum, 2006; Umena et al., 2011; Pagliano et al., 2013).
В заключение необходимо сообщить, что детальное описание вопросов исследования генетического контроля, молекулярной организации и функционирования фотосистем в хлоропластах Chlamydomonas reinhardtii подробно обсуждается в монографии В.Г. Ладыгина «Жизненный цикл, наследование, биогенез, биохимический состав, спектральные свойства и структурно-функциональная организация хлоропластов Chlamydomonas reinhardtii», представленной на сайте Приложения к журналу «Вопросы современной альгологии» в PDF-формате.
ОГЛАВЛЕНИЕ pdf-файла
Список литературы
1. Карнаухов В.Н. Функции каротиноидов – объект биофизических исследований // Биофизика. 2000. Т. 45. № 2. С. 364–384.
2. Ладыгин В.Г. Пигментные мутанты Chlamydomonas reinhardtii, индуцированные нитрозоэтилмочевиной и ультрафиолетовыми лучами // Генетика. 1970. Т. 6. № 3. С. 47–50.
3. Ладыгин В.Г. Коллекция штаммов мутантов Chlamydomonas Института почвоведения и фотосинтеза Академии наук СССР (ИПФС АН СССР). Коллекции Микроводорослей в СССР (списки культур) // Пущино: НЦБИ АН СССР. 1988. С. 104–122.
4. Ладыгин В.Г. Коллекция штаммов мутантов Chlamydomonas Института почвоведения и фотосинтеза Академии наук СССР (ИПФС АН СССР). Каталог Культур Микроводорослей в Коллекциях СССР. Отв. ред. Семененко В.Е. // Москва: РАН. 1991. С. 152–175.
5. Ладыгин В.Г. Структурно-функциональная организация фотосистем в хлоропластах Chlamydomonas reinhardtii // Физиол. растений. 1998. Т. 45. № 5. С. 741–762.
6. Ладыгин В.Г. Современные представления о путях биосинтеза каротиноидов в хлоропластах эукариот // Журн. общей биологии. 2002. Т. 63. № 4. С. 299–325.
7. Ладыгин В.Г. Редукция мембранной системы хлоропластов при нарушении ранних этапов биосинтеза хлорофилла // Физиол. раст. 2006. Т. 53. № 1. С. 15–30.
8. Ладыгин В.Г. Влияние ранних этапов биосинтеза хлорофилла на формирование и функционирование мембран хлоропластов // Успехи современной биологии. 2006. Т. 126. № 1. С. 61–76.
9. Ладыгин В.Г. Лютеин-5,6-эпоксидный цикл – новый ксантофилловый цикл в хлоропластах растений // Биол. мембраны. 2008. Т. 25. № 3. С. 163–172.
10. Ладыгин В.Г., Ширшикова Г.Н. Современные представления о функциональной роли каротиноидов в хлоропластах эукариот // Журнал общей биологии. 2006. Т. 67. № 3. С. 163–189.
11. Ладыгин В.Г. Пути биосинтеза, локализация, метаболизм и функции каротиноидов в хлоропластах различных видов водорослей // Вопросы современной альгологии (Бюллетень). 2014. T. 2. № 6. С. 1–16. [Анонс]
12. Ладыгин В.Г. Пути биосинтеза, локализация, метаболизм и функции каротиноидов в хлоропластах различных видов водорослей // Вопросы современной альгологии. 2014. T. 2. № 6. URL: http://algology.ru/529 [Монография. 87 с.]
13. Ладыгин В.Г. Биогенез и возможности изменения состава каротиноидов глазного пятна у мутантов микроводоросли Chlamydomonas reinhardtii // Микробиология. 2014а. Т. 83. № 2. С. 160–169.
14. Ладыгин В.Г. Получение и физиолого-биохимическая характеристика мутанта С-41 Chlamydomonas reinhardtii – суперпродуцента ζ-каротина // Прикл. биохим. и микробиол. 2014b. Т. 50. № 6. С. 578–586.
15. Ладыгин В.Г., Семенова Г.А. Развитие ультраструктуры и изменение состава каротинов глазного пятна Chlamydomonas reinhardtii с помощью мутагенеза // Биофизика. 2013. Т. 58. № 6. C. 1005–1012.
16. Ладыгин В.Г., Семенова Г.А. Ультраструктурная организация и состав каротиноидов глазного пятна у пигментных мутантов Chlamydomonas reinhardtii // Цитология. 2014. Т. 56. № 1. С. 48–56.
17. Ладыгин В.Г., Семенова Г.А., Тагеева С.В. Развитие ламеллярной структуры пластид у пигментных мутантов Chlamydomonas reinhardtii // Цитология. 1973. Т. 15. С. 810–817.
18. Ладыгин В.Г., Семенова Г.А., Тагеева С.В. Непрерывность хлоропласта Chlamydomonas reinhardtii в течение жизненного цикла. 1. Деление хлоропласта при вегетативном размножении // Цитология. 1974. Т. 16. С. 1203–1209.
19. Ладыгин В.Г., Семенова Г.А., Тагеева С.В. Непрерывность хлоропласта Chlamydomonas reinhardtii в течение жизненного цикла. 2. Формирование хлоропласта зиготы и пластид зооспор в процессе полового размножения // Цитология. 1975. Т. 17. № 2. С. 115–121.
20. Семенова Г.А., Ладыгин В.Г., Тагеева С.В. Конденсация ДНК хлоропластов в зиготах хламидомонады (Chlamydomonas reinhardtii) // Цитология. 1978. Т. 20. № 11. С. 1320–1322.
21. Чекунова Е.М., Ладыгин В.Г. Исследование генетического контроля биосинтеза и метаболизма хлорофилла с использованием мутагенеза и генной инженерии. В кн. «Фотосинтез: открытые вопросы и что мы знаем сегодня». Ред. Аллахвердиев С.И., Рубин А.Б., Шувалов В.А. Ижевский Институт компьютерных исследований. Ижевск; Москва. 2013. Глава 16. C. 535–615.
22. Чекунова Е.М., Ладыгин В.Г. Исследование генетического контроля биосинтеза и метаболизма хлорофилла с использованием мутагенеза и генной инженерии. Современные Проблемы Фотосинтеза. Ред. Аллахвердиев С.И., Рубин А.Б., Шувалов В.А. // Ижевский Институт компьютерных исследований. Ижевск; Москва. 2014. Т. 2. Глава 22. С. 169–248.
23. Ben-Shem A., Frolow F., Nelson N. The crystal structure of plant photosystem I // Nature. 2003. V. 426. P. 630–635.
24. Ben-Shem A., Frolow F., Nelson N. Evolution of photosystem I – from symmetry through pseudosymmetry to asymmetry // FEBS Lett. 2004. V. 564. № 3. P. 274–280.
25. Biesiadka J., Loll B., Kern J., Irrgang K.D., Zouni A. Crystal structure of cyanobacterial photosystem II at 3.2Å resolution: a closer look at the Mn-cluster // Phys. Chem. Chem. Phys. 2004. V. 6. P. 4733–4736.
26. Britton G. Overview of carotenoid biosynthesis. Carotenoids: Biosynthesis and Metabolism. Eds. Britton G., Liaaen-Jensen S., Pfander H. // Basel; Boston; Berlin: Birkhauser Verlag. 1998. V. 3. P. 13–147.
27. Ferreira K.N., Iverson T.M., Maghlaoui K., Barber J., Iwata S. Architecture of the photosynthetic oxygen-evolving center // Science. 2004. V. 303. № 5665. P. 1831–1838.
28. Guskov A., Kern J., Gabdulkhakov A., Broser M., Zouni A., Saenger W. Cyanobacterial photosystem II at 2.9Å resolution and the role of quinones, lipids, channels and chloride // Nat. Struct. Mol. Biol. 2009. V. 16. № 3. P. 334–342.
29. Harris E.H. The Chlamydomonas sourcebook: A comprehensive guide to biology and laboratory use // San Diego: Acad. Press. 1989. 780 pp.
30. Harris E.H. Chlamydomonas as a model organism // Annu. Rev. Plant Physiol. Plant Mol. Biol. 2001. V. 52. P. 363–406.
31. Harris E.H. The Chlamydomonas sourcebook, 2nd ed. // New-York: Elsevier. 2009. V. 1. 590 pp.
32. Hashimoto A., Koyama Y. The 21Ag state of a carotenoid bound to spinach chloroplast as revealed by picosecond transient Raman spectroscopy // Biochim. Biophys. Acta. 1990. V. 1017. № 2. P. 181–186.
33. Hirschberg J. Molecular biology of carotenoid biosynthesis. Carotenoids: Biosynthesis and Metabolism. Eds. Britton G., Liaaen-Jensen S., Pfander H. // Basel; Boston; Berlin: Birkhauser-Verlag. 1998. V. 3. P. 149–194.
34. Jensen P.E., Bassi R., Boekema E.J., Dekker J.P., Jansson S., Leister D., Robinson C., Scheller H.V. Structure, function and regulation of plant photosystem I // Biochim. Biophys. Acta. 2007. V. 1767. № 5. P. 335–352.
35. Jolley C., Ben-Shem A., Nelson N., Fromme P. Structure of plant photosystem I revealed by theoretical modeling // J. Biol. Chem. 2005. V. 280. № 39. P. 33627–33636.
36. Kamiya N., Shen J.R. Crystal structure of oxygen-evolving photosystem II from Thermosynechococcus vulcanus at 3.7Å resolution // Proc. Natl. Acad. Sci. USA. 2003. V. 100. № 1. P. 98–103.
37. Kern J., Loll B., Zouni A., Saenger W., Irrgang K.D., Biesiadka J. Cyanobacterial photosystem II at 3.2Å resolution – the plastoquinone binding pockets // Photosynth. Res. 2005. V. 84. № 1–3. P. 153–159.
38. Klukas O., Schubert W.D., Jordan P., Krauss N., Fromme P., Witt H.T., Saenger W. Photosystem I, an improved model of the stromal subunits PsaC, PsaD, and PsaE // J. Biol. Chem. 1999. V. 274. № 11. P. 7351–7360.
39. Kuhlbrandt W., Wang D.N., Fujiyoshi Y. Atomic model of plant light-harvesting complex by electron crystallography // Nature. 1994. V. 367. № 6464. P. 614–621.
40. Levine R.P. Genetic dissection of photosynthesis // Science. 1968. V. 162. P. 768–771.
41. Levinе R.Р., Еbеrsold W.Т. Тhе genetics and cytology оf Chlamydomonas // Аnn. Rev. Microbio1. 1960. V. 14. P. 197–216.
42. Liu Z., Yan H., Wang K., Kuang T., Zhang J., Gui L., An X., Chang W. Crystal structure of spinach major light-harvesting complex at 2.72Å resolution // Nature. 2004. V. 428. № 6980. P. 287–292.
43. Macpherson A.N., Hiller R.G. Light-harvesting systems in chlorophyll c-containing algae. Light-Harvesting Antennas in Photosynthesis. Eds. Green B.R., Parson W.W. // Dordrecht; Boston; London: Kluwer Acad. Publ. 2003. V. 13. P. 323–352.
44. Merchant S., Sawaya M.R. The light reactions: a guide to recent acquisitions for the picture gallery // Plant Cell. 2005. V. 17. № 3. P. 648–663.
45. Nelson N., Ben-Shem A. Photosystem I reaction center: past and future // Photosyth. Res. 2002. V. 73. № 1–3. P. 193–206.
46. Nelson N., Ben-Shem A. The structure of photosystem I and evolution of photosynthesis // Bioessays. 2005. V. 27. № 9. P. 914–922.
47. Nelson N., Yocum C.F. Structure and function of photosystems I and II // Annu. Rev. Plant Biol. 2006. V. 57. P. 521–565.
48. Pagliano C., Saracco G., Barber J. Structural, functional and auxiliary proteins of photosystem II // Photosynth. Res. 2013. V. 116. № 2–3. P. 167–188.
49. Ruban A.V., Pascal A.P., Robert B., Horton P. Configuration and dynamics of xanthophylls in light-harvesting antennae of higher plants. Spectroscopic analysis of isolated light-harvesting complex of photosystem II and thylakoid membranes // J. Biol. Chem. 2001. V. 276. № 27. P. 24862–24870.
50. Sager R. Inheritance in the green alga Chlamydomonas // Genetics. 1955. V. 40. P. 476–489.
51. Sager R., Palade G.E. Structura and development of the chloroplast in Chlamydomonas. I. The normal green cell // J. Biophys. Biochem. Cytol. 1957. V. 3. № 3. P. 463–487.
52. Scheer H. The pigments. Light-Harvesting Antennas in Photosynthesis. Eds. Green B.R., Parson W.W. // Dordrecht; Boston; London: Kluwer Acad. Publ. 2003. V. 13. P. 29–81.
53. Smith G.M. The fresh water algae of the USA // New-York; London. 1950.
54. Standfuss J., Terwisscha van Scheltinga A.C., Lamborghini M., Kuhlbrandt W. Mechanisms of photoprotection and nonphotochemical quenching in pea light-harvesting complex at 2.5Å resolution // EMBO J. 2005. V. 24. № 5. P. 919–928.
55. Umena Y., Kawakami K., Shen J.R., Kamiya N. Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9Å // Nature. 2011. V. 473. № 7345. P. 55–60.
56. Zouni A., Witt H.T., Kern J., Fromme P., Krauss N., Saenger W., Orth P. Crystal structure of photosystem II from Synechococcus elongatus at 3.8 angstrom resolution // Nature. 2001. V. 409. № 6821. P. 739–743.
Статья поступила в редакцию 15.07.2015
The life cycle, inheritance, biogenesis, biochemical composition, spectral properties and structural-functional organization of chloroplasts Chlamydomonas reinhardtii
Vladimir G. Ladygin
This review is devoted to the topical and important issues of the study of the genetic control of the molecular organization and functioning of the photosystems in the chloroplasts of Chlamydomonas reinhardtii Dang. The inherited chloroplast continuity in the process of the vegetative and sexual cell cycles is shown. Structural changes of chloroplast DNA in the process of forming daughter cells are studied. All stages of the biogenesis of membrane system the chloroplast from single vesicles to makrogranums are first described by using pigment mutants. There are current understanding of the biochemical composition, structural organization of photosystems I and II, the spatial localization of them in thylakoids in a monograph. The values and the number of photosynthetic units are defined and their functional activity is studied. The regularity distribution of spectral forms and chlorophyll fluorescence peaks for native complexes of photosystems in cells in vivo was first defined using double and triple mutants. Modern understanding of the molecular organization of photosystems in the chloroplasts of eukaryotes is considered.
The eponymous monograph is presented in Annex to the magazine «Issues of modern algology» – http://algae.ru/634. It will be interesting for a wide range of experts and scientists: geneticists, biochemists, biophysicists and physiologists of plants as well as for teachers and students of biological universities.
Key words: Chlamydomonas reinhardtii; mutants; biogenesis; inheritance; chloroplasts; pigments; genetic control; biochemical composition; spectral properties; activity of photosystems; ultrastructure of membranes; molecular organization of PS-I and PS-II.
Об авторе
Ладыгин Владимир Георгиевич – Ladygin Vladimir Georgievich
доктор биологических наук
ведущий научный сотрудник, ФГБУН Институт фундаментальных проблем биологии Российской академии наук, Пущино Московской области, Россия (Institute of Basic Biological Problems, Russian Academy of Sciences, Pushchino, Moscow Region, Russia)
Корреспондентский адрес: Россия, 142290, Московская область, г. Пущино, ул. Институтская, д. 2, Институт фундаментальных проблем биологии РАН; телефон: (4967) 73-36-01
ССЫЛКА НА СТАТЬЮ:
Ладыгин В.Г. Жизненный цикл, наследование, биогенез, биохимический состав, спектральные свойства и структурно-функциональная организация хлоропластов Chlamydomonas reinhardtii // Вопросы современной альгологии. 2015. № 2(9). URL: http://algology.ru/739
При перепечатке ссылка на сайт обязательна
ОГЛАВЛЕНИЕ МОНОГРАФИИ
«Жизненный цикл, наследование, биогенез, биохимический состав, спектральные свойства и структурно-функциональная организация хлоропластов Chlamydomonas reinhardtii Dang.»
(pdf-файла)
|
РЕЗЮМЕ……………………………………………………………………………………………..
|
2
|
|
ГЛАВА I. CHLAMYDOMONAS REINHARDTII – ОБЪЕКТ ИССЛЕДОВАНИЯ,
ЖИЗНЕННЫЙ ЦИКЛ И УСЛОВИЯ КУЛЬТИВИРОВАНИЯ……………………….
|
5
|
|
1. Характеристика Chlamydomonas reinhardtii ………………....................
|
5
|
|
2. Классификация Chlamydomonas reinhardtii ……………………………………
|
6
|
|
3. Морфология клеток Chlamydomonas reinhardtii ……………………………….
|
7
|
|
4. Жизненный цикл Chlamydomonas reinhardtii ………………………………….
|
7
|
|
5. Условия культивирования Chlamydomonas reinhardtii и состав сред
|
11
|
|
ГЛАВА II. ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ CHLAMYDOMONAS REINHARDTII.
НАСЛЕДОВАНИЕ ХЛОРОПЛАСТА В ПРОЦЕССЕ МИТОТИЧЕСКОГО
КЛЕТОЧНОГО ЦИКЛА ……………………………………………………………….
|
16
|
|
1. Непрерывность хлоропласта при вегетативном ………………………………
|
16
|
|
ГЛАВА III. ПОЛОВОЕ РАЗМНОЖЕНИЕ CHLAMYDOMONAS REINHARDTII.
НАСЛЕДОВАНИЕ ХЛОРОПЛАСТА В ПРОЦЕССЕ МЕЙОТИЧЕСКОГО
КЛЕТОЧНОГО ЦИКЛА ……………………………………………………………….
|
30
|
|
1. Непрерывность хлоропласта при половом размножении…...............
|
30
|
|
ГЛАВА IV. НАСЛЕДОВАНИЕ И ЛОКАЛИЗАЦИЯ ДНК В ХЛОРОПЛАСТАХ ЗИГОТ
CHLAMYDOMONAS REINНARDTII …………………………………………………...
|
52
|
|
1. Локализация ДНК в хлоропластах вегетативных клеток …………………….
|
52
|
|
2. Локализация ДНК в хлоропластах зигот ………………………………………
|
56
|
|
ГЛАВА V. МУТАНТЫ CHLAMYDOMONAS REINHARDTII КАК МОДЕЛЬНЫЕ ОБЪЕКТЫ
ДЛЯ ИССЛЕДОВАНИЯ ФОТОСИНТЕЗА …………………………………………...
|
61
|
|
1. Действие мутагенных факторов ………………………………………………...
|
61
|
|
2. Получение мутантов …………………………………………………………….
|
61
|
|
ГЛАВА VI. ФОРМИРОВАНИЕ И РАЗВИТИЕ МЕМБРАННОЙ СИСТЕМЫ
ХЛОРОПЛАСТОВ У МУТАНТОВ CHLAMYDOMONAS REINHARDTII …………
|
65
|
|
1. Характеристика пигментных мутантов Chlamydomonas reinhardtii …
|
65
|
|
ГЛАВА VII. ЛОКАЛИЗАЦИЯ И ФУНКЦИИ КАРОТИНОИДОВ В КОМПЛЕКСАХ
ФОТОСИСТЕМЫ I И ФОТОСИСТЕМЫ II ………………………………………...
|
85
|
|
1. Общая характеристика каротиноидов эукариот ……………………........
|
85
|
|
2. Локализация наиболее важных ксантофиллов эукариот …………………
|
89
|
|
ГЛАВА VIII. БИОХИМИЧЕСКИЙ СОСТАВ ХЛОРОФИЛЛ-БЕЛКОВЫХ КОМПЛЕКСОВ
ФОТОСИСТЕМ CHLAMYDOMONAS REINHARDTII ………………………………
|
97
|
|
1. Содержание пигментов ……………………................................................
|
97
|
|
2. Идентификация хлорофилл-белковых комплексов …………………….....
|
99
|
|
3. Полипептидный состав индивидуальных комплексов ……………………..
|
99
|
|
ГЛАВА IX. СПЕКТРАЛЬНЫЕ СВОЙСТВА ХЛОРОФИЛЛ-БЕЛКОВЫХ КОМПЛЕКСОВ
ФОТОСИСТЕМ CHLAMYDOMONAS REINHARDTII ………………………………
|
102
|
|
1. Спектральные формы хлорофилла нативных комплексов ………………
|
102
|
|
2. Спектры флуоресценции хлорофилла нативных комплексов …………
|
105
|
|
ГЛАВА X. ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ФОТОСИСТЕМ
CHLAMYDOMONAS REINHARDTII ………………………………………………….
|
108
|
|
1. Фотосинтетическая активность ……………………....................................
|
108
|
|
2. Величина фотосинтетической единицы …………………….......................
|
109
|
|
3. Число реакционных центров фотосистем ……………………....................
|
110
|
|
ГЛАВА XI. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ФОТОСИСТЕМ CHLAMYDOMONAS
REINHARDTII……………………………………………………………………………
|
113
|
|
1. Пространственная локализация фотосистем в мембранах хлоропластов……
|
113
|
|
2. Состав и функции белков ФС-II ……………………..................................
|
123
|
|
ГЛАВА XII. МОЛЕКУЛЯРНАЯ ОРГАНИЗАЦИЯ ФОТОСИСТЫ I И ФОТОСИСТЕМЫ II ...
|
128
|
|
1. Структура комплекса фотосистемы I ……………………...........................
|
129
|
|
2. Структура комплекса фотосистемы II ……………………..........................
|
131
|
|
3. Реакционный центр фотосистемы II ……………………............................
|
134
|
|
ЗАКЛЮЧЕНИЕ……………………………………………………………………………………...
|
138
|
ПЕРЕЙТИ К МОНОГРАФИИ
Карта сайта

|












