|
|
|
Ультраструктурные изменения морской микроводоросли Ostreopsis cf. ovata в условиях лабораторного культивирования
Крещеновская М.А., Орлова Т.Ю. Miloslava A. Kreshchenovskaya, Tatiana Yu. Orlova
Институт биологии моря им. А.В. Жирмунского ДВО РАН
УДК 582.261+577.95
Описаны изменения ультраструктуры морской микроводоросли <i>Ostreopsis</i> cf. <i>ovata</i> в течении двухмесячного лабораторного культивирования без пересевов и добавления питательной среды. В первую очередь изменения затрагивают фотосинтетический аппарат, строение оболочки клетки и гранулы запасных веществ. В поздней стационарной стадии роста отмечено появление структур, не описанных в литературе ранее и не характерных для предыдущих стадий роста. Ключевые слова: ультраструктура; микроводоросли; Dinoflagellata; культивирование; Ostreopsis cf. ovate.
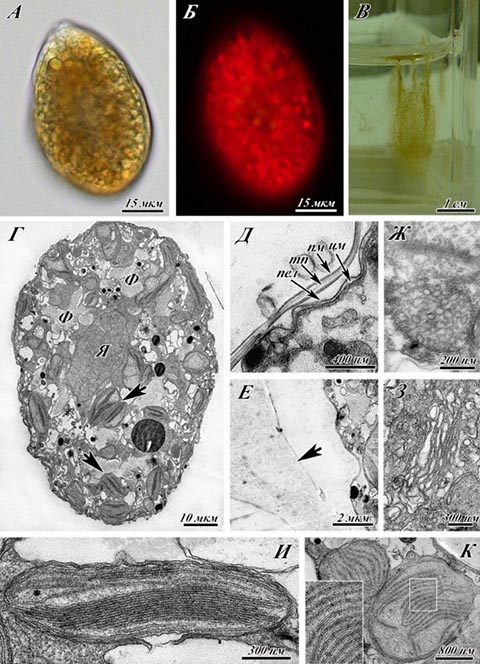
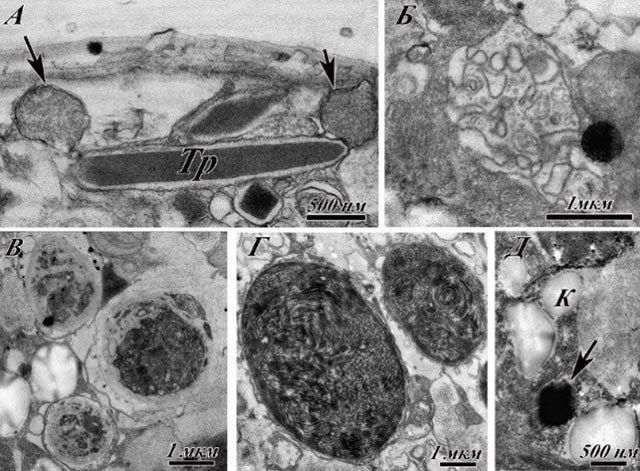
Введение Микроводоросли, являющиеся начальным звеном трофических цепей и одним из основных производителей органического вещества, продуцируют от 50 до 90% кислорода, фиксируют большую часть углекислого газа из атмосферы. Более 99% живых существ океана напрямую или опосредованно зависят от микроводорослей. К примеру, один вид гаптофитовых водорослей Emiliania huxleyi определяет на 95% биогенный баланс карбоната кальция, являясь наиболее важным продуцентом кальция. Практический интерес к этой группе организмов вызван множеством факторов. Прежде всего, микроводоросли – источник витаминов, органических соединений, множества метаболитов, а также сверхсильных токсинов (Soeder, 1986). Лабораторное культивирование микроводорослей рассматривается как важный инструмент для решения фундаментальных и прикладных проблем, в частности, для решения вопросов аквабиотехнологии. Лабораторные культуры предполагают постоянное поддержание клонов микроводорослей в контролируемых условиях. Рост микроводорослей описывается типичной кривой, имеющей S-образную форму, которая включает следующие фазы роста: начальную (или лаг-) фазу, экспоненциальную (или логарифмическую) фазу, стационарную фазу и, в случае отсутствия поддержания, фазу гибели. Как правило, лабораторное культивирование охватывает промежуток максимум до конца стационарной стадии роста (Allen, Nelson, 1910). Экспоненциальная (логарифмическая) фаза роста характеризуется постоянной максимальной скоростью деления клеток. Стационарная фаза наступает тогда, когда число клеток перестает увеличиваться. Скорость роста зависит от концентрации субстрата, поэтому при уменьшении этой концентрации наблюдается снижение скорости роста. Переход от экспоненциальной к стационарной фазе роста происходит постепенно. Скорость роста также может снижаться из-за накопления токсичных продуктов обмена. В стационарной фазе могут происходить такие процессы, как использование запасных веществ, синтез ферментов, быстрая гибель чувствительных клеток. Целью настоящей работы было изучение особенностей ультраструктуры клеток морской микроводоросли Ostreopsis cf. ovate и ее изменения в условиях лабораторного культивирования без пересевов и добавления питательной среды. Материалы и методы Культура Ostreopsis cf. ovata была выделена Н.Г. Литвиновой (лаборатория экологии шельфовых сообществ ИБМ ДВО РАН). С целью получения клоновых культур из природных проб были отловлены отдельные клетки, которые впоследствии отсаживали в отдельные ячейки со средой К и помещали в климатостат КС-200 СПУ (Россия) с температурой 20ºС, освещенностью 3500 лк и свето-темновым периодом 12 час. свет:12 час. темнота. Клетки для цитологического анализа отбирались на стадии экспоненциального роста, в начале (1 месяц) и в конце стационарной стадии (2 месяца) культивирования без пересева и добавления свежей питательной среды. Пробоподготовка для ультрамикроскопических исследований осуществлялась по стандартной методике (Reynolds 1963), для повышения контрастности было использовано окрашивание 0,15% раствором рутения красного. Исследование срезов проводили на трансмиссионном электронном микроскопе Libra 120 и Libra 200, CarlZeiss (Германия). Результаты Ультраструктурное строение вегетативных клеток Ostreopsis cf. ovata на стадии экспоненциального роста в целом соответствует описанию, приводимому в современной литературе (Besada et al., 1982; Коновалова, 1998; Околодков, 2011; Honsell et al., 2013; Kang et al., 2013). Рис. 1 демонстрирует ультраструктурное строение Ostreopsis cf. ovata на стадии экспоненциального роста. Клетки каплевидной формы, размерами от 30 до 80 мкм (рис.1 А, Б). Нами было отмечены многочисленные слизистые тяжи, которые становятся более заметными в конце экспоненциальной фазы (рис.1 В). Динокарион овальной формы размещен в дорсальной части клетки. Значительную часть клетки занимают особые образования – фибриллярные тельца (рис.1 Г). Покровы клетки представлены амфиесмой, состоящей из непрерывной внешней мембраны (плазмалеммы), слоем амфиесмальных везикул (текальных пластин), пелликулярным слоем и цитоплазматической мембраной (рис.1 Д). Митохондрии и аппарат Гольджи имеют стандартное для отдела строение. Хлоропласты располагаются в цитоплазме достаточно хаотично. В одних клетках тилакоиды образуют граноподобные структуры, в других – тилакоиды сгруппированы в стопки по 3. Снаружи клетки покрыты слизистой оболочкой (рис.1 Е). В клетках обнаружены экструсомы двух видов: трихоцисты и мукоцисты, располагающиеся у периферии клетки (рис.2 А). Пузула обычно имеет вид нескольких мешочков трубчатого строения и располагается в центральной части клетки (рис.2 Б). Обнаружены различные клеточные включения: аккумулятивные тельца, довольно крупные крахмальные зерна (до 3 мкм), липидные гранулы величиной до 5 мкм (рис.2 В-Д).
Рис. 1. Ультраструктура Ostreopsis cf. ovata на экспоненциальной стадии роста.
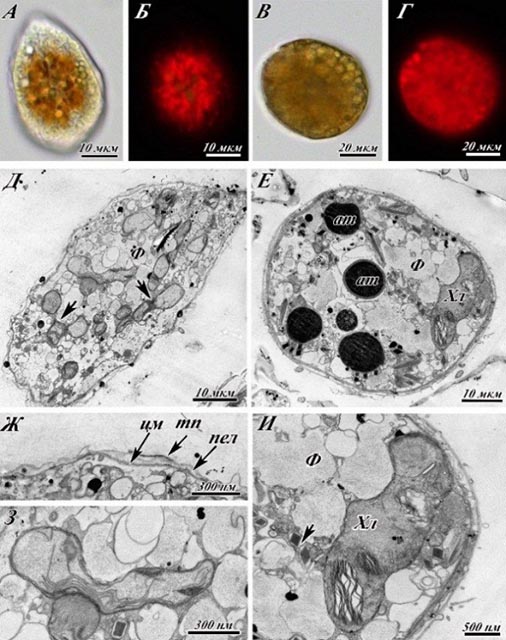
Рис.2. Ультраструктура Ostreopsis cf. ovata на стадии экспоненциального роста. На рис. 3 представлены ультраструктурные изменения клеток Ostreopsis cf. ovata, зафиксированные в начале стационарной фазы. На этой стадии роста клетки становятся более темными, меняется их форма. Можно выделить два типа: каплевидные (характерные для экспоненты) и округлые (Рис.3 A-Г). Рис.3 Б демонстрирует уменьшение объема содержимого цитоплазмы в клетке по сравнению с экспоненциальной стадией роста. На рис.3 Д, Е, Ж, З, И показана ультраструктура клеток. Особого внимания заслуживает изменение строения амфиесмы, хлоропластов, а также аккумулятивных телец. Фибриллярные тельца, трихоцисты внешне изменениям не подвергаются (рис.3 Д, Е). Аккумулятивные тельца становятся значительно более электронно-плотными, более темными (рис.3 Е), увеличиваются в размерах. Кроме того, происходит частичная потеря слоя текальных пластин, на рисунке стрелка указывает на небольшой сохранившийся участок этого слоя (рис.3 Ж). Изменяется внутреннее строение хлоропластов: тилакоиды теряют организованность в ламеллы по 3, сливаются в электронно-плотные линии (рис.3 З) или сужаются, отекают и как бы «расшнуровываются» (рис.3 И). Площадь, занимаемая тилакоидами в строме хлоропласта, также заметно уменьшается (рис.3 З, И).
Рис.3. Ультраструткура Ostreopsis cf. ovata на ранней стационарной стадии роста (1 месяц культивирования).
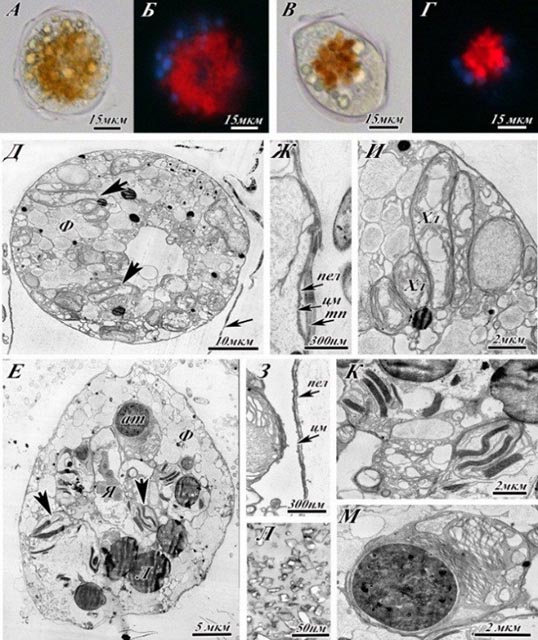
Рис. 4 отражает изменения, происходящие в конце стационарной фазы. Большинство клеток имеет округлую форму, видны крупные гранулы в периферической части клетки (рис.4 А, Б). Сохраняется небольшое количество клеток овальной формы, однако заметно, что внутреннее содержимое цитоплазмы уплотняется еще сильнее по сравнению с ранним стационаром (рис.4 В, Г). Самые значительные ультраструктурные изменения касаются строения хлоропластов, амфиесмы и аккумулятивных телец (рис.4 Д-М). Фибриллярные тельца внешне выглядят такими же, как в стационарной стадии роста. Большинство клеток теряет слой текальных пластин, однако в некоторых случаях он остается (рис.4 Ж, З). Хлоропласты подвергаются еще большему изменению – тилакоиды частично разрушаются или могут сливаться, образуя электронно-плотные структуры (рис.4 И, К). Именно на этой стадии у многих клеток обнаруживается особый тип включений – так называемые агрегаты кристаллического материала, обычно располагающиеся на периферии клетки (рис.4 Л). Агрегаты кристаллического материала имеют электронно-плотные очертания и размеры приблизительно до 100 нм в ширину и до 200 нм в длину. Подобные образования были описаны для еще одного вида динофлагеллат – Alexandrium tamarense. Аккумулятивные тельца увеличиваются в размерах, могут сливаться (рис.4 М).
Рис.4. Ультраструктура Ostreopsis cf. ovata на поздней стационарной стадии роста (2 месяц культивирования).
Обсуждение Ответная реакция на стимулы или изменения среды является неотъемлемой характеристикой любого живого организма. Стресс, таким образом, может быть определен как состояние окружающей среды, которое приводит к нарушению обмена веществ, что требует биохимических и метаболических корректив. Микроводоросли являются уникальной экспериментальной системой среди фотосинтетиков для изучения ответной реакции на стресс. Изучение же стрессофизиологии и адаптации микроводорослей имеет важное значение для дальнейшего развития массового культивирования микроводорослей. Понимание физиологических реакций на стресс поможет выработать более эффективные механизмы для производства целевого продукта, а также, в будущем, потенциал для генетической модификации штаммов. Потенциальная возможность использования микроводорослей как части биологических систем для детоксикации и очистки сточных вод также связана с выращиванием клеток в условиях стресса. Понимание процесса может помочь в выборе правильных условий культивирования, а также в отборе штаммов, с целью повышения эффективности биологического процесса. Работы по исследованию физиологического состояния микроводорослей из различных таксономических групп в условиях лабораторного культивирования ведутся в Институте биологии южных морей (Севастополь, Россия). Сотрудниками ИНБЮМ показано, что в продолжение роста культур клеток Isochrysis galbana (Haptophyta), Monochrysis lutheri (Ochrophyta), Tetraselmis suecica (Chlorophyta), Dunaliella viridis (Chlorophyta), Chaetoceros calcitrans (Ochrophyta) происходят изменения количественного содержания липидов, белков и углеводов. Каждая из фаз роста микроводорослей характеризуется ярко выраженной направленностью потока углерода в один из основных блоков метаболизма клетки. Активное потребление водорослями нитратов из питательной среды, по мнению авторов, способствовало накоплению белка в течение 7-10 дней наращивания культуры, но к концу стационарной фазы роста зарегистрировано значительное падение его уровня: в частности, у Isochrysis galbana в 1,5-2 раза по сравнению с экспоненциальной стадией роста. Содержание липидов с ростом культуры увеличивается и достигает максимума в конце стационарной фазы. Для Isochrysis galbana зарегистрировано повышение уровня липидов в 2-2,5 раза. (Токарева, 2008). Эти данные согласуются с нашими результатами: увеличение липидных капель в клетках Ostreopsis cf. ovata наблюдалось с начала стационарной фазы и было наибольшим в поздней стационарной фазе. Результаты, касающиеся изменения ультраструктуры клеток в условиях лабораторного культивирования, на настоящий момент крайне обрывочны и малочисленны. В настоящей работе показано, что основные изменения ультраструктуры, происходящие в условиях лабораторного культивирования, затрагивают, в первую очередь, фотосинтетический аппарат, являющийся определяющим для фотосинтезирующих организмов. В нашем эксперименте модификации касались расположения тилакоидов в строме: увеличения расстояния между ними или, наоборот, слияния тилакоидов между собой. К концу стационарной фазы подавляющее большинство клеток Ostreopsis cf. ovata теряет слой текальных пластин (панцирь), в результате чего самой внешней оболочкой становится пелликула. Это явление характерно для покоящихся стадий динофлагеллят (Doucette et al., 1989). В ходе нашего эксперимента регистрировались значительные изменения количества запасных веществ. Происхождение крупных липидных капель в цитоплазме клеток к концу стационарной стадии роста неизвестно, возможно, продукты переваривания разрушающихся клеточных органелл в цитоплазме преобразуются в липидные капли (Anderson, 1975). В клетках динофлагелляты Ostreopsis cf. ovatа через 2 месяца культивирования наблюдалось значительное увеличения размеров аккумулятивных телец (примерно в 2 раза). По мнению некоторых авторов (Honsell et al., 2013; Kang et al., 2013), изменение размеров аккумулятивных телец связано с накоплением в них продуктов разрушения клеточных органелл в условиях стрессовых воздействий. Агрегаты кристаллического материала впервые были обнаружены в результате настоящего исследования и ранее не были известны у представителей рода Ostreopsis. На электроннограммах агрегаты кристаллического материала встречались очень редко, всего в 3 из почти 50 исследованных клеток и располагались ближе к периферии. Подобные клеточные включения описаны для Alexandrium tamarense и для некоторых других динофлагеллят (Bibby, Dodge, 1972). Доусетт с коллегами (Doucette et al., 1989) отметили агрегаты кристаллина как у вегетативных клеток, так и у пелликулярных и гипнозиготических цист – покоящихся стадий жизненного цикла. Также ими было показано, что в цистах, в отличие от вегетативных клеток, эти включения отмечались всегда. Точная функция агрегатов кристаллина не выяснена. Предполагается, что они являются неким «хранилищем» запасных веществ и участвуют в формировании клеточной мембраны, а также играют важную роль в образовании цист (Doucette et al., 1989). Мы склонны относить появление этих агрегатов кристаллического материала к одному из признаков подготовки клетки к состоянию покоя. В заключение можно сделать вывод, что в результате длительного культивирования без пересевов и добавления питательной среды в первую очередь затрагивается фотосинтетический аппарат клетки, являющийся важнейшим для автотрофных организмов, оболочка – основной барьер и защита клетки, а также гранулы с запасными веществами.
Список литературы 1. Коновалова Г.В. Динофлагелляты (Dinophyta) дальневосточных морей России и сопредельных акваторий Тихого океана. - Владивосток: Дальнаука, 1998. - 299 с. 2. Околодков Ю.Б. Dinoflagellata (Bütschli) Fensome, Taylor, Norris, Sarjeant, WhartonetWilliams, 1993 // Протисты, часть 3. Руководство по зоологии. Карпова С.А. (ред.) - Москва, Санкт-Петербург: Товарищество научных изданий КМК, 2011. - Т.3. C. 7-119. 3. Токарева Ю.Н. Микроводоросли Черного моря. - Севастополь; ЭКОСИ-Гидрофизика, 2008. - 454 с. 4. Allen E.J., Nelson E.W. On the artificial culture of marine plankton organisms // J. Mar. Biol. Assoc. U.K 1910. V. 8. P. 421-474. 5. Besada E.G., Loeblich L.A., Loeblich A.R. Observation on tropical, benthic dinoflagellates from ciguatera-endemic areas: Coolia, Gamberdiscus, and Ostreopsis // Bulletin of Marine Science. 1982. V. 32, № 3. P. 723-735. 6. Bibby B.T., Dodge J.D. The encystment of a freshwater dinoflagellate: a light and electron microscopical // Br. Phycol. J. 1972. V. 7, P. 85-100. 7. Doucette G.J, Cembella A.D., Boyer L.G. Cyst formation in the red tide dinoflagellate Alexandrium tamarense (Dinophyceae): effects of iron stress // J. Phycol. 1989. V. 25. P. 723-731. 8. Honsell G., Bonifacio A., De Bortoli M., Penna A., Battocchi C., Ciminiello P., Dell’Aversano C., Fattorusso E., Sosa S., Yasumoto T,, Tubaro A. New insight on cytological and metabolic features Ostreopsis cf. ovata Fukuyo (Dinophyceae): a multidisciplinary approach // PLOS ONE. 2013. V. 8, № 2. P. 1-18. 9. Kang N. S., Jeong H. J., Lee S. Y., Lim A.S., Lee M.J., Kim H.S., Yih W. Morphology and molecular characterization of the epiphytic benthic dinoflagellate Ostreopsis cf. ovata in the temperate waters off Jeju Island, Korea // Harmful algae. 2013. V. 27. P. 98-112. 10. Preisig H.R., Andersen R.A. Historical review of algal culturing techniques // Andersen R.A. (ed.) Algal culturing techniques. - Elsevier Academic Press, 2005. P. 1-12. 11. Reynolds E. The use of lead citrate at high pH as an electron opaquestain in electron microscopy // Journal of Cell Biology. 1963. V. 17. P. 208–212. 12. Soeder C. J. An historical outline of applied algology // Richmond A. (ed.) CRC Handbook of Microalgal Mass Culture. - Florida: CRC Press, Boca Raton, 1986. P. 25-41. опубликовано - декабрь 2014 г.
Ultrastructural changes of marine microalga Ostreopsis cf. ovate in laboratory culture conditions Miloslava A. Kreshchenovskaya, Tatiana Yu. Orlova In this paper, we describe the ultrastructure changes of marine microalga Ostreopsis cf. ovate in laboratory cultivation during 2 month without reinoculation and addition of growth medium. In the first place, changes affect the photosynthetic apparatus, the structure of the cell membrane and granule storage substances. In the late stationary phase of growth marked the emergence of structures, not previously described in the literature and are not specific to the previous stages of growth. Keywords: ultrastructure; microalgae; Dinoflagellata; cultivation; Ostreopsis cf. ovate .
Об авторах Крещеновская Мирослава Алексеевна - Kreshchenovskaya Miroslava A. младший научный сотрудник Института биологии моря им. А.В, Жирмунского ДВО РАН, г. Владивосток, Россия (Zhirmunsky Institute of Marine Biology, Far Eastern Branch, Russian Academy of Sciences, Russia) mkreshenovskaya@gmail Орлова Татьяна Юрьевна - Orlova Tatiana Yu. кандидат биологических наук torlova06@mail.ru Корреспондентский адрес: Россия, 690041, г. Владивосток, ул. Пальчевского, д. 17, к.17; телефон (423) 231-09-05.
ССЫЛКА НА СТАТЬЮ: Крещеновская М. А., Орлова Т. Ю. Ультраструктурные изменения морских микроводорослей в условиях лабораторного культивирования // Вопросы современной альгологии. 2014. № 2 (6). URL: http://algology.ru/545
При перепечатке ссылка на сайт обязательна
. На ГЛАВНУЮ

|
|||
|
| ||