по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование»
V Сабининские чтения 29 ноября 2016 - 29 января 2017
Унифицированная установка для лабораторных исследований микроводорослей
Unified installation for microalgae laboratory studies
Тренкеншу Р.П., Лелеков А.С., Боровков А.Б., Новикова Т.М.
Rudolf P. Trenkenshu, Alexander S. Lelekov, Andrey B. Borovrov,
Tatyana M. Novikova
Институт морских биологических исследований имени А.О.Ковалевского (г. Севастополь)
УДК 57.082
В работе приводится описание лабораторной установки для исследования ростовых характеристик низших фотоавтотрофов, обоснование её конструкции, сравнение с традиционными способами культивирования. Данную установку предлагается использовать как унифицированную конструкцию при организации работ с микроводорослями в НИИ и вузах.
Ключевые слова: накопительная культура; квазинепрерывная культура; удельная скорость роста; продуктивность.
Введение
Разработке систем культивирования микроводорослей посвящено немало литературы (Геворгиз, 2005; Кокова, 1976; Перт, 1978). Авторы предлагают разные виды конструкций, начиная от самых элементарных лабораторных культиваторов, заканчивая автоматизированными промышленными системами (Fabregas, 1998; Novick, 1950; Ukeles, 1976; Vonshak, 1986). Реально в научно-исследовательских учреждениях в качестве лабораторных культиваторов традиционно используется химическая посуда. При этом, как правило, процедура измерения поверхностной радиации практически не учитывает расхождение форм освещаемых поверхностей. При перемешивании суспензии барботированием воздухом или газовоздушной смесью довольно приблизительно указывается количество воздуха на единицу объема перемешиваемой суспензии. Указанные обстоятельства не дают возможности корректного сравнения экспериментальных данных, например, для расчета кинетических характеристик роста микроводорослей. Таким образом, создание унифицированной установки для культивирования микроводорослей позволит получить новые знания о процессах роста и накопления биохимических компонентов клетками микроводорослей. Установка для культивирования микроводорослей должна удовлетворять следующим требованиям:
- Все составные элементы системы должны быть разработаны на основе теоретических представлений о кинетике роста микроводорослей (Лелеков, Тренкеншу, 2007; Тренкеншу, 2005; Тренкеншу, Лелеков, 2005). Например, геометрия фотобиореактора необходима такая, чтобы легко и довольно точно можно было рассчитывать важнейшие характеристики системы (фазы роста, объем, площадь освещаемой поверхности, интенсивность поверхностной радиации и др.).
- Все составные системы культивирования должны быть стандартного фабричного производства, чтобы в случае выхода из строя какого-нибудь элемента конструкции его замена не представляла бы трудностей.
- Простота и надежность конструкции.
- Контроль над основными параметрами процесса и возможность простого управления ими.
- Минимальная стоимость всей системы культивирования.
Цель работы – на основе разработанной теории роста микроводорослей создать унифицированную систему культивирования как некоторый стандарт для использования в лабораторной практике студентов, преподавателей и научных сотрудников.
В данной работе предлагается установка, которая обеспечивает рост культуры низших фототрофов как в накопительном режиме, так и в режиме хемостата при требуемых удельных скоростях протока. Установка может быть использована при организации лабораторных работ по изучению роста микроводорослей на биологических факультетах университетов, а также в качестве экспериментальных культиваторов при организации промышленного производства. Использование установки в научно-исследовательских институтах позволит получить новые знания о росте микроводорослей, причем результаты, полученные разными авторами для разных видов микроводорослей, будут сопоставимы благодаря одинаковым условиям роста культур.
Теоретическое обоснование конструкции. Следует отметить, что все факторы, ограничивающие рост культуры микроводорослей, можно разделить на 3 категории: световые условия, газовое обеспечение и минеральные компоненты питательной среды. Общее влияние упомянутых факторов определяет форму накопительной кривой. Верно и обратное утверждение – по форме накопительной кривой можно судить о лимитирующих рост факторах, последовательности их действия (Ризниченко, 2002).
Как показано в работах (Гуревич 1984; Кокова, Лисовский, 1976; Ризниченко, 2002; Трекеншу, 2005; Уильямсон, 1975), накопительную кривую можно разделить на следующие фазы роста: лаг-фаза, экспоненциальная (логарифмическая), линейная фазы, фаза замедления роста, стационарная фаза и фаза отмирания. Максимальная удельная скорость роста культуры микроводорослей наблюдаются на экспоненциальной фазе: биомасса растёт по экспоненциальному закону, что подразумевает отсутствие лимитирующих факторов. Единственным ограничивающим фактором является только величина внешнего светового потока. При повышении освещённости (если минерального и газового субстрата достаточно) увеличится удельная скорость роста культуры. В пределе, при некоторой пороговой освещённости, будет наблюдаться максимально возможная удельная скорость роста. С другой стороны, уменьшение светового потока приведёт к уменьшению скорости роста культуры.
Удельная освещенность клеток складывается из поверхностной освещенности, которая обусловлена мощностью световой решетки (ламп), освещаемого слоя фотобиореактора (толщина фотобиореактора) и интенсивности перемешивания культуры. Для реализации максимальной скорости роста необходимы мощные лампы, тонкий освещаемый слой при активном перемешивании суспензии. Выполнение этих условий требует специального дорогостоящего оборудования. Поэтому нами в качестве стандарта выбрана световая решетка, укомплектованная десятью недорогими 18 Вт лампами, обеспечивающая поверхностную освещенность до 20 кЛк (около 50 Вт/м2) на расстоянии 5 см от ламп. Для обеспечения достаточного количества биомассы при ежедневном отборе проб оптимальным является компромисс между толщиной освещаемого слоя и общим объёмом фотобиореактора при его небольших линейных размерах и весе. Опыт культивирования микроводорослей в отделе биотехнологий и фиторесурсов ИМБИ РАН показывает, что минимальный объем фотобиореактора, обеспечивающий условное невмешательство в процессы роста, составляет 3 литра. Исходя из размера световой решетки и объёма культиватора, освещаемый слой фотобиореактора будет составлять 5 см. Для поддержания постоянства освещенности фронтальные стенки фотобиореактора требуется делать из стекла. Последнее в отличие от оргстекла с течением времени не мутнеет. Также для увеличения удельной освещенности клеток боковые грани фотобиореактора необходимо выполнить из зеркала.
Максимальная продуктивность культуры наблюдается на линейной фазе. В соответствии с теорией о лимитирующих факторах (Blackman, 1905; Liebig, 1847; Monod, 1949), показано, что линейный рост возможен только в случае постоянства потока лимитирующего субстрата на систему культивирования. В работе (Лелеков, Тренкеншу, 2007) обосновано, что свойством постоянства потока лимитирующего субстрата на систему культивирования обладает только газовая составляющая в форме углекислого газа, что подтверждается экспериментальными данными (Ладыгина, 2007). Поэтому для обеспечения максимальной продуктивности необходимо увеличить подачу углекислого газа в фотобиореактор до максимального предела, который составляет 5% газо-воздушной смеси (Мурадян, 2003). Реализация данного режима возможна при использовании стандартного аквариумного насоса, баллона с углекислотой и смесителя с обратным клапаном. Кроме снабжения клеток углекислотой, компрессор обеспечивает перемешивание суспензии для равномерного распределения клеток в культиваторе и, соответственно, равномерного освещения. Так же компрессор обеспечивает вынос кислорода, являющегося побочным продуктом фотосинтеза и ингибитором роста. Для улучшения перемешивания нижняя грань фотобиореактора должна быть расположена под углом 25 градусов.
Для обеспечения непрерывного режима культивирования необходимо включить в конструкцию установки дозирующее устройство, емкости для питательной среды и сбора урожая. Наиболее простая, надежная и дешевая реализация дозирующего устройства представляет собой программируемое реле времени и электромагнитный проточный клапан. Преимуществом данной конструкции является возможность управления процессами роста культуры в широком диапазоне плотностей (скоростей), что необходимо для исследования влияния различных факторов внешней среды на рост и физиологическое состояние культуры низших фототрофов.
Описание установки. Установка для культивирования микроводорослей состоит из установочной площадки, двух фотобиореакторов, систем освещения, термостабилизации, газообеспечения, а также системы обеспечения непрерывного режима культивирования.
Установочная площадка. Установочная площадка представляет собой настольную конструкцию размерами 1000×800×500. Вертикальные стойки и их крепления выполнены из металлических никелированных трубок диметром 25 мм, а полки – из белого пластика толщиной 20 мм. На нижней площадке расположены два фотобиореактора и сливные емкости системы обеспечения непрерывного режима культивирования. На верхней площадке расположены емкости для питательной среды, компрессор, электромагнитный клапан. В центре верхней площадки сделано отверстие для подвода шлангов с воздухом к фотобиореактору и шлангов с питательной средой к электромагнитному клапану.
Фотобиореактор. Фотобиореактор представляет собой емкость из стекла размером 400×200×50 (плоскопараллельный тип) с рабочей толщиной 50 мм, т.е. выполняется условие перпендикулярности вектора светового потока к поверхности 400×200. Рабочий объем реактора – 3 л.
Нижняя грань сделана под углом 25 градусов с целью улучшения перемешивания суспензии. Сверху фотобиореактор закрывается крышкой из стекла, в которой имеются 2 отверстия для подачи воздуха, питательной среды. Все стеклянные элементы фотобиореактора склеены аквариумным силиконом.
Система освещения. В качестве источника света используется горизонтальная световая решетка, состоящая из 10 ламп дневного света General Electric F18W/54-765. Корпуса ламп симметрично относительно краев закреплены на ламинированную ДВП размерами 900×800. Лист ДВП с помощью захватов закреплен на тыльную сторону металлического каркаса. Средняя освещенность поверхности фотобиореакторов составляет 20 клк при их размещении вплотную к лампам. Интенсивность поверхностной радиации можно регулировать, изменяя расстояние между лампами и фотобиореактором или устанавливая между ними нейтральные светофильтры.
Система газообеспечения. Данный элемент установки обеспечивает перемешивание суспензии микроводорослей внутри фотобиореактора для равномерного распределения питательных веществ между клетками, а также подачу в фотобиореактор углекислого газа и вынос кислорода, являющегося побочным продуктом фотосинтеза. Основным элементом системы является аквариумный компрессор типа CR-40R (либо аналогичный аквариумный компрессор) с двумя выходами, производительностью 2 л/мин. С помощью гибкого силиконового шланга диаметром 5 мм воздух подается непосредственно в фотобиореактор через отверстие в крышке. На конце шланга закреплена стеклянная трубочка длиной 35 см, что обеспечивает подачу воздуха в нижнюю часть фотобиореактора.
Система термостабилизации. Фотобиореактор оснащен системой охлаждения (водяной рубашкой) размерами 400×200×10. Во избежание образования воздушных пробок и пузырей внутри рубашки водяной ток направляется снизу вверх. Увеличение либо уменьшение скорости протока воды через водяную рубашку позволяет поддерживать температуру в фотобиореакторе на заданном уровне.
Система для обеспечения непрерывного режима культивирования. Система обеспечивает рост микроводорослей в режиме хемостата. В качестве емкости для питательной среды используется пятилитровый пластиковый бочонок. Основными элементами системы являются программируемое реле времени (FERON TM22 либо аналог) и электромагнитный клапан (CAMOZZI A331-1C2-А7Е). Реле времени подключается к розетке, расположенной на листе крепления ламп световой решетки. Электромагнитный клапан с помощью кронштейна крепится над фотобиореактором. Питательная среда через соединительный шланг самотеком поступает к электромагнитному клапану, который находится в нормально закрытом состоянии. При включении программируемого реле времени, на клапан подается напряжение 220 В, он открывается, и питательная среда поступает в фотобиореактор. Скорость подачи питательной среды регулируется с помощью ручки на клапане, а также программно, с помощью временного реле. В максимально открытом состоянии клапана за одну минуту в фотобиореактор поступает 120 мл питательной среды. Минимально возможное время между включением и выключением клапана составляет 1 мин и определяется программой на таймере. Система настроена на 10 включений в сутки продолжительностью 1 мин. Таким образом, максимальная удельная скорость протока составляет 0,40 сут–1. Для увеличения скорости протока свыше 0,40 сут-1 необходимо выставить на таймере время включения 2 или более минуты.
Датчик оптической плотности. Установка оборудована простейшим датчиком оптической плотности, который позволяет обеспечить непрерывное измерение оптической плотности культуры микроводорослей. Часто подобные датчики разрабатываются для специальных целей или их стоимость достаточно велика, поэтому их применение при исследовании роста микроводорослей затруднено. Нашей целью являлось создание датчика оптической плотности, который бы удовлетворял следующим требованиям:
- Расстояние между излучателем и фотоприёмником должно быть соизмеримым с их линейными размерами. Это обеспечивает увеличение точности измерения за счёт уменьшения эффекта рассеивания света при прохождении через суспензию микроводорослей;
- В качестве источника света необходимо использовать современные узконаправленные светодиоды;
- Для измерения плотности культуры микроводорослей длина волны излучателя должна находиться в пределах 730-750 нм;
- Все составные элементы датчика должны быть стандартного фабричного производства, чтобы в случае выхода из строя какого-нибудь элемента конструкции его замена не представляла бы трудностей;
- Простота и надежность конструкции.
На рис. 1 представлены основные элементы датчика оптической плотности. Корпус 1 выполнен из чёрного пластика, имеющего форму параллелепипеда размерами 50´10´10 мм, в котором высверлены два взаимно перпендикулярных сквозных отверстия. Чёрный цвет корпуса 1 обеспечивает непроницаемость датчика для внешнего света. В поперечное отверстие вставлена стеклянная трубочка 3 диаметром 5 мм, которая обеспечивает проток суспензии клеток водорослей через датчик. Концы трубочки 3, выступающие за корпус датчика 1, также окрашены в чёрный цвет с целью нивелирования влияния внешней освещённости на показания прибора.
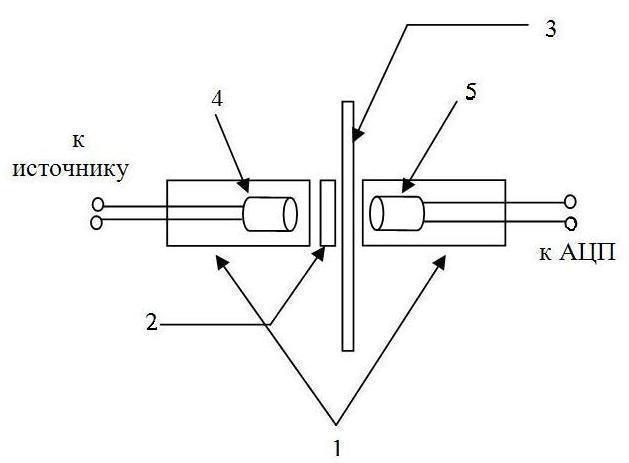
Рис. 1. Схема датчика оптической плотности (вид сбоку). 1 – корпус датчика, 2 – узкополосный светофильтр, 3 – стеклянная трубочка с суспензией клеток микроводорослей, 4 – светодиод, 5 – фотодиод.
В продольное отверстие корпуса с противоположных сторон вставлены светодиод 4 и фотодиод 5 таким образом, что трубочка 3 и узкополосный светофильтр 2 находятся между ними. Светофильтр 2 имеет узкую полосу пропускания света (рис. 2) с максимумом 720 нм. Это обеспечивает проведение измерений в той области спектра, в которой не поглощают ни пигменты, ни вода. В качестве светодиода нами выбран мощный ИК-светодиод с максимумом светимости при 850 нм. Ярко выраженный максимум светимости в ИК диапазоне спектра совместно со светофильтром 2 исключает влияние пигментов клеток микроводорослей на показания датчика. В качестве фотодиода нами выбран ФД-26К, имеющий диапазон чувствительности в области от 400 до 1100 нм с максимумом, приходящимся на 800 нм. Стоит отметить, что вместо указанного фотодиода возможно использование любого фотодиода с аналогичными параметрами.
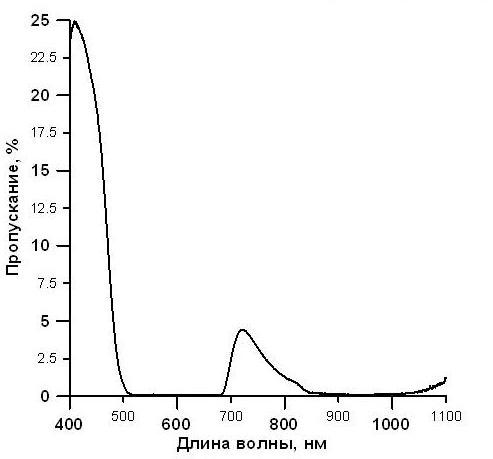
Рис. 2. Спектр узкополосного светофильтра.
В качестве источника питания нами выбрано стандартное зарядное устройство для мобильного телефона, на выходе которого напряжение составляет 5 В. Между источником питания и светодиодом находятся три резистора, один из которых играет роль предохранителя (R1 = 200 Ом), а два других – подстроечные резисторы, соединённые параллельно (R2 = 1,5 кОм; R3 = 10 кОм). Подстроечные резисторы служат для установки нуля («грубо» и «точно»), выбора диапазона сигнала при необходимости.
Нами выполнена калибровка предлагаемого датчика оптической плотности на базе лаборатории молекулярной и клеточной биофизики ФГАОУ ВО СевГУ. В качестве объекта исследования мы выбрали спирулину Arthrospira (Spirulina) platensis. При достижении спирулиной стационарной фазы роста, мы проводили параллельные измерения оптической плотности на КФК-2 и на предлагаемом датчике оптической плотности. Измерения проводили следующим образом: отобранную пробу промеряли относительно дистиллированной воды на КФК-2, после этого пробу промеряли на датчике оптической плотности. Перед измерением на датчике с помощью подстроечных резисторов устанавливали показания прибора, равные 100 мВ на дистиллированной воде. Далее воду сливали, и в трубочку 3 с помощью дозатора наливали 1,5 мл суспензии микроводорослей. Исходную пробу разбавляли в 2, 3, 4 и т.д. раз, при этом повторяли процедуру указанных измерений.
На рис. 3 представлены зависимости показаний оптической плотности (D750) на КФК-2 от показаний датчика (мВ) для спирулины. Для варианта 3 А в датчик была залита дистиллированная вода, и с помощью подстроечных резисторов выставлено показание прибора на отметку 100 мВ, что соответствует нулевому значению оптической плотности. Для варианта 3 В 100 мВ показания прибора выставлены по воздуху. Полученные данные свидетельствуют о хорошей линейной зависимости показаний датчика и КФК-2.
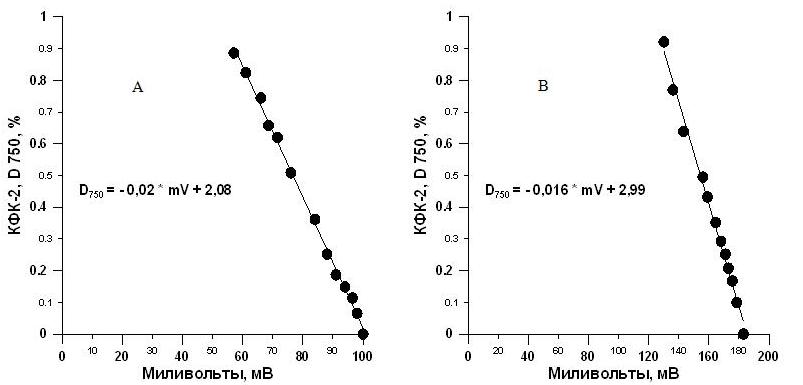
Рис. 3. Калибровочные кривые зависимости показаний величины оптической плотности (D750) на КФК-2 и предлагаемом датчике для спирулины.
А – калибровка датчика по дистиллированной воде, В – калибровка датчика по воздуху.
Однако для варианта 3 А угол наклона прямой к оси абсцисс меньше, поэтому при использовании этого коэффициента ошибка измерений будет ниже. Величина оптической плотности, полученная с помощью калибровочного уравнения, в свою очередь прямо пропорциональна абсолютно сухому весу (АСВ). Поэтому в дальнейшем целесообразно провести калибровку датчика непосредственно на АСВ, что при проведении экспериментов с микроводорослями значительно упростит процедуру измерений биомассы, а также позволит автоматизировать культивирование водорослей.
Разработанный датчик оптической плотности был принят за основу при разработке проточного датчика оптической плотности. Для его подключения к фотобиореактору в нижней части фотобиореактора высверлено отверстие диаметром 8 мм, в которое вставлен регулирующий кран, соединенный со входом датчика. Циркуляция суспензии микроводорслей через датчик обеспечивается с помощью эрлифта.
Апробация установки. Установка успешно прошла испытания при интенсивном культивировании трёх видов микроводорослей в отделе биотехнологий и фиторесурсов ИМБИ РАН, а также в лаборатории молекулярной и клеточной биофизики СГУ (г. Севастополь). На рис. 4 представлена динамика роста микроводорослей. Культура Dunaliella salina выращивалась на среде Ben-Amotz. Линейная фаза роста продолжалась со вторых по пятые сутки. Рассчитанное значение максимальной продуктивности использовали для построения прогностической кривой роста дуналиеллы в условиях непрерывной культуры. Для верификации данного уравнения на 11 сутки эксперимента была установлена удельная скорость протока 0,42 сут-1. При достижении плотностью культуры стационарного динамического равновесия на уровне 0,47 г АСВ/л, на 23-й день эксперимента удельная скорость протока была изменена на 0,2 сут-1. Это привело к увеличению плотности культуры и достижению ею стационарного динамического равновесия на уровне 0,98 г АСВ/л (см. рис. 4).
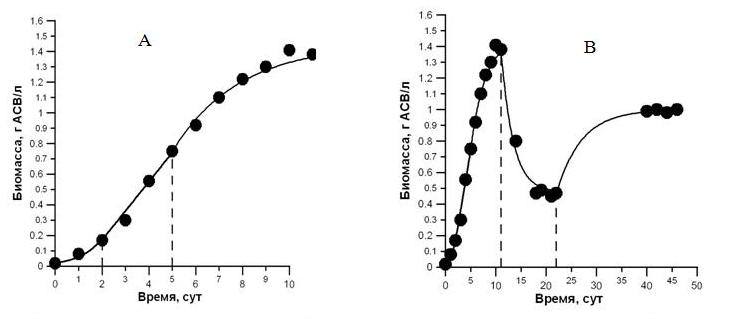
Рис. 4. Кривые роста культуры Dunaliella salina.
Пунктиром отмечены границы фаз роста и моменты включения протока. А – накопительная культура, В – проточная культура.
Культура Scenodecmus sp. выращивалась на среде Тамия. Целью эксперимента являлось исследовать динамику роста Scenodecmus sp. и провести сравнительную оценку её продуктивности в накопительной культуре на сточных водах и питательной среде. Эксперимент проводился в двух культиваторах (далее – варианты № 1 и 2) методом накопительных культур. В качестве контроля использовали сточную воду, которая на протяжении всего эксперимента находилась в тех же условиях, что и культиваторы. Динамика биомассы накопительной культуры Scenedesmus sp. при культивировании на среде Тамия и сточных водах представлена на рис. 5.
Кривые роста во всех вариантах характеризуются отсутствием лаг-фазы и экспоненциальной фазы роста, что объясняется высоким значением начальной плотности культуры. При выращивании Scenedesmus sp. на питательной среде Тамия линейная фаза длилась с первых по шестые сутки, а на сточных водах – с момента начала эксперимента по третьи сутки. Результаты представлены на рис. 5. В культиваторе № 2 после внесения дополнительного источника минерального фосфора биомасса Scenedesmus sp. начала увеличиваться и на тринадцатые сутки достигла 0,933 г АСВ. При этом наблюдалось снижение концентрации нитратного азота и минерального фосфора, которые достигли нуля на четырнадцатые сутки. Стоит отметить, что динамика плотности культуры полностью повторилась (рис. 5): удельная скорость дыхания, рассчитанная для второй фазы замедления, равняется удельной скорости дыхания, рассчитанной для первой фазы замедления.
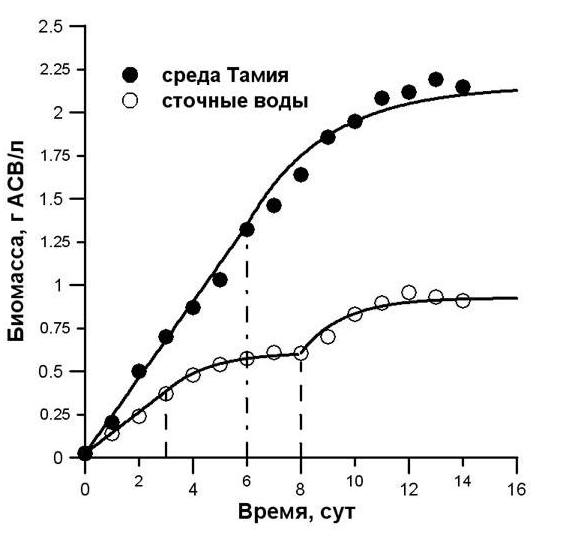
Рис. 5. Динамика биомассы Scenedesmus sp. в культуральной среде.
Линии – аппроксимация линейной фазы и фазы замедления. Пунктиром отмечены границы фаз роста.
Анализ кинетических характеристик трёх культур микроводорослей (таб. 1) показывает общность полученных значений. Так, максимальная удельная скорость роста составляла около 1,1 сут -1, а максимальная продуктивность – 0,2 г АСВ/л·сут. Так как в применяемых питательных средах содержание биогенных элементов было не одинаково, то и величины максимальной плотности для исследуемых видов микроводорослей не совпали.
Таблица 1. Характеристики роста накопительных культур:
µm – максимальная удельная скорость роста, Pm – максимальная продуктивность, µr – удельная скорость дыхания, Bm – плотность культуры на стационарной фазе роста
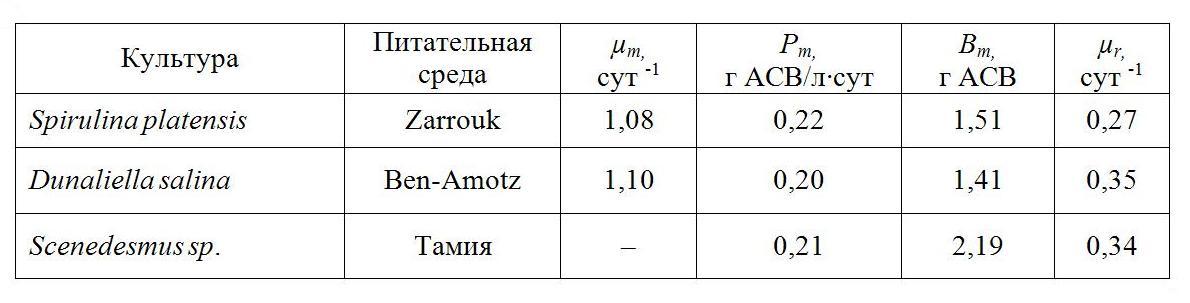
Проведенное исследование позволяет принять к обсуждению вопрос о том, что при общности условий культивирования и оптимальных температурных условиях скорость роста водорослей различных систематических групп одинаковая. Полученных данных недостаточно, чтобы с уверенностью судить о правильности данного наблюдения, что вызывает необходимость более детального исследования проблемы роста микроводорослей.
Заключение. Для исследования ростовых, биохимических и физиологических характеристик культур микроводорослей разработана установка, которая обеспечивает рост водорослей в накопительной и непрерывной культуре. Основываясь на известных представлениях роста микроводорослей, создана оптимальная конструкция, которая обеспечивает контроль над основными параметрами роста и физиологического состояния, а также возможность простого управления ими. Отличительными особенностями данной разработки является простота, надежность конструкции и легкость замены элементов, а также дешевизна установки в целом. Использование установки в вузах и НИИ позволит получить данные о росте различных видов и штаммов водорослей в одинаковых условиях, что важно для сравнения их биологических свойств, а также даст возможность корректно сравнивать экспериментальные данные, полученные различными исследователями.
Список литературы
1. Геворгиз Р.Г., Шахматов А.П. Установка для культивирования морских микроводорослей // Экология моря. 2005. №67. С. 44–47.
2. Гуревич Ю.Л. Устойчивость и регуляция размножения в микробных популяциях. – Новосибирск, 1984. – 161 с.
3. Кокова В.Е., Лисовский Г.М. Непропорционально-проточная культура простейших. – Новосибирcк: Наука, 1976. – 76 с.
4. Ладыгина Л.В. Микроводоросли как кормовые объекты личинок мидий и устриц: Автореф. дис. канд. биол. наук. – Севастополь, 2007. – 25 с.
5. Лелеков А.С., Тренкеншу Р.П. Простейшие модели роста микроводорослей. 4. Экспоненциальная и линейная фазы роста // Экология моря. 2007. №74. С. 47–49.
6. Мурадян Е.А. Влияние экстремально высокой концентрации СО2 на функциональное состояние фотосинтетического аппарата и обмен липидов Dunaliella salina: Автореф. дис. канд. биол. наук. – Москва, 2003. – 26 с.
7. Перт С.Д. Основы культивирования микроорганизмов. – М.: Мир, 1978. – 331 с.
8. Ризниченко Г.Ю. Лекции по математическим моделям в биологии. – М: Изд. РХД, 2002. – 236 с.
9. Тренкеншу Р.П. Простейшие модели роста микроводорослей. 1. Периодическая культура // Экология моря. 2005. №67. С. 89–97.
10. Тренкеншу Р.П., Лелеков А.С. Простейшие модели роста микроводорослей. 3. Потребность микроводорослей в элементах минерального питания // Экология моря. 2005. №70. С. 53–61.
11. Уильямсон М. Анализ биологических популяций. – М.: Мир, 1975. – 271 с.
12. Blackman F.F. Optima and limiting factors // Ann. Bot. Lond. 1905. V. 19. P. 281–295.
13. Fabregas J., Garcia D., Morales E. Reneval rate of semicontinuous culture of the microalga Porphyridium cruentum modifies phycoerythrin, exopolysaccharoide and fatty acid productivity // J. Ferment. Bioengin. 1998. V.86, №5. P. 463–467.
14. Liebig J. Chemistry in its Application to Agriculture and Physiology. – Lond., 1847. – 320 p.
15. Monod J. The growth of bacterial cultures // Ann. Rev. Microbiol. 1949. V.3. P. 371–394.
16. Novick A., Szilard L. Description of the chemostat // Scien. 1950. V.112. P. 715–718.
17. Ukeles R. Cultivation of plants // Mar. Ecol. 1976. V. 3. P. 367–420.
18. Vonshak A. Laboratory techniques for the cultivation of microalgae / Нandbook of micro-algal mass culture. – CRC Press, Boca Raton, FL, USA, 1986. – P. 117–145.
Статья поступила в редакцию 9.12.2016
Unified installation for microalgae laboratory studies
Rudolf P. Trenkenshu, Alexander S. Lelekov, Andrey B. Borovkov, Tatyana M. Novikova
The article provides a description of the laboratory instalation for the study characteristics of growth microalgae culture, the rationale for its design, compared to traditional ways of cultivation. This installation is to be used as a standardized design in the organization of work in microalgae research in institutes and universities.
Key words: batch culture; semicontinious culture; specific growth rate; productivity.
Об авторах
Тренкеншу Рудольф Павлович – Trenkenshu Rudolf P.
кандидат биологических наук
старший научный сотрудник, заведующий Отделом биотехнологий и фиторесурсов Института морских биологических исследований им. А.О.Ковалевского РАН (ФГБУН ИМБИ), г. Севастополь, Россия (Federal State Institution of Science «The A. O. Kovalevsky Institute of Marine Biological Research of RAS» IMBR, Sevastopol, Russia)
r.trenkenshu@rambler.ru
Лелеков Александр Сергеевич – Lelekov Alexander S.
кандидат биологических наук
старший научный сотрудник,Севастопольский государственный университет,Севастополь, Россия (Sevastopol State University, Sevastopol, Russia), Лаборатория молекулярной и клеточной биофизики
a.lelekov@yandex.ru
Боровков Андрей Борисович – Borovrov Andrey B.
кандидат биологических наук
старший научный сотрудник, зам. директора по научной работе, Института морских биологических исследований им. А.О.Ковалевского РАН (ФГБУН ИМБИ), г. Севастополь, Россия (Federal State Institution of Science «The A. O. Kovalevsky Institute of Marine Biological Research of RAS» IMBR, Sevastopol, Russia)
spirit2000sev@yandex.ru
Новикова Татьяна Михайловна – Novikova Tatyana M.
младший научный сотрудник, Институт морских биологических исследований им. А.О.Ковалевского РАН (ФГБУН ИМБИ), г. Севастополь, Россия (Federal State Institution of Science «The A. O. Kovalevsky Institute of Marine Biological Research of RAS» IMBR, Sevastopol, Russia)
nowtanj@yandex.ru
Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ:
Тренкеншу Р.П., Лелеков А.С., Боровков А.Б., Новикова Т.М. Унифицированная установка для лабораторных исследований микроводорослей // Вопросы современной альгологии. 2017. №1 (13). URL: http://algology.ru/1097
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Адрес - info@algology.ru
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮ
Карта сайта
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|







