|
|
|
|
V Сабининские чтения 29 ноября 2016 - 29 января 2017 Влияние размера популяции тест-объекта Scenedesmus quadricauda (Turpin) Bréb. на результаты биотестирования
Ипатова В.И. Valentina I. Ipatova
Московский Государственный Университет имени М. В. Ломоносова,
УДК 577.472:577.486.628.394
Исследовано влияние начальной плотности популяции зеленой микроводоросли Scenedesmus quadricauda (Turpin) Bréb. на результаты оценки токсичности тяжелого металла хрома и антибиотика стрептомицина. Увеличение исходной плотности культуры в 2–2,5 раза приводит к снижению токсичности на 20–25%. Начальная плотность популяции клеток микроводорослей при биотестировании не должна превышать 105 кл/мл, поскольку использование культур микроводорослей с плотностью более 105 кл/мл может приводить к потенциальной недооценке токсичности веществ. Ключевые слова: начальная плотность популяции; микроводоросли; биотестирование; токсические вещества.
Биотестирование с использованием культур микроводорослей, основанное на диагностировании ингибирования их роста, традиционно используется для оценки опасности загрязнения водных экосистем. В стандартных краткосрочных водорослевых тестах определяют уменьшение темпа роста популяции или ее конечной численности (биомассы) после 72–96 часов экспозиции. Конечная численность клеток водорослей в таком эксперименте является основой для проведения хронического теста (длительностью 2–4 недели). В токсикологической литературе имеется много данных о влиянии условий культивирования, продолжительности биотеста и состава питательных сред на чувствительность лабораторных испытаний. Однако влияние начальной плотности популяции микроводорослей на проявление токсического эффекта изучено недостаточно. В лабораторном биотестировании с использованием микроводорослей в качестве стартовых часто используются необоснованно высокие клеточные плотности, по сравнению с плотностью популяций в естественных условиях, что может оказаться особенно важным в испытаниях с высокотоксичными веществами при их малых концентрациях. Кроме того, высокая клеточная плотность и увеличение длительности теста могут приводить к химическим превращениям токсиканта в среде, изменениям его биодоступности и токсичности в процессе биотестирования. До недавнего времени сведения о влиянии плотности популяции на различные общебиологические и физиологические показатели водорослей были случайными. Имеются данные об обратной зависимости фотосинтеза водорослей при световом насыщении, а также скорости деления клеток и содержания фосфора в клетке от плотности популяции (Бурлакова и др., 1979). Для макрофитов было показано, что скорость роста и способность к накоплению металлов у высшего водного растения ряски Lemna gibba значительно менялась при изменении плотности популяции (Demirezen et al., 2007). При этом при высокой плотности популяции наблюдалось уменьшение накопления никеля ряской в расчете на одно растение. В литературе уделено мало внимания влиянию плотности популяции на накопление токсических веществ клетками водорослей (Franklin et al., 2002). Тяжелые металлы токсичны для гидробионтов и человека и способны накапливаться в живых организмах выше допустимых уровней. Некоторые из них являются необходимыми в качестве микроэлементов, однако в высоких концентрациях проявляют токсические свойства. Они вызывают ингибирование роста растений, изменение большинства физиологических процессов на всех уровнях метаболизма и подавляют темп клеточного деления. Антибиотики, также как и тяжелые металлы, встречаются в окружающей среде во многих водоемах мира в связи с интенсивным развитием фармацевтической промышленности и широким их применением в медицине, ветеринарии, животноводстве и рыбоводстве. Стрептомицин, образуемый актиномицетами рода Actinomyces (Streptomyces), является антибиотиком широкого спектра антибактериального действия. В соответствии с современными представлениями антимикробная активность стрептомицина связана с подавлением синтеза белка, однако первичный механизм его действия окончательно не установлен. В связи с этим целью настоящего исследования послужило изучение влияния начальной численности популяции клеток зеленой микроводоросли Scenedesmus quadricauda (Turpin) Bréb. на результаты оценки токсичности тяжелого металла хрома и антибиотика стрептомицина.
Материалы и методы Культуру водоросли Scenedesmus quadricauda (Turpin) Bréb. (=Desmodesmus communis (E.Hegewald) (штамм S-3, DMMSU) выращивали на среде Успенского №1 (Успенская, 1966) в люминостате при освещенности 3 клюкс со сменой дня и ночи (12:12 ч) и температуре 22–25 C°. Для опытов использовали 7-суточную культуру в логарифмической фазе роста. В качестве токсиканта использовали бихромат калия в концентрациях 1 и 3 мг/л (в пересчете на хром) и антибиотик стрептомицина сульфат в концентрации 1 мг/л, которые однократно вносили в культуральную среду в день постановки эксперимента. Далее в тексте для краткости бихромат калия будем называть просто хромом. Показателем токсического действия токсиканта служило изменение общей численности клеток водоросли, которая учитывалась с помощью камеры Горяева, по сравнению с контролем. Мы провели 3 серии экспериментов. В первой серии опытов оценивали токсический эффект 1 мг/л хрома на популяции клеток водоросли с исходной плотностью 100, 200 и 400 тыс. кл/мл. Во второй – хром в концентрации 3 мг/л вносили в культуры с исходной численностью 100 тыс. и 1,5 млн. кл/мл. В третьей – отдельно хром и стрептомицин в концентрации 1 мг/л добавляли в культуры с исходными плотностями 200 тыс., 500 тыс., 1 млн. и 2 млн. кл/мл. Опыты проводили в трех повторностях длительностью 21–45 суток. Токсический эффект оценивали с помощью расчета достоверности отличий опытных значений от контрольных по t-критерию.
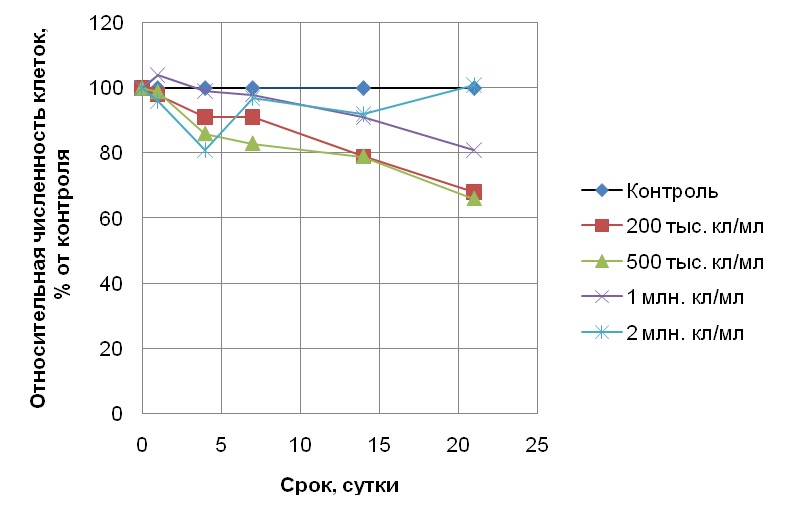
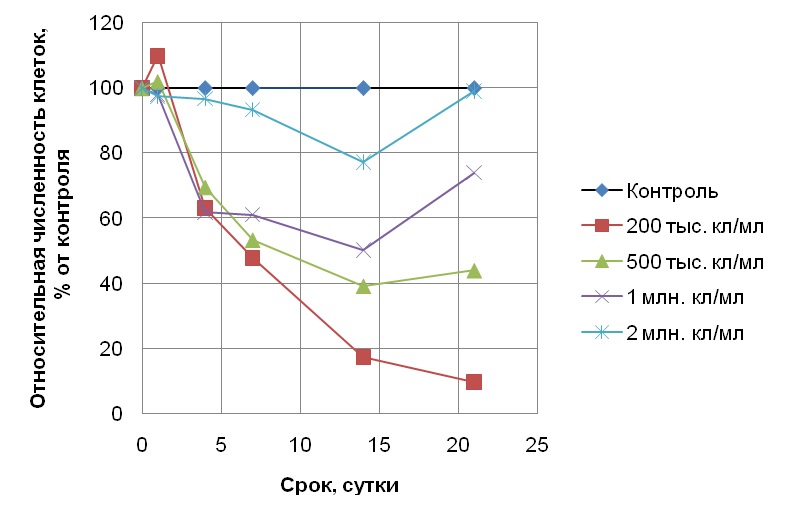
Результаты и обсуждение При исходной плотности популяции клеток водоросли S. quadricauda 100, 200 и 400 тыс. кл/мл в присутствии 1 мг/л хрома (серия 1) в день постановки эксперимента дозы хрома составляли 1·10-8, 5 и 2,5·10-9 мг/кл соответственно. Несмотря на это, во всех случаях токсический эффект хрома оказался одинаковым: наблюдался небольшой, но сходный прирост численности клеток (по отношению к исходному уровню). Таким образом, культуры водоросли в присутствии хрома в концентрации 1 мг/л показывали сходную интенсивность роста при варьировании их начальной плотности в пределах от 100 до 400 тыс. кл/мл, хотя доза токсиканта, приходящаяся на одну клетку, при этом отличалась более, чем в 2 раза. В следующем эксперименте (серия 2) мы увеличили количество хрома в среде до высокотоксичной концентрации 3 мг/л, близкой к летальной. Начальные плотности культур микроводоросли при этом составляли 100 тыс. и 1,5 млн. кл/мл, что соответствовало дозам токсиканта 3·10-8 и 2·10-9 мг/кл. Таким образом, в данном эксперименте дозы токсиканта, приходящиеся на одну клетку, отличались уже в 15 раз. Кроме того, для оценки возможности восстановления популяции с высокой начальной численностью 1,5 млн. кл/мл в присутствии токсиканта опыт продлили до 45 суток (стандартный хронический токсикологический опыт длится 14-21 сутки). Однако численность клеток в культуре с высокой плотностью после добавления хрома в концентрации 3 мг/л (доза токсиканта при этом составляла 2·10-9 мг/кл) постепенно уменьшалась вплоть до конца эксперимента, что свидетельствует об ингибировании клеточного деления и гибели клеток. Отметим, что хром в дозе 2,5·10-9 мг/кл (культура с исходной плотностью 400 тыс. кл/мл в присутствии 1 мг/л токсиканта, серия 1) не оказывал столь сильного воздействия на водоросли, поскольку численность их клеток незначительно возрастала в течении эсперимента. Культура с меньшей плотностью 100 тыс. кл/мл в процессе опыта также практически не нарастала. При этом к концу опыта численность клеток при большой начальной плотности составляла 12%, а при малой – 3% от уровня чистого контроля (без токсиканта). Следовательно, эффект хрома в высокотоксичной концентрации 3 мг/л проявлялся лишь немного сильнее при исходной плотности 100 тыс. кл/мл по сравнению с таковым при исходной плотности 1,5 млн. кл/мл. Такая небольшая разница в ответе популяции микроводоросли на присутствие 3 мг/л хрома при разной начальной плотности клеток связана, прежде всего, с высокой его токсичностью которая при такой высокой концентрации лишь незначительно зависела от плотности популяции. В 3 серии экспериментов по оценке влияния хрома и антибиотика стрептомицина в концентрациях 1 мг/л на популяции S. quadricauda с исходными плотностями 200 тыс., 500 тыс., 1 млн. и 2 млн. кл/мл дозы токсикантов на исходный день постановки экспериментов составляли 5·10-9; 2·10-9; 1·10-9 и 5·10-10 мг/кл соответственно. Параллельно был поставлен контроль с такими же плотностями клеток, но без добавления токсикантов. По результатам хронических 21-суточных экспериментов с антибиотиком было обнаружено, что самая высокая его токсичность наблюдалась при начальных плотностях 200 и 500 тыс. кл/мл (рис. 1), причем ингибирование роста численности (т.е. интенсивность токсического эффекта) оказалось сходным и составило 68 и 66% от контроля соответственно. С увеличением плотности популяции до 1 млн. кл/мл токсичность антибиотика снижалась, а при начальной плотности 2 млн кл/мл отмечали лишь кратковременный токсический эффект на 4 сутки опыта, но в дальнейшем токсичность практически не проявлялась, поскольку рост водоросли был на уровне чистого контроля. Таким образом, токсичность 1 мг/л антибиотика уменьшалась с увеличением начальной плотности клеток от 500 тыс. до 2 млн. кл/мл. В опыте с хромом в концентрации 1 мг/л зависимость токсического эффекта от начальной плотности популяции оказалась выражена сильнее. При исходных плотностях 200 тыс., 500 тыс. и 1 млн. кл/мл наблюдалось ингибирование роста численности популяции, причем степень ингибирования роста находилась в обратной зависимости от величины начальной плотности популяции (рис. 2). Так, к концу 21-суточного эксперимента численность популяции с исходной плотностью 200 тыс. кл/мл, росшей в присутствии хрома, составила 9,5% от уровня контрольной, в то время как популяции с исходными плотностями 500 тыс. и 1 млн. кл/мл достигли численностей 44 и 74% от контроля соответственно. Таким образом, каждое увеличение плотности культуры в 2–2,5 раза приводило к снижению токсичности на 20–25%. Отметим, что как и в эксперименте с антибиотиком, при максимальной в данной серии опытов начальной плотности популяции 2 млн. кл/мл токсический эффект также практически не наблюдался, а к концу эксперимента численность клеток водоросли достигла уровня контрольной культуры без добавления токсиканта.
Рис. 1. Изменение относительной численности клеток Scenedesmus quadricauda в присутствии 1 мг/л стрептомицина при разной исходной плотности популяции. Fig. 1. Change in the relative number of Scenedesmus quadricauda cells in the presence of 1 mg/l of streptomycin at various initial population densities.
Сопоставляя полученные нами данные о действии хрома и стрептомицина на культуру S. quadricauda при варьировании ее исходной плотности от 200 тыс. до 2 млн. кл/мл, можно увидеть, что для хрома влияние этого фактора на токсичность (т.е. уменьшение токсического эффекта с ростом начальной плотности культуры) проявлялось, начиная с плотности 500 тыс. кл/мл, а при меньших плотностях (200 и 400 тыс. кл/мл) токсический эффект оказывался сходным. Для антибиотика же уменьшение токсического эффекта наблюдалось при увеличении исходной плотности популяции от 500 тыс. до 1 млн. кл/мл. Такая разница в ответе водоросли на токсическое действие хрома и стрептомицина вероятнее всего связана с разной природой токсикантов и, в частности, с антибактериальными свойствами стрептомицина, учитывая то, что мы использовали альгологически чистую, а не бактериально чистую культуру водоросли.
Рис. 2. Изменение относительной численности клеток Scenedesmus quadricauda в присутствии 1 мг/л хрома при разной исходной плотности популяции. Fig. 2. Change in the relative number of Scenedesmus quadricauda cells in the presence of 1 mg/l of chromium at various initial population densities.
Полученные нами данные о действии хрома на культуры водоросли с разной исходной плотностью хорошо согласуются с результатами работ других авторов. Изучение влияния различной исходной плотности клеток для двух видов водорослей на токсичность меди (Franklin et al., 2002) показало, что ее токсичность уменьшалась с увеличением плотности популяций. Данные по внеклеточному (на поверхности клеток) и внутриклеточному содержанию меди подтверждают, что при более высокой начальной плотности клетками связывается меди меньше, что приводит к ее меньшему поглощению внутрь клеток и более низкой токсичности. Сходный эффект был получен и другими авторами (Sunda, Huntsman,1998; Vasseur et al., 1988). Чем больше меди связывалось клеточной поверхностью, тем больше было поглощение меди внутрь клеток через клеточную мембрану и тем более сильный эффект был выражен на процессы деления клеток. Для оказания воздействия на клетку металл должен связаться с рецептором на клеточной поверхности, после чего транспортироваться через клеточную мембрану и поступить в цитоплазму (Franklin et al., 2002). Первоначальная токсическая нагрузка определяется адсорбцией металлов клетками, зависящей от площади клеточной поверхности и количества связывающих сайтов. Более высокая плотность клеток водорослей при биотестировании создает большую площадь поверхности с большим числом связывающих сайтов, но в расчете на одну клетку при этом приходится меньшее количество металла, что и определяет уменьшение его токсичности. С увеличением числа клеток водорослей повышается продукция их экзометаболитов (например, гликолевой кислоты и полисахаридов), образующих комплексы с токсикантами, в частности, с металлами (Sunda, Huntsman,1998), что приводит к уменьшению биодоступности веществ в растворе, а, следовательно, к уменьшению их токсичности. Развитие водорослей и высокие плотности их популяций могут вызывать изменения рН и последующие химические изменения тестовых веществ (Vasseur et al., 1988). Увеличение рН также может играть роль в понижении токсичности металлов при массовом развитии водорослей путем образования нерастворимых форм металлов. Так, было показано, что повышение рН тестируемой среды, содержащей высокую численность клеток, было вероятным механизмом, ответственным за понижение токсичности Cu, Cd и Zn для Selenastrum capricornutum с увеличением инокулята от 104 до 106кл/мл (Vasseur et al., 1988). В настоящей работе мы изучали действие бихромата калия, а не иона хрома, на культуру водоросли, тем не менее, токсичность бихромата определяется присутствием в нем именно хрома. Мы не исследовали химические превращения хрома в растворе и его концентрацию внутри клеток и на их поверхности, но можем предположить, что после различных физико-химических превращений и адсорбции токсиканта на поверхности клеток хром может проникать в клетку в виде металл-иона.
Заключение Выбор оптимальной начальной клеточной плотности культур водорослей имеет большое значение при проведении токсикологических лабораторных испытаний, поскольку от этого параметра непосредственно зависит получаемая экспериментальным или расчетным путем величина полуэффективной концентрации (ЭК50) веществ, а также другие важные параметры токсичности. При более высокой плотности клеток водорослей при проведении процедуры биотестирования в расчете на одну клетку приходится меньшее количество токсиканта. Наши результаты показали, что токсичность хрома в концентрации 1 мг/л не зависела от начальной плотности клеток водоросли в диапазоне 100–400 тыс. кл/мл, но, в то же время, токсический эффект уже различался при исходной плотности 200 и 500 тыс. кл/мл. С увеличением же начальной клеточной плотности более 500 тыс. кл/мл токсичность как 1 мг/л хрома, так и 1 мг/л стрептомицина уменьшалась существенно. Поэтому биотестирование с использованием культур микроводорослей с начальной плотностью более 105 кл/мл может потенциально недооценивать токсичность веществ. Рекомендуется, чтобы начальная плотность популяции клеток водорослей при биотестировании не превышала 105кл/мл. Однако в природных условиях численность микроводорослей в большинстве случаев ниже 105 кл/мл. Учитывая также, что токсичность испытуемых веществ может уменьшаться в результате различных превращений их в растворе, вызванных присутствием в среде метаболитов или увеличением рН, биотестирование следует проводить еще с более низкой начальной численностью клеток популяций микроводорослей, порядка 102–104 кл/мл. Большинство методик биотестирования рекомендуют начальные плотности популяции 104–106 кл/мл. Считается, что это компромисс между максимальной чувствительностью испытания и достаточным количеством клеток для определения изменения численности в течение срока биотестирования. Однако численность 105–106 кл/мл намного выше, чем бывает даже при условии цветения. В последнее время в экотоксикологии начинают применять более современный проточный счет клеток, что делает возможным регистрацию единичных клеток и проведение биотестирования при малой плотности клеток водорослей 102–103 кл/мл, которая является наиболее обычной в природных водных системах. Использование сходных с природным уровнем клеточных плотностей в биотестировании поможет уменьшить химические изменения и превращения исследуемых веществ, связанные с их взаимодействием с клетками так, чтобы токсичность, определяемая в биотестировании с применением культур водорослей и цианобактерий, более близко оценивала биодоступность и токсичность веществ в природной среде.
Работа выполнена в рамках гостемы «Исследование эффекта потенциально токсичных веществ на водные организмы и сообщества с целью защиты водных экосистем».
Список литературы 1. Бурлакова З.П., Крупаткина Д.К., Ланская Л.А., Яфарова Д.Л. Влияние плотности популяции морских одноклеточных водорослей на потребление фосфора и основные физиологические показатели клеток // Взаимодействие между водой и живым веществом: Тр. Междунар. симпоз. (Одесса, 6-10 окт. 1975 г.). – М.: Наука, 1979. – Т. 1. – С. 231–235. 2. Успенская В.И. Экология и физиология питания пресноводных водорослей. – М.: Изд-во МГУ, 1966. – 124 с. 3. Demirezen D., Aksoy A., Uruc K. Effect of population density on growth, biomass and nickel accumulation capacity of Lemna gibba (Lemnaceae) // Chemosphere. 2007. V.66. P. 553–557. 4. Franklin N.M., Stauber J.L., Apte S.C., Lim R.P. Effect of initial density on the bioavailability and toxicity of copper in microalgal bioassays // Environ. Toxicol. Chem. 2000. V.21. P. 742–751. 5. Sunda W.G., Huntsman S.A. Processes regulating cellular metal accumulation and physiological effects: Phytoplankton as model system // Sci. Total Environ. 1998. V.219. P. 165–181. 6. Vasseur P., Pandard P., Burnel D. Influence of some experimental factors on metal toxicity to Selenastrum capricornutum // Toxic Assess. 1988. V.3. P. 331–343. Статья поступила в редакцию 18.12.2016
The impact of population size of the test object Scenedesmus quadricauda (Turpin) Bréb. Valentina I. Ipatova The effect of initial population density of green microalga Scenedesmus quadricauda (Turpin) Bréb. on the toxicity estimation of the heavy metal chromium and the antibiotic streptomycin was studied. The increase of the initial density of the culture by a factor of 2–2.5 leads to a reduction in toxicity in 20–25%. Initial microalgal cell population density in bioassay should not exceed 105 cells/ml, since the use of cultures of microalgae with a density of more than 105 cells/ml can lead to an underestimation of the potential toxicity of the substances. Keywords: initial population density; microalgae; bioassay; toxic substances.
Об авторе Ипатова Валентина Ивановна - Ipatova Valentina Ivanovna кандидат биологических наук viipatova@hotmail.com Корреспондентский адрес: Россия, 119991, Москва, Ленинские горы, Московский Государственный Университет им.М.В.Ломоносова, д. 1, стр. 12, Биологический ф-т, каф. гидробиологии; тел.: (495) 939-27-73
ССЫЛКА НА СТАТЬЮ: Ипатова В.И. Влияние размера популяции тест-объекта Scenedesmus quadricauda (Turpin) Bréb. на результаты биотестирования // Вопросы современной альгологии. 2017. № 1 (13). http://algology.ru/1153 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||