|
|
|
Влияние освещения и температуры на макроводоросли Баренцева моря
Макаров М.В., Воскобойников Г.М. Mikhail V. Makarov, Grigory M. Voskoboynikov
Мурманский морской биологический институт КНЦ РАН (г. Мурманск)
УДК 574.23+574.24+574.522
Представлен обзор исследований, проведенных за последние 20 лет в лаборатории альгологии Мурманского морского биологического института. Основное направление исследований – раскрытие механизмов адаптации водорослей к условиям Арктических морей. Показано влияние интенсивности, фотопериода и спектрального состава освещения на морфо-физиологические параметры водорослей, находящихся на разной стадии онтогенетического развития. Выявлены механизмы, позволяющие водорослям-макрофитам существовать в условиях полярной ночи при отсутствии освещения и низких температурах. Результаты исследований позволяют сделать вывод, что адаптация к длительному отсутствию освещения и низкой температуре способствовала распространению водорослей за пределы полярного круга. Ключевые слова: макроводоросли; адаптация; освещение; температура.
Несмотря на более чем двухвековой период исследований водорослей-макрофитов арктических морей, многие физиологические особенности, позволяющие им существовать в суровых условиях, остаются малоизученными. Также являются актуальными и проблемы биоразнообразия и возможности распространения водорослей в высокие широты. При наличии большого количества теорий, описывающих основы биоразнообразия и распределения наземных и морских организмов (см. обзор Willig et al., 2003), лишь единицы из них рассматривают механизмы, обеспечившие возможность распространения водорослей и приведшие к образованию новых видов в процессе эволюционного развития (Перестенко, 1998; Howe, Brunner, 2005). Водоросли арктических морей, особенно обитающие в литоральной зоне, произрастают в уникальных условиях. Зимой, в период полярной ночи, они находятся не только при отсутствии освещения (или крайне низком), но и в условиях низкой температуры морской воды (до минус 1,5°С) и промерзания на литорали во время отливов, истирания льдом. Летом, в полярный день – высокая интенсивность и продолжительность освещения, высыхание в период отлива или смена солености вплоть до нулевой вследствие дождей. В течение года также значительно меняется спектральный состав освещения вследствие различной высоты поднятия солнца над уровнем горизонта, высота прилива (фактор, от которого зависит интенсивность и спектральный состав освещения, гидростатическое давление, продолжительность нахождения на воздухе в период отлива), количество планктонных организмов, растворенного органического и взвешенного вещества и т.д. Подобный набор факторов вполне можно было бы назвать экстремальными или стрессовыми условиями, однако, судя по биоразнообразию водорослей и их биомассе, они вполне приспособлены к подобному существованию. А это значит, что у них выработались адаптации к обитанию в столь суровых условиях. В данной статье мы остановимся на кратком рассмотрении только двух абиотических факторов среды, оказывающих влияние на макроводоросли арктических морей, – температуры и освещения. С влиянием первого фактора разобраться достаточно легко, определив оптимальные температуры произрастания, а также возможности выдерживать отрицательные и положительные температуры. Со вторым гораздо сложнее, поскольку освещение можно разложить на 3 составляющих – интенсивность, фотопериод и спектральный состав освещения, каждая из которых имеет собственное влияние, однако в природе они действуют совместно, и имеют свои суточные и годовые кривые изменений. Сложность исследованиям добавляет и то, что помимо экзогенного воздействия факторов среды у водорослей имеется и эндогенная регуляция физиологических процессов. И если одни ее проявления хорошо заметны, например, начало роста некоторых видов в середине полярной ночи (Makarov et al., 1999), то другие могут перекрываться действием внешних короткопериодических (суточная смена освещения, приливоотливные циклы) и продолжительных (полярный день – полярная ночь) воздействий (Lüning, 1990). Проведенные в лаборатории альгологии Мурманского морского биологического института многолетние натурные наблюдения и многочисленные эксперименты, краткий обзор которых представлен в настоящей статье, позволяют утверждать, что возможность приспособления отдельных видов водорослей к низкой температуре и смене освещения от полярного дня до полярной ночи также оказывала влияние на их распространение в высокие широты. Это подтверждает выдвинутую в последние годы гипотезу о комплексном барьере, контролирующем биогеографическое распространение водорослей (см. обзоры Campana et al., 2009; Gómez et al., 2009; Wulff et al., 2009; Zacher et al., 2009).
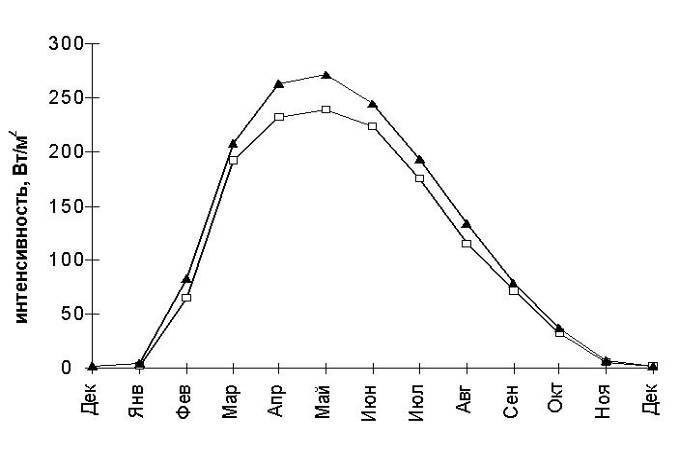
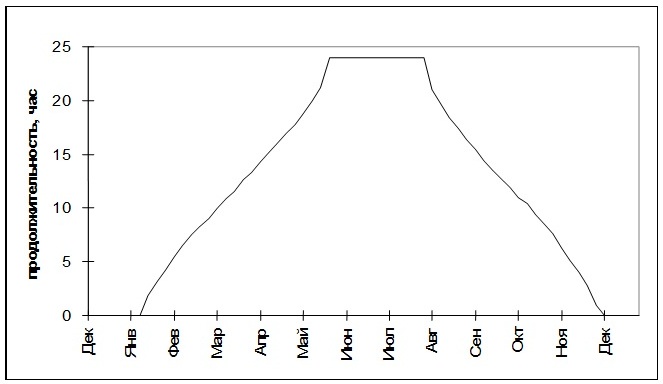
1. Интенсивность освещенияДиапазон интенсивности освещения, необходимый для эффективной работы фотосинтетического аппарата, ограничивается нижним лимитирующим пределом, при котором обеспечиваются энергетические потребности организма на конкретном этапе онтогенеза, и верхним, при котором вследствие избыточного освещения происходит деструкция фотосинтетического аппарата. Ранние стадии развития (споры, гаметы, гаметофиты, проростки), в связи с отсутствием или неразвитостью защитных механизмов, обычно менее приспособлены к высокому уровню освещения по сравнению со взрослыми растениями. Как уже говорилось, водоросли арктических морей испытывают значительные колебания освещенности в течение года (Рис. 1). Вследствие этого наблюдаются и значительные изменения фотосинтетического аппарата водорослей, т.к. возможность их произрастания в высокоширотных районах с меняющимися условиями освещения от полярного дня до полярной ночи зависит от адаптационных возможностей их фотосинтетического аппарата.
Рис. 1. Изменение интенсивности освещения на Мурманском побережье Баренцева моря
Поэтому для понимания процессов адаптации водорослей к условиям внешней среды необходимо исследовать ответные реакции и физиологическое состояние организма на всех стадиях онтогенеза.
1.1. Влияние интенсивности освещения на ранние стадии онтогенеза У зеленых водорослей наличие фототаксиса у спор и гамет способствует их движению по направлению к зоне с оптимальными условиями освещения. У зооспор бурых ламинариевых водорослей фототаксис отсутствует, однако имеется хемотаксис (Макаров, 1987), определяющий их движение по направлению к взрослым растениям, прорастание под пологом которых способствует выживанию растений на ранних стадиях развития. В этом случае хемотаксис аналогичен фототаксису. Изучение процессов развития гаметофита и раннего спорофита ламинариевых водорослей продолжается уже более века. Большой вклад в данное направление исследований внес сотрудник ММБМ Владимир Николаевич Макаров, чьи работы легли в основу плантационного выращивания данного вида на Белом и Баренцевом морях. Нами было проведено исследование влияния интенсивности освещения на скорость оседания, прорастание и развитие спор, гаметофитов и ранних спорофитов S. latissima Баренцева моря. Диапазон освещения составлял от 0,5 до 100 Вт/м2, что соответствует природным условиям в период выхода спор у данного вида. Результаты экспериментов с движущимися зооспорами показали, что характер движения и скорость их оседания не зависят от интенсивности освещения. Устойчивость зооспор может быть связана с тем, что фотосинтетический аппарат у них еще не сформирован окончательно. Воздействие высокой интенсивности освещения (75 Вт/м2 и выше) на последующие стадии раннего развития S. latissima, с уже сформированным фотосинтетическим аппаратом, вызывало их гибель. Устойчивость зависела от длительности освещения: эмбриоспоры выдерживали до 2 сут, ранние спорофиты – до 10 сут. Диапазон толерантности и зона оптимума освещенности отличаются для ламинарии различных видов или произрастающих в разных условиях. Для развития гаметофитов дальневосточной ламинарии японской (=S. japonica) оптимальной является интенсивность освещения 30 Вт/м2 и более (Yabu, 1964), хотя другие данные указывают на диапазон 120–250 Вт/м2 (Мальцев, 1978). Для беломорской ламинарии оптимальным является освещение 5–30 Вт/м2 (Макаров, 1987). Результаты наших исследований показали, что для баренцевоморской S. latissima оптимум находится в диапазоне освещения 10–50 Вт/м2. По-видимому, отличия объясняются световыми условиями в местах естественного произрастания данных видов.
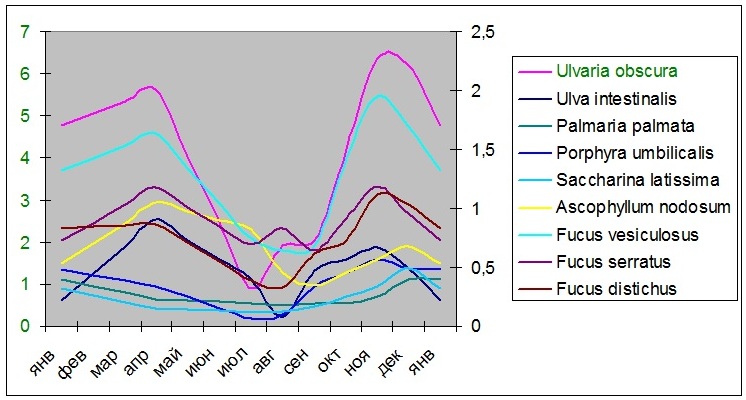
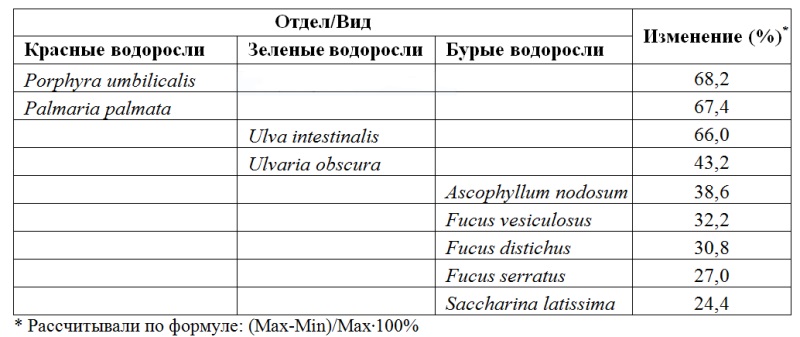
1.2. Сезонные изменения фотосинтетического аппарата водорослей Наши исследования показали, что адаптация происходит на разных уровнях организации и проявляется в изменении площади фотосинтетических мембран, содержания и соотношения фотосинтетических пигментов, размера светособирающих комплексов (ССК), содержания экранирующих и абсорбирующих веществ (Макаров, 2010). Максимальное содержание фотосинтетических пигментов (Рис. 2) и наибольший ССК у всех видов водорослей также наблюдается в апреле и ноябре-декабре, минимальное – в июле-августе (Макаров, 2010). Анализ размеров ССК в течение года (таб. 1) показал, что наибольшим изменениям подвержен фотосинтетический аппарат красных водорослей за счет разрушения фикобилиновых пигментов в летний период, у бурых водорослей он наиболее стабилен. Кроме этого, размер ССК зависит от глубины произрастания водорослей: наименьшие изменения наблюдаются у сублиторальных видов.
Рис. 2. Содержание фотосинтетических пигментов водорослей
Анализ каротиноидных пигментов показал достаточно большое их содержание у всех исследованных видов водорослей. По изменению соотношения Хл/Кар водоросли четко разделяются по систематическим группам. У зеленых водорослей данный показатель достаточно стабилен в течение года, соотношение составляет около 2, увеличение соотношения до 3,5 наблюдается январе. У красных водорослей в течение лета он постоянен и составляет около 2 и значительно, до 5, повышается в зимне-весенний период. У бурых водорослей в течение года соотношение хлорофиллов и каротиноидов достаточно стабильное, около 2 (Макаров, 2010).
Таблица 1. Изменение относительных размеров ССК водорослей в течение года
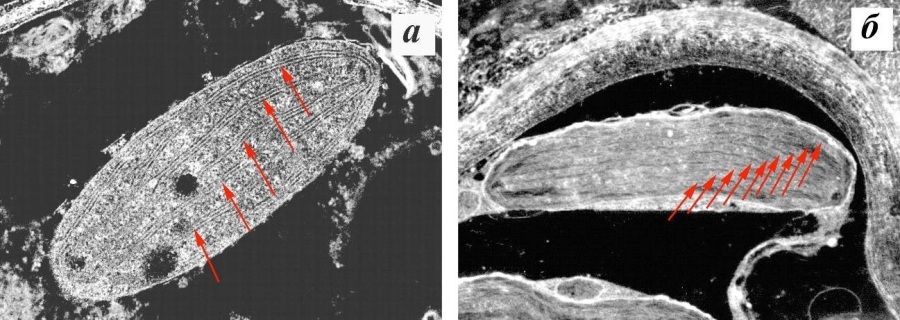
Исследование ультраструктуры хлоропластов зеленой водоросли Ulvaria obscura показало, что в зимний период, по сравнению с летом, значительно увеличивается парциальный объем мембран тилакоидов на единицу площади стромы хлоропласта. Тилакоиды в зимнее время выглядят более плотно упакованными, отмечается уменьшение числа рибосом в строме (Воскобойников и др., 2004). Сходные изменения отмечаются и у других видов водорослей. Например, у F. vesiculosus различия по соотношению площади среза хлоропласта и длины фотосинтетических мембран в летний период по сравнению с зимним увеличивается более чем в 6 раз (Рис. 3). Весной большая площадь фотосинтетических мембран и высокая активность фотосинтетического аппарата связана с активным ростом водорослей.
Рис. 3. Хлоропласты F. vesiculosus летом (а) и зимой (б).
Проведенные нами исследования позволили выявить структурные и функциональные перестройки фотосинтетического аппарата, позволяющие водорослям Баренцева моря эффективно функционировать в течение всего года при значительных изменениях интенсивности освещения. У разных видов водорослей выявлены одинаковые ответные реакции, что может быть связано с их приспособленностью к существованию в высоких широтах.
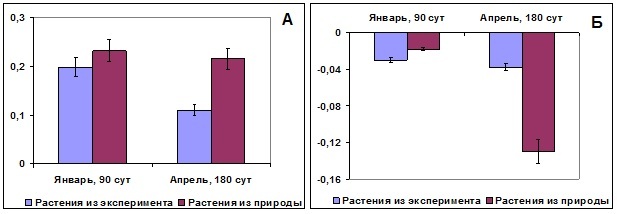
1.3. Механизмы существования водорослей в период полярной ночи и при отсутствии освещения На Мурманском побережье Баренцева моря полярная ночь длится около 1 месяца, средняя интенсивность фотосинтетически активной радиации (ФАР) в середине декабря в полдень составляет 3 Вт/м2. На широте Шпицбергена полярная ночь длится около 4 месяцев, из них 2 месяца освещение полностью отсутствует. Наши исследования показали наличие физиологической активности водорослей в период полярной ночи (Voskoboinikov et al., 2001; Тропин, Макаров, 2004; Матишов, Макаров, 2004; Воскобойников и др., 2006; Макаров и др., 2006). На Мурманском побережье интенсивность фотосинтеза у большинства видов водорослей в дневное время в несколько раз превышает дыхание (хотя при пересчете на суточную продукцию дыхание превалирует). Для исследования функционального состояния водорослей в период полярной ночи на более высоких широтах, где наблюдается отсутствие освещения, был разработан специальный светонепроницаемый контейнер, который помещали в море. Экспериментально были выявлены различные механизмы, позволяющие водорослям переживать неблагоприятный период, и показано, что продолжительность их существования при отсутствии освещения зависит от структуры таллома и типа меристематической зоны (Макаров, 2010). Однолетние водоросли при недостатке освещения находятся в покоящейся стадии. Большинство видов зимний период переживают в виде микроскопических стадий жизненного цикла (гаметофитов или спор) (Breeman, 1988; tom Dieck, 1993). Многолетние красные и зеленые макроводоросли, имеющие тонкопластинчатую организацию таллома и диффузный рост (отсутствие дифференцированной зоны роста), наиболее чувствительны к недостатку освещения. Продолжительность их существования ограничена количеством внутриклеточных запасных веществ и составляет около 30 суток. У более высокоорганизованных бурых водорослей кроме потребления запасных веществ имеются дополнительные механизмы, обеспечивающие их существование при отсутствии освещения, обусловленные физиологической дифференциацией различных участков таллома. Структура их таллома изначально определяет транспорт веществ и гетеротрофный способ питания внутренних слоев клеток, лишенных возможности фотосинтетической ассимиляции углерода, путем передачи ассимилятов от внешних фотосинтезирующих клеток. При недостатке освещения запасенные во внутренних слоях клеток ассимиляты, наоборот, передаются к клеткам фотосинтезирующего слоя (донорно-акцепторная система). У Saccharina latissima зона роста расположена на границе стволика и пластины, в естественных условиях в зимний период пластина разрушается, остается только зона роста и небольшой участок центральной части пластины. При этом происходит «ближний» транспорт запасных веществ из гетеротрофных слоев клеток центральной части к клеткам внешнего фототрофного слоя и «дальний» транспорт ассимилятов от разрушающихся клеток волана и дистальной части пластины к зоне роста, что позволяет ей длительное время (до 60 суток) оставаться в интактном состоянии даже при отсутствии освещения (Макаров и др., 2006). Возможно, что данный механизм позволяет запускать ростовые процессы в период полярной ночи (Dunton, Schell, 1986; Makarov et al., 1999). У фукусовых водорослей зона роста апикальная, и они не могут, подобно ламинариевым водорослям, активно использовать органические вещества, образующиеся при автолизе таллома. Однако нами было показано, что F. vesiculosus способен до 9 месяцев сохранять жизнеспособность при нахождении в условиях отсутствия освещения. Через 3 месяца нахождения водорослей в темноте наблюдалось образование органов размножения (рецептакулов). Через 6 месяцев их фотосинтетический аппарат сохранялся в интактном состоянии, количество и соотношение фотосинтетических пигментов оставалось неизменным. Интенсивность фотосинтеза и дыхания менялись незначительно, уровень фотосинтеза (как при освещении низкой (3 Вт/м2) так и высокой (100 Вт/м2) интенсивностью) был в 6–8 раз выше, чем дыхания (Рис. 4). На ультраструктурном уровне наблюдали уменьшение размеров и снижение электронной плотности гранул полисахаридной природы, увеличение удельной доли митохондрий и крист в митохондриях. Через 9 месяцев нахождения в темноте у растений в неповрежденном состоянии оставались только апикальные участки, нижняя часть таллома разрушалась.
Рис. 4. Интенсивность фотосинтеза (А) и дыхания (Б) F. vesiculosus через 3 месяца (январь) и 6 месяцев (апрель) нахождения в темноте. По оси ординат – выделение/поглощение кислорода растениями, мкг О2/г сыр. массы в час
Возможность длительного существования фукоидов в условиях отсутствия освещения скорее всего связана с их способностью к поглощению растворенных органических веществ, что было показано ранее (Хайлов, 1971; Хайлов, Фирсов, 1976; Хайлов, Монина, 1977). По всей вероятности, органические вещества используются макрофитами для поддержания энергетического обмена, поскольку нами было показано поглощение карбонат-ионов при отсутствии световой фиксации СО2 (Тропин, Макаров, 2004), что было также отмечено и для других видов водорослей (Титлянов и др., 1972; Быков, 2003; Колмаков, 2005; Трусова, 2009). Исследования ультраструктуры клеток и тканей Fucus vesiculosus выявили, что в летний период на поверхности водорослей присутствуют единичные бактерии. В апикальной части таллома обнаруживается большое число делящихся клеток, ядра которых, в зависимости от стадии деления, различаются по ультраструктуре. Хроматин находится в различной степени конденсации: от дисперсного до собранного в глыбки. В цитоплазме присутствует большое количество рибосом, как свободных, так и прикрепленных к мембранам ретикулума. Хорошо выражены мембраны шероховатого ретикулума. Эти признаки свидетельствуют об активных процессах синтеза белка. В периферических рядах клеток содержится большое число электронноплотных гранул, по-видимому, физодов, которые занимают до 30% площади среза клеток. Хлоропласты овальной формы, длиной до 12 мкм, их расположение в основном пристеночное. Внешняя мембрана многих хлоропластов контактирует с мембранами гладкого ретикулума. Фотосинтетические мембраны хлоропластов хорошо выражены: комплексы из трех тилакоидов тянутся параллельными рядами через весь хлоропласт. В строме выявляется большое число рибосом. После трехмесячного пребывания в темноте наружная поверхность водорослей покрыта слоем бактерий. Проникновения бактерий в межклеточники и внутрь клеток не отмечается. Делящиеся клетки отсутствуют. Вместе с тем, отмечается сегрегация хроматина в ядрах большинства клеток, уменьшение числа рибосом в цитоплазме, преобладание мембран гладкого ретикулума над шероховатым. В ряде клеток периферии апекса до 50% объема занято физодами. Хлоропласты не отличаются по форме, размерам, локализации в клетке от хлоропластов водорослей в летний период, однако зимой количество фотосинтетических мембран значительно увеличивается. В клетках не отмечено признаков деградации каких-либо структур. Таким образом, после длительного пребывания в темноте (2 месяца в природных условиях, возле Шпицбергена, и более 6 месяцев в экспериментальных условиях) F. vesiculosus сохранил жизнеспособность, признаки повреждения клеток отсутствуют. Морфологические характеристики свидетельствуют о замедлении его функциональной активности. Проведенные нами исследования показали, что на Мурманском побережье возможность существования водорослей в период полярной ночи обеспечивается адаптацией фотосинтетического аппарата к низкому уровню освещения. Для водорослей более высоких широт переживание периода отсутствия освещения обеспечивается потреблением запасных веществ, продуктов автолиза таллома и внешних растворенных органических веществ, что может являться важным условием распространения водорослей в высокие широты.
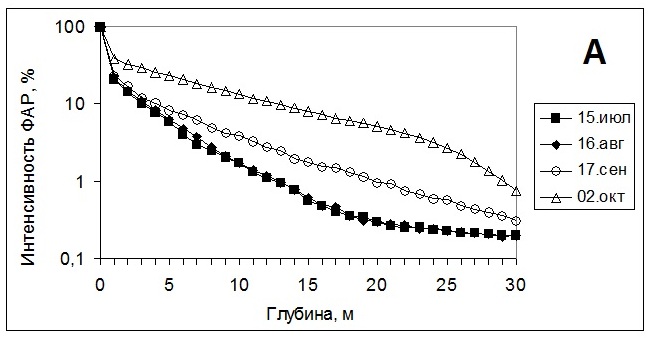
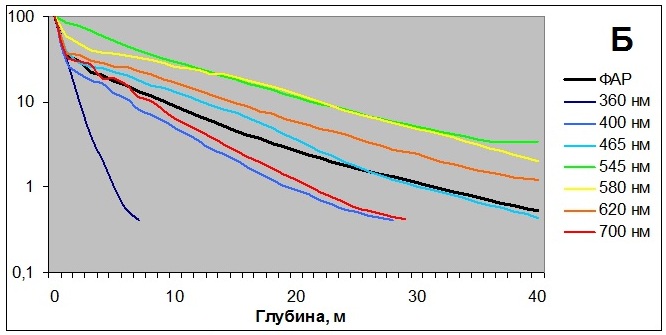
2. Спектральный состав освещенияСпектральный состав освещения изменяется как в течение года, что связано с высотой поднятия солнца над уровнем горизонта, так и с глубиной, на которой произрастают водоросли. Наши исследования в губе Зеленецкой (Мурманское побережье Баренцева моря) показали, что более 80% освещения задерживается верхним метровым слоем воды. Причем наиболее ярко это проявляется в летний период (рис. 5А). Глубина проникновения различных длин волн также различна. Глубже всего проникает зеленый и желтый свет, быстрее всего задерживаются волны красного и синего света, особенно ультрафиолет (Рис. 5Б), хотя, как будет показано далее, он оказывает значительное влияние на водоросли. Однако при исследовании физиологического состояния водорослей при произрастании на различной глубине остается непонятным, что оказывает первостепенное воздействие – изменение спектрального состава освещения или снижение его интенсивности. К тому же, как показали другие наши исследования, влияние может оказывать и увеличение гидростатического давления (Макаров, 2011).
Рис. 5. Изменение интенсивности освещения с глубиной (А)
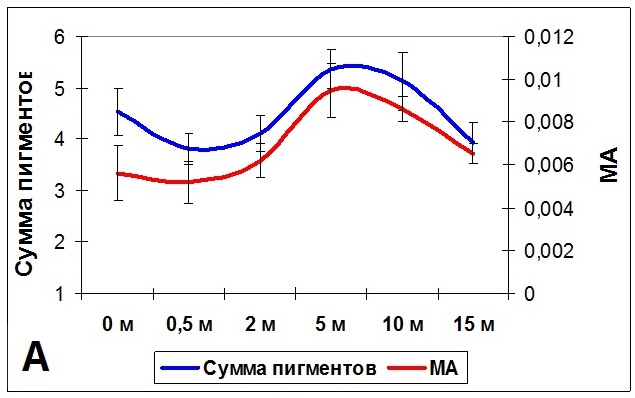
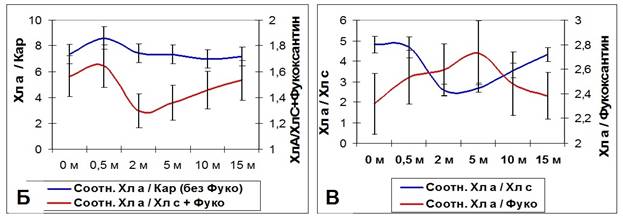
2.1. Влияние спектрального состава освещения (глубины произрастания) на светособирающий комплекс Fucus vesiculosus Существует большое количество исследований, посвященных эффекту хроматической адаптации водорослей. Однако большой объем противоречивых данных и сложности с их интерпретацией затрудняют понимание происходящих процессов. Достаточно подробно сравнение специфической и неспецифической световой и хроматической адаптаций проводится в статье Ф.Ф. Литвина и В.И. Звалинского (1983). Проведенные нами исследования показали перестройки светособирающего комплекса бурой литоральной водоросли Fucus vesiculosus в ответ на изменение спектрального состава освещения при увеличении глубины произрастания. У бурых водорослей светособирающий комплекс назван FCPA (Fucoxanthin-Chlorophyll-Protein Assembly) или «ксантосомой». Комплекс состоит из 7 идентичных белковых субъединиц по 54 кДа, каждая из которых содержит 13 молекул Хл a, 3 – Хл c, 10 – фукоксантина и 1 – виолаксантина. Миграция поглощенной энергии в ксантосомах происходит по 2 независимым путям, различающимся по скорости, но не по эффективности: от фукоксантина на Хл a и от Хл c на Хл a (Alberte et al., 1981; Katoh et al., 1989; Mimuro et al., 1990). Однако соотношение пигментов может варьировать в зависимости от видовой принадлежности (Barrett, Anderson, 1980; Katoh et al., 1989, 1993; Mimuro et al., 1990; Passaquet et al., 1991; Douady et al., 1993). У высших растений и зеленых водорослей содержание хлорофилла в ССК рассчитывают по соотношению Хл a/Хл b (Lichtenthaler, 1987). Поскольку у бурых водорослей соотношение пигментов в ССК неизвестно, то распределение Хл a по пулам ССК или ФС можно условно определить по соотношению Хл a/Хл c+фукоксантин. По аналогии с зелеными водорослями наименьшее значение данного показателя будет указывать на максимальный размер ССК. В состав ССК высших растений и зеленых водорослей в качестве основного светособирающего пигмента кроме Хл а входит только Хл b. Поэтому при изменении спектрального состава освещения у данной группы организмов можно выявить лишь изменение размера ССК, но не перестройку его структуры. В состав ССК красных водорослей (фикобилисома) кроме Хл а входит 2 пигмент-белковых комплекса: фикоэритрин и фикоцианин, с максимумами поглощения в различных областях спектра. И все исследования хроматической адаптации красных водорослей указывают на факт изменения соотношения именно данных пигментов. Таким образом, здесь выявляется перестройка структуры фикобилисомы. У бурых водорослей в состав ксантосомы кроме Хл а также входит 2 светособирающих пигмента, Хл с и фукоксантин, с различными спектрами поглощения. И изменение соотношения данных пигментов также будет указывать на перестройку структуры ксантосомы как адаптацию к изменению спектрального состава освещения. Для определения адаптационных перестроек ФСА талломы F. vesiculosus, собранные с литорали, помещали на глубины от 0 до 15 м, где они находились в течение месяца. Адаптация ФСА растений к снижению интенсивности освещения происходила путем изменения содержания фотосинтетических пигментов с параллельным изменением метаболической активности клеток водорослей (Рис. 6А), а также изменения размеров ксантосом. Максимальный их размер (минимальное соотношение Хл а/Хл с+фукоксантин) наблюдался при нахождении растений на глубине 2 м и снижался с дальнейшим увеличением глубины (Рис. 6Б) (Макаров и др., 2010). Метаболическую активность клеток определяли тетразолиевым методом (Рыжик, 2013). Изменение размеров ксантосомы сопровождалось перестройкой ее структуры: изменялось соотношение Хл а/Хл с и Хл а/фукоксантин, причем изменения происходили в противофазе (Рис. 6В). В основном менялось содержание Хл с, а содержание фукоксантина оставалось более стабильным. Возможно, что имеет место функциональная специализация данных пигментов: энергия квантов света с фукоксантина в большей степени передается на ФС I, a с хлорофилла с – на ФС II, что подтверждается результатами исследований фотосинтетического аппарата и функционирования фотосистем F. vesiculosus Балтийского и Норвежского морей (Gylle et al., 2011). При адаптации к интенсивности освещения, которое меняется в течение года, изменение размеров ксантосомы у F. vesiculosus происходит без перестройки ее структуры: соотношение Хл а/фукоксантин и Хл а/Хл с изменяются синхронно.
Рис. 6. Изменение содержания фотосинтетических пигментов F. vesiculosus (сумма хлорофиллов и каротиноидов) и метаболической активности (МА) клеток (А), размеров ксантосомы (Б) и соотношения входящих в нее пигментов (В) в зависимости о глубины
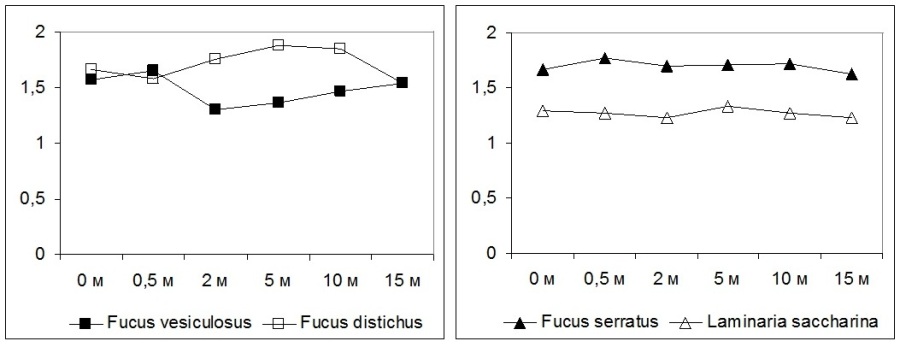
Дальнейшие исследования показали, что фотосинтетический аппарат разных видов водорослей, даже принадлежащих к одному отделу, по разному реагирует на изменение глубины произрастания. Если у F. vesiculosus адаптация к увеличению глубины происходит путем увеличения размеров ксантосомы, то у F. distichus размеры ксантосомы снижаются, а у F. serratus и S. latissima – не изменяются (Рис. 7). Рис. 7. Изменение размеров ксантосомы (соотношение Хл а/Хл с+фукоксантин) разных видов бурых водорослей в зависимости от глубины
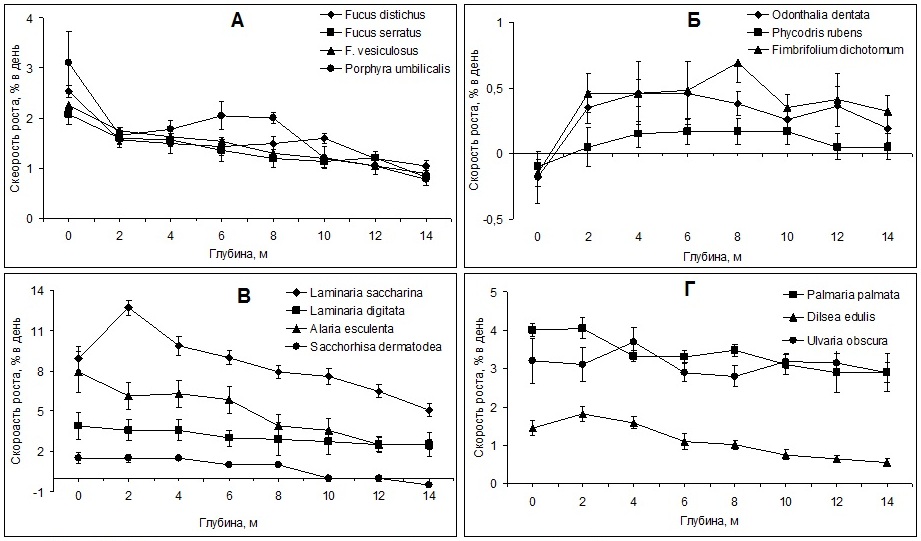
При изменении глубины произрастания меняется и скорость роста водорослей (Рис. 8). В основном с глубиной она снижается, кроме группы красных водорослей, произрастающих в сублиторали под пологом других растений (Рис. 8Б) – на поверхности избыток освещения тормозит их рост.
Рис. 8. Скорость роста водорослей на различной глубине
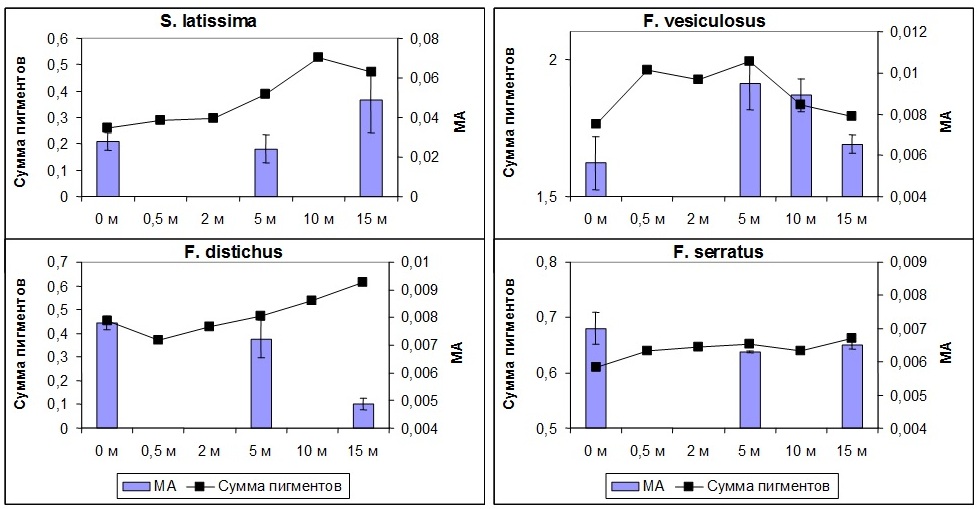
Изменение скорости роста сопровождается и изменением содержания фотосинтетических пигментов и метаболической активности клеток водорослей. При этом у каждого вида характер изменений собственный (Рис. 9).
Рис. 9. Содержание фотосинтетических пигментов (мг/г сыр. массы) и метаболическая активность клеток (А570нм/г*ч) в талломах водорослей при различной глубине произрастания
2.2. Влияние ультрафиолетовой радиации Ультрафиолетовая часть спектра задерживается верхними слоями воды (Рис. 5б). Однако даже сниженное ее количество оказывает значительное воздействие. Опыты с отсечением при помощи избирательных фильтров различных частей УФ-радиации показали, что скорость роста водорослей максимальна при ее отсутствии, остается на том же уровне или немного снижается под воздействием УФ-А и заметно уменьшается под воздействием УФ-Б (Makarov, 1999). Виды, обитающие в нижней литорали и верхней сублиторали и имеющие пластинчатую организацию таллома, оказываются наиболее чувствительными, что, скорее всего, связано с нарушением работы фотосинтетического и белоксинтезирующего аппаратов (Harm, 1980; Dohler, 1984; Karentz et al., 1991; Jordan et al., 1991). Степень устойчивости разных видов к УФ-Б зависит от содержания экранирующих и УФ-абсорбирующих пигментов, а также активности репарационных процессов (Макаров, 1999; Steinhoff et al., 2011). Облучение спорогенной ткани S. latissima УФ-Б вызывает гибель парафиз, что влечет за собой выход не только подвижных зрелых, но и незрелых спор и отрыв целых спорангиев. При высоком уровне освещения (1,2 Вт/м2, что соответствует природному уровню в ясный летний день) выход начинался через 4 ч после начала воздействия. Скорость оседания зооспор также напрямую зависит от интенсивности УФ. Облучение УФ зооспор S. latissima в течение короткого времени не оказывало значительного влияния на их прорастание, тогда как облучение эмбриоспор, гаметофитов и прорастающих спорофитов вызывало задержку или нарушение развития (Макаров, 1999). Вероятно, это происходит потому, что в отличие от зооспор у последующих стадий развития ДНК и белоксинтезирующий аппарат находятся в активном состоянии. Проведенные исследования показали, что ультрафиолетовая радиация является фактором, оказывающим значительное воздействие на репродукцию водорослей и процессы восстановления природных зарослей.
3. ФотопериодНа Мурманском побережье Баренцева моря, в связи с наличием полярного дня и ночи, фотопериод меняется от 0/24 до 24/0 (свет/темнота) (Рис. 10). А, как известно, многие жизненные функции и начало этапов развития растений определяются именно продолжительностью светового дня.
Рис. 10. Продолжительность светового дня на Мурманском побережье Баренцева моря
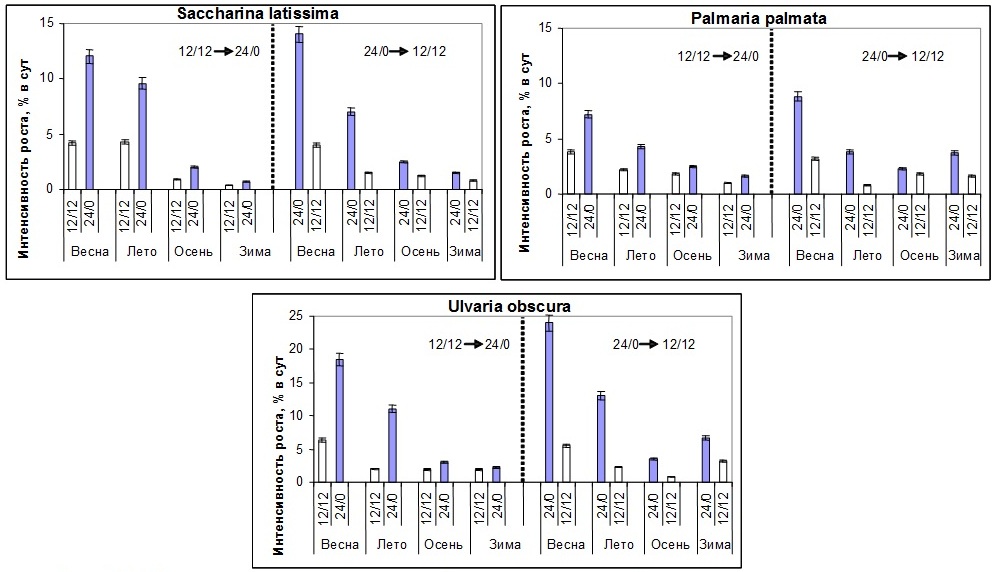
Эксперименты также показали, что при постоянном освещении скорость роста водорослей выше, чем при фотопериоде 12/12 свет/темнота (Рис. 11). Тем не менее, в естественных условиях при постоянном освещении (полярный день) и увеличении температуры воды рост водорослей замедляется, что является проявлением эндогенных ритмов сезонного развития водорослей (Makarov et al., 1999). Сходные данные также были получены и на других видах водорослей из морей умеренных широт (Fortes, Lüning, 1980; Lüning 1991, 1993; tom Dieck, 1991; Lüning, Kadel, 1993; Schaffelke, Lüning, 1994).
Рис. 11. Скорость роста водорослей при изменении фотопериода
Реакция фотосинтетического аппарата клетки на продолжительность и интенсивность освещения различается. При длинном дне наблюдается общее снижение содержания фотосинтетических пигментов без изменения соотношения хлорофиллов и каротиноидов. При коротком световом дне накопление каротиноидов, выполняющих двойную роль и фотозащитных и светособирающих пигментов, является оптимальным: при высокой интенсивности освещения в дневные часы каротиноиды защищают хлорофиллы от фотодеструкции, а при низком освещении в утренние и вечерние часы выполняют роль «светосборщиков», увеличивая тем самым период эффективного использования световой энергии.
Рис. 12. Изменение содержания сухих веществ в талломах F. vesiculosus при изменении фотопериода
Снижение продолжительности освещения вызывает также увеличение содержания сухих веществ в талломах F. vesiculosus (Рис. 12), особенно у растений, предварительно содержавшихся в темноте или в природных условиях. По-видимому, уменьшение длины светового дня является сигналом, переключающим физиологические процессы водорослей с роста на накопление запасных веществ, что является важным приспособлением к переживанию полярной ночи. Наши исследования подтвердили вывод К. Люнинга (Lüning, 1993), что фотопериод является регулятором, синхронизирующим эндогенные ритмы водорослей с условиями внешней среды. Особенно это актуально для водорослей полярных морей, где температурные и световые условия в течение года меняются в широких пределах.
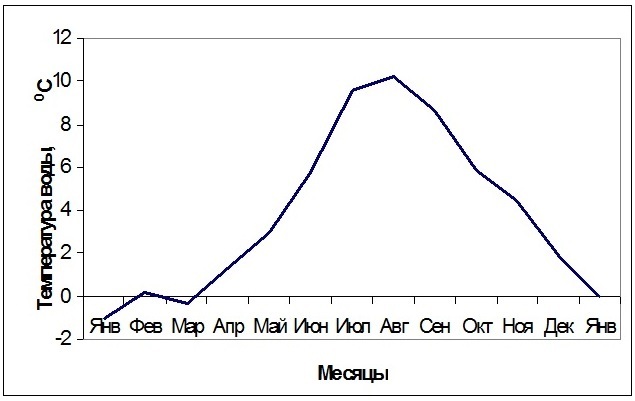
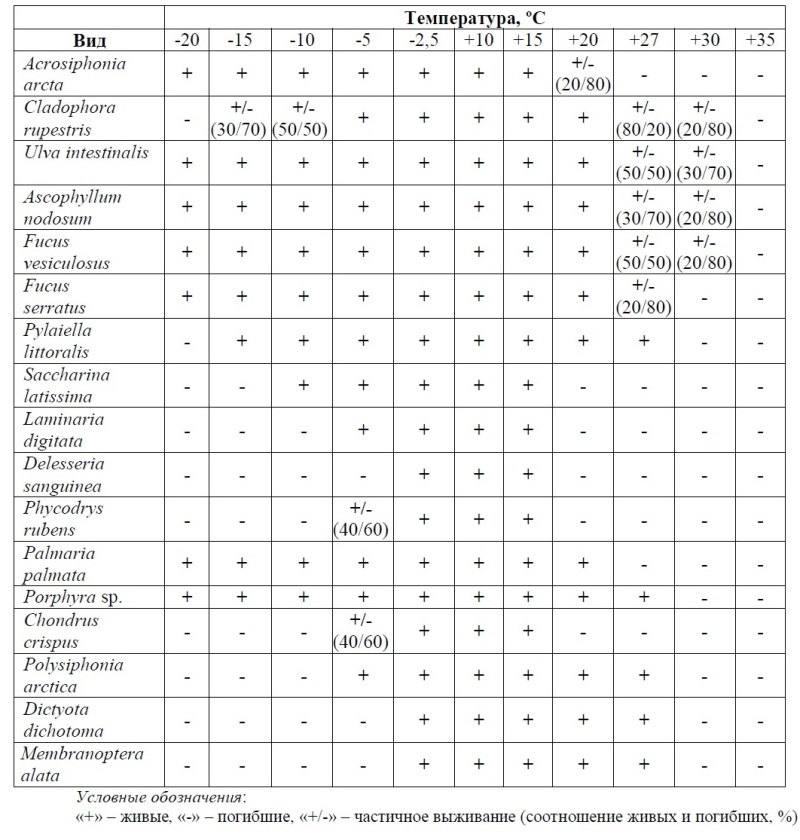
4. ТемператураСчитается, что температура является одним из основных факторов, определяющих биогеографические границы произрастания водорослей (Hoek, 1982a,b, 1984; Lüning, 1984; Перестенко, 1998; Cambridge et al., 1990; Novaczek, Breeman, 1990; Howe, Brunner, 2005; Verbruggen et al., 2009). Однако, несмотря на многочисленные экспериментальные исследования температурной толерантности водорослей, механизмы их тепло- и, что особенно актуально для северных морей, холодоустойчивости, до настоящего времени не ясны. Температура воздуха на побережье Баренцева моря, которую испытывают в период отливов литоральные водоросли, зимой может опускаться до минус 25ºС. Наиболее низкая температура воды (до –1,5ºС) отмечается в январе–марте (Рис. 13).
Рис. 13. Температура поверхностного слоя воды (до глубины 3 м) в губе Зеленецкая Баренцева моря в течение года. Представлены средние данные за 2010–2011 гг.
Результаты наших экспериментов показывают, что для большинства водорослей Баренцева моря оптимальная температура для вегетативного роста 10–15ºС, реже 5–10ºС, для единичных видов 20–22ºС (табл. 2). Среди них имеются эвритермные виды, приспособленные к значительным колебаниям температур, к которым относится большинство литоральных водорослей, и стенотермные, способные существовать в узком температурном диапазоне. Сходные результаты были получены и для других видов водорослей (Гринталь, 1965; Lüning, 1990; Schoschina et al., 1996; Voskoboinikov et al., 1996, 1997).
Таблица 2. Влияние температуры на жизнеспособность макрофитов Баренцева моря
Температура воздуха на побережье Баренцева моря, которую испытывают в период отливов литоральные водоросли, зимой может опускаться до –25ºС, а летом достигать +30ºС. Самая низкая температура воды (до –1,5ºС) отмечается в феврале–марте. Максимальная температура у поверхности воды в губах Баренцева моря достигает 12ºС в сентябре месяце, а на глубине 10 метров не поднимается выше 5ºС (Черновская, 1956). Проведенные нами исследования показали, что водоросли Баренцева моря способны в течение месяца существовать при температуре –1,5ºС. Первые повреждения у Phycodrys rubens и S. latissima отмечались при –2,0ºС, однако часть из них была обратима. У сублиторальных водорослей образование кристаллов внутри клетки начинается при температуре ниже –1,8ºС (температура замерзания морской воды). С дальнейшим понижением температуры число поврежденных клеток растет, достигая максимума при –5ºС для Phycodrys rubens и при –6,5ºС для S. latissima. Наибольшая устойчивость к низким температурам была обнаружена у F. vesiculosus: необратимые повреждения начинали проявляться при температуре –20ºС. У Palmaria palmata и Porpyra umbilicalis при температуре –20ºС лишь единичные фрагменты сохраняли жизнеспособность (Voskoboinikov et al., 1996). Широкий диапазон температурной толерантности F. vesiculosus был выявлен также и для беломорских фукоидов (Фельдман и др., 1963). Возможно, что устойчивость водорослей к замерзанию является следствием синтеза и накопления ими криопротекторов (глицерин, пролин, маннит, фукоидан и т.д.). Однако, эта гипотеза допустима лишь для ограниченного числа видов, способных к синтезу данных веществ. В частности бурая водоросль S. latissima, содержание маннита у которой значительно выше по сравнению со многими литоральными водорослями, сильно уступает им по устойчивости к отрицательным температурам. Экскреция литоральными фукусовыми водорослями полисахарида фукоидана способствует формированию пленки (ледяного футляра) с внешней стороны водорослей, предохраняющей макрофиты от гибели во время отливов зимой. В клетках фукоидов содержится большое количество фенольных соединений, также являющихся антифризами. В период отливов литоральные водоросли теряют до 40–70% воды. Не исключено, что именно способность к дегидратации без потери жизнеспособности также обеспечивает сохранность тканей некоторых видов литоральных водорослей зимой. Эксперименты последних лет, проведенные с помощью высокочастотной диэлектрометрии, ядерного парамагнитного резонанса и показавшие наличие у фукуса пузырчатого большого процента связанной воды в клетках, также свидетельствуют в пользу данного предположения (Паршикова и др., 2000). На Palmaria palmata и Porphyra sp. было показано, что понижение температуры вызывает увеличение концентрации полиненасыщенных жирных кислот в водорослях (Kayama et al., 1985; Хотимченко, 2003), способствующих сохранению текучести клеточных мембран. Не исключается наличие и других механизмов, способствующих переживанию литоральных водорослей в условиях холода (Гапочка, 1981; Климов, 2001). На основании экспериментальных данных, полученных, в том числе, и на установке программной заморозки был построен ряд холодоустойчивости фукусовых водорослей: Fucus vesiculosus > F. distichus > F. serratus, который совпадает с вертикальным расположением водорослей на литорали. Макрофиты Баренцева моря демонстрируют значительное различие в устойчивости не только к отрицательным, но и к положительным температурам. Нами было показано, что у двух близких по систематической принадлежности, строению таллома и местам произрастания видов зеленых водорослей Cladophora rupestris и Acrosiphonia arcta, температурные оптимумы роста и границы устойчивости к положительным температурам оказываются совершенно разными. У A. arcta максимальная скорость роста наблюдается при температуре +8–10°С, а температура +18–20°С вызывает гибель. У C. rupestris скорость роста максимальна при 20–22°С, а гибель происходит при 30°С. Объяснение этому феномену лежит в происхождении водорослей: у A. arcta – арктическое происхождение, а у C. rupestris – тропическое (Voskoboinikov et al., 1997). Полученные данные позволили сделать вывод о генетической закрепленности температурной толерантности водорослей.
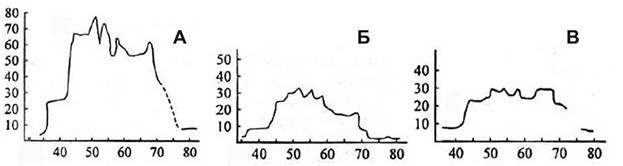
Заключение Таксономический обзор бурых водорослей, проведенный Л.П. Перестенко (2000), показал, что видовое разнообразие резко снижается на широтах выше 70° с.ш. (Рис. 14). Результаты наших исследований позволяют утверждать, что снижение в большей степени связано с действием полярной ночи (длительное отсутствие освещения), нежели с понижением температуры, поскольку теплое Северо-Атлантическое течение доходит до берегов Шпицбергена, и температура вод возле его юго-западной части сравнима с температурой возле побережья Мурмана.
Рис. 14. Видовое разнообразие бурых водорослей порядков Ectocarpales (А), Chordariales (Б) и Dictyosiphonales (В) (по Перестенко, 2000). По оси абсцисс – градусы северной широты, по оси ординат – количество видов
По всей вероятности, распространение видов происходило параллельно с развитием приспособлений к существованию в период полярной ночи. У однолетних водорослей таким приспособлением является синхронизация жизненного цикла с природными условиями, чтобы неблагоприятный период приходился на покоящуюся стадию. Для них возможность распространения зависела от продолжительности данной стадии и скорости развития таллома до фертильного состояния в благоприятный период. У многолетних видов механизмы переживания периода отсутствия освещения связаны со структурой таллома, а также типом и расположением зоны роста. Однако для всех видов водорослей важным приспособлением является синхронизация жизненного цикла с условиями окружающей среды, закрепленная на генетическом уровне, что подтверждается наличием эндогенных ритмов развития. Это позволяет наиболее оптимально распределить фазы жизненного цикла с учетом воздействия на них стимулирующих (оптимальной температуры, освещенности, биогенов) или подавляющих (низкая температура, УФ-излучение) факторов среды. Анализ сезонных изменений показал, что у водорослей разных систематических групп, несмотря на различия в наборе фотосинтетических пигментов и строении ФСА, наблюдаются сходные перестройки. В зимний период у всех видов происходит увеличение размеров ССК, площади тилакоидных мембран и содержания фотосинтетических пигментов. Вместе с тем, имеются и отличия в сезонном содержании некоторых каротиноидных пигментов у водорослей, принадлежащие к различным отделам. Однако, по всей вероятности, данные отличия связаны не с работой фотосинтетического аппарата, а с функциональной направленностью организма в определенный период времени, например, с формированием органов размножения. Произрастание водорослей в приполярных районах зависит не только от лабильности ФСА, но и от возможности адаптации физиологических процессов к низкой температуре окружающей среды. Анализ изменений, происходящих на различных уровнях у высших растений при адаптации к низкой температуре и у водорослей при низкой интенсивности освещения, показал, что имеется большое количество сходных изменений. На уровне организма наблюдается торможение метаболических процессов, а также синхронизация сезонного ритма развития организма с условиями окружающей среды. На клеточном уровне – изменение численности (или парциального объема в клетке) митохондрий и хлоропластов, тилакоидов в хлоропласте. На молекулярном уровне – изменение содержания фотосинтетических пигментов и доли хлорофиллов, относящихся к ССК. У высших растений, адаптированных к холоду, и у зеленых водорослей при низкой интенсивности освещения наблюдается снижение парциального объема крахмальных гранул. При гидролизе крахмала происходит накопление водорастворимых углеводов в цитоплазме (что способствует снижению температуры точки образования льда), а также их потребление для поддержания процессов клеточного метаболизма при недостатке ассимилятов, синтезирующихся в процессе фотосинтеза. Описанные перестройки ФСА происходят вследствие снижения уровня светового насыщения фотосинтеза при низких температурах, что было показано на высших растениях и зеленых водорослях (Mawson, Cummins, 1991; Gray et al., 1997; Huner et al., 1998; Morgan et al., 1998). Таким образом, результаты наших исследований и анализ литературных данных показали, что, несмотря на многообразие жизненных форм водорослей, на разницу в месте и времени происхождения, их эволюция и распространение в высокоширотные районы Мирового океана привели к конвергентному функционированию фотосинтетического аппарата водорослей различных систематических групп. Распространение водорослей происходило вследствие совершенствования механизмов, обеспечивающих их существование в высоких широтах Мирового океана, и сопровождалось эволюционными изменениями, приводившими к образованию новых видов. Так, отличие в эволюционной направленности видообразования ламинариевых (неотения, педоморфоз) и фукусовых водорослей (усложнение организации) (Перестенко, 1998, 2000) определило различие в механизмах адаптации к условиям освещения. Существенно, что большое количество водорослей различных систематических таксонов, обитающих в полярных регионах, имеют сходные физиологические адаптации к низкому уровню освещения и температуре, что также было отмечено различными авторами (обзор Gomez et al., 2009). Таким образом, данное исследование подтверждает гипотезу о существовании некоего барьера из комплекса факторов среды, контролирующего биогеографическое распространение водорослей (Gomez et al., 2009). Исследуя водоросли, произрастающие в прибрежных водах архипелага Шпицберген, мы пришли к выводу, что в высокоширотных районах значительное влияние оказывает еще один не учитываемый нигде фактор – это истирание водорослей льдами, перенос и перемалывание субстрата, на котором макроводоросли могут закрепиться и произрастать. Так, вследствие отсутствия заноса ледовых полей в залив Грен-фиорд в 2013–2014 гг. значительно повысилась биомасса водорослей в этом районе.
Работа выполнена по теме НИР «Механизмы адаптации, регуляции роста, размножения и рациональное использование водорослей-макрофитов арктических морей» № ГЗ 0228-2016-0002.
Список литературы 1. Быков О.Д. Фотосинтез и темновая фиксация СО2 литоральных макроводорослей Баренцева моря в условиях полярной ночи // Ботанический журнал. 2003. Т. 88. № 12. С. 68–73. 2. Воскобойников Г.М., Макаров М.В., Маслова Т.Г., Шерстнева О.А. Ультраструктура и пигментный состав фотосинтетического аппарата зеленой водоросли Ulvaria obscura в полярный день и полярную ночь // Доклады АН. Общая биология. 2004. Т. 394. №3. С. 423–426. 3. Воскобойников Г.М., Макаров М.В., Рыжик И.В. Изменения в составе фотосинтетических пигментов и структуре клеток у бурых водорослей Fucus vesiculosus L. и F. serratus L. из Баренцева моря при длительном нахождении в темноте // Биология моря. 2006. Т. 32. №1. С. 26–33. 4. Гапочка Л.Д. Об адаптации водорослей. – М.: Изд. МГУ, 1981. – 80 с. 5. Гринталь А.Р. Состав и распределение сообществ водорослей на литорали губ Ярнышной и Подпахты (Восточный Мурман) // Тр. ММБИ. 1965. Вып. 8 (12). С. 23–40. 6. Климов С.В. Пути адаптации растений к низким температурам // Успехи современ. биол. 2001. Т. 121. № 1. С. 3–22. 7. Колмаков П.В. Темновая фиксация неорганического углерода некоторыми видами морских зеленых макроводорослей. // Материалы 48 Межвузовской научно-технической конференции. Т III. – Владивосток, 2005. – С. 55–57. 8. Литвин Ф.Ф., Звалинский В.И. К теории хроматической и нехроматической адаптации фотосинтеза // Успехи современной биологии. 1983. Т. 95. №3. С. 339–357. 9. Макаров В.Н. Поведение зооспор и ранние стадии развития Laminaria saccharina (L) Lamour. Белого и Баренцева морей: Автореф. дис. канд. биол. наук. – Ленинград, 1987. – 20 с. 10. Макаров М.В. Влияние ультрафиолетовой радиации на рост и размножение доминантных видов водорослей-макрофитов Баренцева моря: Автореф. дис. канд. биол. наук. – СПб, 1999. – 22 с. 11. Макаров М.В. Адаптация водорослей Баренцева моря к условиям освещения: Дисс... докт. биол. наук по спец. 25.00.28 «океанология». – Мурманск, 2010. – 359 с. 12. Макаров M.В. Влияние гидростатического давления на вертикальную зональность Laminaria saccharina (L.) Lamouroux Баренцева моря // Океанология. 2011. Т. 51. № 3. С. 485–493. 13. Макаров М.В., Рыжик И.В, Воскобойников Г.М., Матишов Г.Г. Дифференциация пластины Laminaria Saccharina (L) Lamour как приспособление к длительному отсутствию освещения // Докл. АН. Общая биология. 2006. Т. 409. № 2. С. 1–2. 14. Макаров М.В., Рыжик И.В., Воскобойников Г.М., Матишов Г.Г. Влияние глубины произрастания на морфофизиологические показатели Fucus vesiculosus L. Баренцева моря // Доклады АН. 2010. Т. 430. № 3. С. 427–429. 15. Мальцев В.Н. Изучение гаметофита ламинарии японской при ее культивировании. // Матер. 6 сов.-япон. симпозиума по вопросам аквакультуры и и повышения биопродуктивности Мирового океана. Москва – Батуми, 7-21 октября 1977 г. – М.: ВНИРО, 1978. – С. 76–77. 16. Матишов Г.Г., Макаров М.В. Изменения пигментного состава Fucus vesiculosus L. и F. serratus L. Баренцева моря при длительном нахождении в темноте // Доклады АН. Общая биология. 2004. Т. 397. № 5. С. 1–2. 17. Паршикова Т.В., Щеголева Т.Ю., Колесников В.Г. Состояние воды в клетках водорослей и их функциональная активность в различных условиях // 5 Всерос. конф. по водным растениям «Гидроботаника 2000». – Борок, 2000. – С. 66–67. 18. Перестенко Л.П. О происхождении и эволюции ламинариевых водорослей (Laminariales, Phaeophyta) // Ботанический журнал. 1998. № 5. С. 1–11. 19. Перестенко Л.П. Эволюция бурых водорослей (Phaeophyta) в мировом океане 1. Особенности географического распространения // Ботанический журнал. 2000. № 8. С. 1–13. 20. Рыжик И.В. Оценка метаболической активности клеток фукусовых водорослей тетразолиевым методом // Альгология. 2013. 23 (1). С. 10–19. DOI – http://dx.doi.org/10.15407/alg23.01.010 21. Титлянов Э.А., Колмаков П.В. Лавин П.И. Темновая фиксация неорганического углерода морскими зелеными водорослями // Инф. Бюлл. Сиб. ин-та физиол. и биохим. растений. 10. – Иркутск, 1972. – С. 47–48. 22. Тропин И.В., Макаров М.В. Оценка состояния фотосинтетического аппарата фукоидов Баренцева моря после завершения полярной ночи // Альгология. 2004. Т. 4. № 4. С. 393–404. 23. Трусова Н.А. Эколого-физиологические характеристики фотосинтетического аппарата морских водорослей макрофитов. // Материалы Международной отраслевой студенческой научно-технической конференции «П.О.И.С.К. – 2009» (Владивосток, 14-17 сентября 2009 г.) – Владивосток: Дальрыбвтуз, 2009. – С. 176–179. 24. Фельдман Н.Л., Завадская П.Г., Лютова М.И. Исследование температурной устойчивости некоторых морских водорослей в природных условиях и в эксперименте // Цитология. 1963. Т. 5. № 2. С. 125–134. 25. Хайлов К.М. Экологический метаболизм в море. – Киев: Наук. думка, 1971. – 252 с. 26. Хайлов К.М., Монина Т.Л. Органотрофия у морских макрофитов как функция плотности их популяции в условиях эксперимента // Биология моря. 1977. Т. 2. С. 11–18. 27. Хайлов К.М., Фирсов Ю.К. Фотосинтез и органотрофия морских макрофитов как функция индивидуального веса их талломов // Биология моря. 1976. Т. 6. С. 47–51. 28. Хотимченко С.В. Липиды морских водорослей-макрофитов и трав: структура, распределение, анализ. – Владивосток: Дальнаука, 2003. – 234 с. 29. Черновская E.H. Гидрологические и гидрохимические условия на литорали Восточного Мурмана и Белого моря. – М., Л.: Издательство АН СССР, 1956. – 115 с. 30. Alberte R.S., Friedman A.L., Gustafson D.L., Rudnick M.S., Lyman H. Light-harvesting systems of brown algae and diatoms. Isolation and characterization of chlorophyll a/c and chlorophyll a/fucoxanthin pigment-protein complexes // Biochim Biophys Acta. 1981. V. 635. № 2. P. 304–316. 31. Barrett J., Anderson J.M. The P-700-chlorophyl a-protein complex and two major light-harvesting complexes of Acrocarpia paniculata and other brown seaweeds // Biochim. Biophys. Acta. 1980. V. 590. P. 309–323. 32. Breeman A.M. Relative importance of temperature and other factors in determining geographic boundaries of seaweeds: Experimental and phenological evidence // Helgoland Marine Research. 1988. V. 42. № 2. P. 199–241. 33. Cambridge M.L., Breeman A.M., Hoek van den C. Temperature limits at the distribution boundaries of four tropical to temperate species of Cladophora (Cladophorales: Chlorophyta) in the North Atlantic ocean // Aquatic Bot. 1990. V. 38. № 2–3. P. 135–151. 34. Campana G. L., Zacher K., Fricke A., Molis M., Wulff A., Quartino M. L., Wiencke Ch. Drivers of colonization and succession in polar benthic macro- and microalgal communities // Bot. Mar. 2009. V. 52. P. 655–667. 35. Dohler G. Effects of UV-B radiation on the marine diatoms Lauderia annulata and Тhallassiosira rotula grown in different salunities // Mar. Biol. 1984. V. 83. P. 247–253. 36. Douady D., Rousseau B., Berkaloff C. Isolation and characterization of PSI1 core complexes from a brown alga, Laminaria saccharina // FEBS. 1993. V. 324. P. 22–26. 37. Dunton K.H., Schell D.M. Seasonal carbon budget and growth of Laminaria solidungula in the Alaskan High Arctic // Mar. Ecol. Prog. Ser. 1986. V. 31. P. 57–66. 38. Fortes M.D., Lüning K. Growth rates of North Sea macroalgae in relation to temperature, irradiance and photoperiod // Helgolander Meeresunters. 1980. V. 34. P. 15–-29. 39. Gómez I., Wulff A., Roleda M. Y., Huovinen P., Karsten U., Quartino M. L., Dunton K., Wiencke C. Light and temperature demands of marine benthic microalgae and seaweeds in polar regions // Bot. Mar. 2009. V. 52. № 6. P. 593–608. 40. Gray G.R., Chauvin L-P., Sarhan F., Huner N.P.A. Cold acclimation and freezing tolerance. A complex interaction of light and temperature // Plant Physiol. 1997. V. 114. P. 467–474. 41. Gylle A.M., Rantamaki S., Ekelund N.G.A., Tyystjarvi E. Fluorescence emission spectra of marine and brackish-water ecotypes of Fucus vesiculosus and Fucus radicans (Phaeophyceae) reveal differences in light-harvesting apparatus // J. Phycol. 2011. V. 47. P. 98–105. 42. Harm W. Biological effects of ultraviolet radiation // IUPAB Biophysics Series 1. –Cambrige: Cambrige University Press, 1980. – 216 p. 43. Hoek van den C. The distribution of benthic marine algae in relation to the temperature regulation of their life histories // Biol. J. Linn. Soc. 1982a. V. 18. P. 81–144. 44. Hoek van den C. Phytogeographic distribution groups of benthic marine algae in the North Atlantic Ocean. A review of experimental evidence from life history studies // Helgoland Marine Research. 1982b. V. 35. № 2. P. 153–214. 45. Hoek van den C. World-wide latitudinal and longitudinal seaweed distribution patterns and their possible causes, as illustrated by the distribution of Rhodophytan genera // Helgoland Marine Research. 1984. V. 38. № 2. P. 227–257. 46. Howe G.T., Brunner A.M. An evolving approach to understanding plant adaptation // New Phytologist. 2005. V. 167. № 1. P. 1–5. 47. Huner N.P.A., G. Öquist., Sarhan F. Energy balance and acclimation to light and cold // Trends in plant science. 1998. V. 3. № 6. P. 224–230. 48. Jordan B.R., Chow W.S., Strid A., Anderson J.M. Reduction in cab and psb A RNA trancripts in response to supplementary ultraviolet-B radiation // FEBS Letters. 1991. V. 284. № 1. P. 5–8. 49. Karentz D., Cleaver J.E., Mitchell D.L. Cell survival characteristic and molekular responses of Antarctic phytoplancton to ultraviolet-B radiation // J. Phycol. 1991. V. 27. P. 326–341. 50. Katoh T., Mimuro M., Takaichi S. Light-harvesting particles isolated from a brown alga, Dictyota dichotoma. A supramolecular assembly of fucoxanthin-chlorophyll-protein complexes // Biochim. Biophys. Acta. 1989. V. 976. P. 233–240. 51. Katoh T., Tanaka A., Mimuro M. Xanthosomes: Supramolecular assemblies of xanthophyll-chlorophyll a/c protein complexes // Methods Enzymol. 1993. V. 214. P. 402–412. 52. Kayama M., Iijima N., Kuwahara M., Sado Т., Araki S., Sakurai T. Effect of water temperature on the fatty acid composition of Porphyra // Bull. Jpn. Soc. Sci. Fish. 1985. V. 51. № 4. P. 687. 53. Lichtenthaler H.K. Chlorophylls and caroienoids: Pigments of photosymhetic membranes // Meth. Enzym. 1987. V. 148. P. 350–382. 54. Lüning K. Temperature tolerance and biogeography of seaweeds: The marine algal flora of Helgoland (North Sea) as an example // Helgoland Marine Research. 1984. V. 38. № 2. P. 305–317. 55. Lüning K. Seaweeds, their environment, biogeography, and ecophysiology. – John Wiley, New York, 1990. – 527 p. 56. Lüning K. Circannual growth rhythm in a brown alga Pterygophora californica // Bot. Acta. 1991. V. 104. P. 157–162. 57. Lüning K. Environmental and internal control of seasonal growth in seaweeds // Hydrobiol. 1993. V. 260/261. P. 1–14. 58. Lüning K., Kadel P. Daylength range for circannual rhythmicity in Pterygophora californica (Alariaceae, Phaeophyta) and synchronization of seasonal growth by daylength cycles in several other brown algae // Phycologia. 1993. V. 33. P. 379–387. 59. Makarov M.V. Influence of ultraviolet radiation on the growth of the dominant macroalgae of the Barents Sea. In: Chemosphere: Global Change Science. Climate Change Effect on Northern Terrestrial and Freshwater Ecosystems. 1999. V. 1. № 4. P. 461–467. 60. Makarov V.N., Makarov M.V., Schoschina E.V. Seasonal dynamics of growth in the Barents sea seaweeds: endogenous and exogenous regulation // Bot. Mar. 1999. V. 42. № 1. P. 43–49. 61. Mawson T., Cummins W.R. Low temperature acclimation of guard cell chloroplasts by the arctic plant Saxifraga cernua L. // Plant, Cell Environ. 1991. V. 14. № 6. P. 569–576. 62. Mimuro M., Katoh T., Kawai H. Spatial arrangement of pigments and their interaction in the fucoxanthin-chlorophyll a/c protein assembly (FCPA) isolated from the brown alga Dictyota dichotoma. Analysis by means of polarized spectroscopy // Biochimica et Biophysica Aсta. 1990. V. 1015. P. 450–456. 63. Morgan R.M., Ivanov A.G., Priscu J.C., Maxwell D.P., Huner N.P.A. Structure and composition of the photochemical apparatus of the Antarctic green alga, Chlamydomonas subcaudata // Photosynt. Res. 1998. V. 56. P. 303–314. 64. Novaczek I., Breeman A.M. Thermal ecotypes of amphi-Atlantic algae. II. Cold-temperate species (Furcellaria lumbricalis and Polyides rotundus) // Helgoland Marine Research. 1990. V. 44. № 3–4. P. 475–485. 65. Passaquet C., Thomas J.C, Caron L., Hauswirth N., Puel F., Berkaloff C. Light-harvesting complexes of brown algae. Biochemical characterization and immunological relationships // FEBS Lett. 1991. V. 280. P. 21-26. 66. Schaffelke B., Lüning K. A circannual rhythm controls seasonal growth in the kelps Laminaria hyperborea and L. digitata from Helgoland (North Sea) // Eur. J. Phycol. 1994. V. 29. P. 49–56. 67. Schoschina E.V., Makarov V.N., Voskoboinikov G.M., Hoek C. van den. Growth and reproductive phenology of nine intertidal algae on the Murman coast of the Barents Sea // Bot. Mar. 1996. V. 39. P. 83–93. 68. Steinhoff F.S., Wiencke Ch., Wuttke S., Bischof K. Effects of water temperatures, UV radiation and low vs high PAR on phlorotannin content and germination in zoospores of Saccorhiza dermatodea (Tilopteridales, Phaeophyceae) // Phycol. 2011. V. 50. P. 256–263. 69. tom Dieck (Bartsch) I. Circannual growth rhythm and photoperiodic sorus induction in the kelp Laminaria setchellii (Phaeophyta) // J. Phycol. 1991. V. 27. P. 341–350. 70. tom Dieck (Bartsch) I. Temperature tolerance and survival in darkness of kelp gametophytes (Laminariales, Phaeophyta): ecological and biogeographical implications // Mar. Ecol. Prog. Ser. 1993. V. 100. P. 253–264. 71. Verbruggen H., Tyberghein L., Pauly K., Vlaeminck C., Nieuwenhuyze Van K., Kooistra W.H.C.F., Leliaert F., Clerck De O. Macroecology meets macroevolution: evolutionary niche dynamics in the seaweed Halimeda // Global Ecology and Biogeography. 2009. V. 18. № 4. P. 393–405. 72. Voskoboinikov G.M., Breeman A. M., Hoek C. van den. Influence of temperature and photoperiod on the rate of growth of algae from the Barents Sea // Tes. IY Intern. Phycological Congress. Leiden. 1997. P. 234 73. Voskoboinikov G.M., Breeman A.V., Hoek C. van den, Makarov V.N., Shoshina E.V. Influence of temperature and photoperiod on survival and growth of north east Atlantic isolates of Phycodrys rubens (Rhodophyta) from different latitudes // Bot. Mar. 1996. V. 39. P. 341–346. 74. Voskoboinikov G., Makarov M., Maslova T., Sherstneva O. The photosynthetic apparatus of Ulvaria obscura during the polar day and polar night // Phycologia. 2001. V. 40 (4). Suppl. Р. 83. 75. Willig M.R., Kaufman D.M., Stevens R.D. Latitudinal gradients of biodiversity: pattern, process, scale, and synthesis // Annu. Rev. Ecol. Evol. Syst. 2003. V. 34. P. 273–309. 76. Wulff А., Iken K., Quartino M. L., Al-Handal A., Wiencke C., Clayton M.N. Biodiversity, biogeography and zonation of marine benthic micro- and macroalgae in the Arctic and Antarctic // Bot. Mar. 2009. V. 52. № 6. P. 491–507. 77. Yabu H. Early development stages of several species of Laminariales in Hokkaido // Hem. Fac. Fish. Hokkaido Univ. 1964. V. 12. P. 1–72. 78. Zacher K., Rautenberger R., Hanelt D., Wulff A., Wiencke C. The abiotic environment of polar benthic algae // Bot. Mar. 2009. V. 52. P. 483–490. Статья поступила в редакцию 2.03.2017
Influence of light and temperature on Barents sea seaweed Mikhail V. Makarov, Grigory M. Voskoboynikov Murmansk marine biological institute KSC RAS (Murmansk, Russia) The review of the last 20-years investigations carried out in laboratory of algology of Murmansk Marine Biological Institute is presented. The main direction of presented investigations is disclosing of mechanisms of seaweed adaptation to Arctic seas conditions. Influence of intensity, photoperiod and spectral composition of light on morphological and physiological parameters of seaweed at different stages of ontogenetic development is shown. The mechanisms allowing seaweed to exist in the conditions of polar night in the absence of illumination and low temperatures are revealed. Results of investigations allow drawing a conclusion, that adaptation to a long period absence of illumination and low temperature promoted distribution of seaweed behind a polar circle. Key words: seaweed; adaptation; light; temperature.
Об авторах Макаров Михаил Владимирович - Makarov Mikhail V. доктор биологических наук zelentsy@yandex.ru Воскобойников Григорий Михайлович - Voskoboynikov Grigory M. доктор биологических наук grvosk@mail.ru Корреспондентский адрес: Россия, 183010, ул. Владимирская, 17, Мурманск, ММБИ КНЦ РАН; тел. 8-8152-250696, факс 8-8152-253994.
ССЫЛКА НА СТАТЬЮ: Макаров М.В., Воскобойников Г.М. Влияние освещения и температуры на макроводоросли Баренцева моря // Вопросы современной альгологии. 2017. №3(15). URL: http://algology.ru/1183 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮ

|
|||||
|
| ||||