|
|
|
Санитарная водорослевая плантация для очистки прибрежных акваторий от нефтепродуктов: от теории к практике
Воскобойников Г.М.1, Ильинский В.В.2, Лопушанская Е.М.3, Grigory M. Voskoboynikov, Vladimir V. Il'inskii,
1Мурманский морской биологический институт КНЦ РАН (г. Мурманск, Россия)
УДК 57.014+574.24+574.632+579.68+581.1
Описана схема санитарной водорослевой плантации, успешная апробация которой прошла в Баренцевом и Белом морях. В основе плантации симбиотическая ассоциация бурых водорослей Fucus vesiculosus, Saccharina latissima и углеводородокисляющих бактерий. Проведен анализ скорости роста водорослей, других физиологических показателей в условиях плантации. Определены биохимические и физиологические характеристики F. vesiculosus, способного к длительному обитанию в условиях постоянного загрязнения нефтепродуктами. Показана роль F. vesiculosus в очистке морской воды от нефтепродуктов (НП). Предполагается, что данный вид способен к аккумуляции, поглощению и включению НП в метаболизм растения. Прослежена динамика деструкции НП фукусом в воде. Выявлено, что нефтяное загрязнение морской среды приводит к возрастанию на поверхности фукусов общей численности бактерий, в том числе сапротрофных и углеводородокисляющих. Получены данные о таксономической принадлежности доминирующих на поверхности фукуса углеводородокисляющих бактерий методами электронной микроскопии, молекулярно-генетического анализа. Новые сведения о природной симбиотической ассоциации водорослей и нефтеокисляющих бактерий значительно расширяют понимание роли биологического фактора в очистке морской акватории от нефтепродуктов и являются основой для развития санитарной аквакультуры. Ключевые слова: фукусовые водоросли; ламинариевые водоросли; эпифитные углеводородокисляющие бактерии; нефтяное загрязнение; биоремедиация; санитарная водорослевая плантация.
Введение Проблема загрязнения прибрежных акваторий нефтепродуктами (НП) в арктических морях в ближайшие годы, по-видимому, не исчезнет, а будет только становиться острее, несмотря на усилия экологов самых разных направлений. Планируемые и уже происходящие добыча полезных ископаемых на шельфе арктических морей, транспортировка нефти и НП, строительство на побережье перегрузочных комплексов, заводов по переработке НП и сжижению газа – все это неизбежно приведет к загрязнению прибрежных акваторий, а именно они являются местом размножения, раннего развития для многих беспозвоночных, водорослей, рыб. В настоящее время существует три направления борьбы с загрязнением водной акватории НП: боновые заграждения, сорбенты и диспергенты. К сожалению, большинство из них имеют как положительные, так и отрицательные характеристики. Широко используемые боны лишь на некоторое время задерживают распространение поверхностных выбросов НП, позволяя концентрировать их и частично собирать с помощью специальных судов-сборщиков. Кроме того, боновые заграждения способны перекрыть распространение подобных загрязнений только в достаточно тонком слое поверхностных вод, не препятствуя эмульгировавшим под воздействием волновых процессов компонентам переноситься потоками воды в ее толщу. Имеющиеся диспергенты параллельно с нейтрализацией химического загрязнения оказывают негативное воздействие на рост и размножение большинства видов гидробионтов. Применение сорбентов в арктических морях значительно ограничено погодными условиями: с конца октября по конец февраля большое число дней в месяц являются штормовыми, сопровождающиеся ветром до 8 баллов, не позволяющим направленно обрабатывать сорбентами загрязненные акватории. Если в ликвидации аварийных разливов нефтепродуктов достигнут определенный прогресс, то для окончательной, «финишной очистки», а также профилактической ежедневной очистки загрязнений, появляющихся в результате судоходства, деятельности береговых предприятий, технологии отсутствуют. Об этом позволяют судить анализы опубликованных сведений по проблеме, а также патентной информации. Это загрязнение может создавать содержание НП в воде во много раз превышающее предельно допустимую концентрацию (ПДК) – 0,05 мг/л. Такая ситуация нами неоднократно фиксировалась на Баренцевом море: в акватории Мурманского порта, в районе порта г. Североморска, где отмечалось содержание нефтепродуктов в воде в 40-70 раз выше ПДК. Учитывая способность морских макрофитов вступать в симбиотические отношения с микроорганизмами, отмеченную роль макрофитов и углеводородокисляющих бактерий в очистке морской воды от нефтепродуктов, возрастание углеводородокисляющей активности бактерий в зоне зарослей макрофитов (Миронов, 1985; Морозов, Телитченко, 1977; Перетрухина и др., 2006; Ильинский, 2000; Ильинский и др., 2010; Семенов и др, 2014; Воскобойников и др., 2008, Воскобойников, Пуговкин, 2012; Пуговкин и др., 2016) нами была предложена схема создания санитарной водорослевой плантации (плантации-биофильтр) для биоремедиации прибрежных акваторий Санитарная водорослевая плантация (СВП) является инженерным сооружением, биологическая компонента которого представлена симбиотической ассоциацией: ламинариевых и (или) фукусовых водорослей и углеводородокисляющих бактерий (УОБ). Именно свойства биологической компоненты наряду с технологией постановки плантации обеспечивают успешное круглогодичное функционирование СВП, направленное на биоремедиацию прибрежных акваторий.
1. Основы технологии постановки СВП в прибрежных акваториях Баренцева моря В основу СВП положена технология плантационного выращивания ламинариевых водорослей (Рис. 1), разработанная в Мурманском морском биологическом институте КНЦ РАН совместно с сотрудниками ООО «ПЛАНТАЦИЯ» и апробированная в губе Зеленецкая (Восточный Мурман) Баренцева моря (Макаров и др., 1986; Воскобойников и др., 2005).
Рис. 1. Схема санитарной водорослевой плантации (1 – гравитационные якоря из бетона или природного камня массой 60–100 кг, 2 – вертикальные несущие синтетические канаты (длина 10–20 м), 3 – горизонтальные синтетические канаты (длина 5–20 м) с вплетенными талломами Fucus vesiculosus, 4 – вертикальные канаты-поводцы (длина 5–20 м) с вплетенными талломами Saccharina latissima или оспоренные, 5 – груз для удержания поводца в вертикальном положении, 6 – кухтыли)
Постановка остова СВП выполняется по схеме, близкой к схеме постановки ламинариевой плантации. Технология СВП имеет следующие особенности: 1) В горизонтальные канаты (поверхностный слой воды) длиной 10-20 метров вплетаются отобранные на литорали растения вида F. vesiculosus в возрасте 3-4 года. Вплетение производится группами по три-четыре растения через 5 см. Обычно горизонтальные канаты в поверхностном слое воды размещаются в две параллельные линии. 2) В биоремедиации глубинных слоев воды (до 20 м), при подготовке СВП применяется способ вплетения молодых талломов S. latissima (10–20 см) в вертикальные субстраты – поводцы до 20 м длиной. Отбор талломов сахарины проводится в верхнем горизонте сублиторали или используется специально выращенная рассада. Вплетение отобранных растений в заранее подготовленные поводцы производится группами по два-три растения через каждые 10 см. 3) В случае использования фукусовых водорослей для биоремедиации слоев воды до глубины 8 м, в частности, при постановке СВП в опресненных прибрежных районах, отобранные талломы фукуса вплетаются в субстраты группами по три-четыре растения через 5 см. 4) Часто постановку плантации необходимо осуществить на большом расстоянии от места изготовления субстратов. В таких случаях имеет смысл проводить все подготовительные работы по месту основного базирования, а доставку к месту постановки плантации осуществлять уже субстратов с вплетенными водорослями. Рекомендуется иметь «выростные участки», на которых обеспечивается хранение в море, готовых к размещению на плантации субстратов с водорослями. Субстраты с фукусовыми водорослями лучше всего размещать на литорали, в привычном для водорослей месте обитания (Рис. 2). Субстраты с талломами S. latissima, будущие вертикальные канаты на плантации, размещать для передержки необходимо под водой на глубине не менее 0,5–1 м. В случае необходимости отправка модулей плантации к месту постановки может быть осуществлена за 2–3 часа.
Рис. 2. Создание выростных участков для передержки субстратов с биоматериалом
Доставка субстратов с водорослями к месту постановки плантации осуществляется только после того, как готов остов плантации: расставленные по дну якоря, крепежные вертикальные канаты с буями на поверхности.
2. Биотическая компонента санитарной водорослевой плантации Выбору биотической компоненты СВП предшествовали исследования биологических особенностей водорослей и микроорганизмов, преимущественно их диапазону и механизмам толерантности к факторам внешней среды, способности к биоремедиации, а у микроорганизмов также таксономической принадлежности.
2.1. Водорослевая компонента симбиотической ассоциации Fucus vesiculosus L. – фукус пузырчатый. Бореально-арктический вид, распространен в Атлантическом и Северном Ледовитом океанах. В Баренцевом море обычно растет в верхнем и среднем горизонтах литорали. Этот вид обладает большой экологической пластичностью, обитает в открытых и защищенных местах, при океанической солености и в сильно опресненных местах (до 10‰), устойчив к ультрафиолету, осушению, воздействию отрицательных и положительных температур, нефтяному загрязнению (Воскобойников, Степаньян, 2007; Макаров и др., 2006, 2007). Рис. 3. Fucus vesiculosus L. – фукус пузырчатый
Продолжительность жизни F. vesiculosus в Баренцевом и Белом морях достигает 11–13 лет (Кузнецов, 1960; Возжинская, 1986) и предположительно (на основании размеров сильно оборванных слоевищ) может достигать 20 лет
Laminaria saccharina (L.) Lamour. – ламинария сахаристая = Saccharina latissima – cахарина большая. Бореально-арктический вид. Обитает в морях Северного Ледовитого и Атлантического океанов. В Баренцевом море образует обширные заросли преимущественно в сублиторальной зоне (до глубины 12-15), в местах с интенсивным движением воды может занимать нижнюю литораль. Продолжительность жизни S. latissima – 3 года.
Рис. 4. Laminaria saccharina (L.) Lamour. – ламинария сахаристая = Saccharina latissima – cахарина большая
Сахарина в отличие от фукуса значительно менее устойчива к влиянию факторов внешней среды: ультрафиолету, распреснению, и, как показали эксперименты, к нефтяному загрязнению (Макаров, 1999; Воскобойников, 2006; Макаров, 2010).
В процессе разработки технологии СВП в губах Зеленецкой и Ярнышной (поб. Баренцева моря) в районе биологической станции ММБИ КНЦ РАН были проведены исследования по влиянию факторов внешней среды на морфо-физиологию водорослей – биокомпонентов плантации, сравнительный анализ физиологических показателей растений при росте в природе и на плантации.
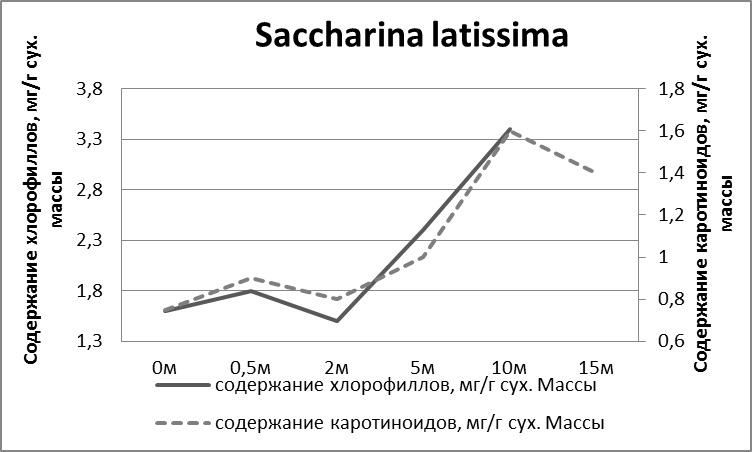
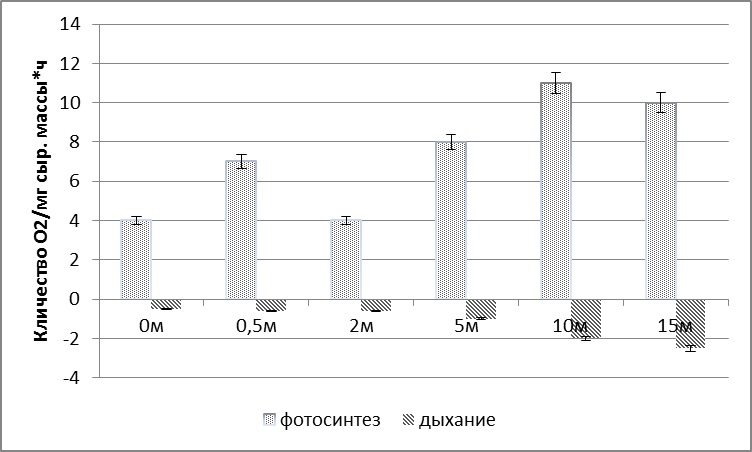
2.1.1. Морфо-функциональные показатели у S. latissima при плантационном выращивании В период активного роста сахарины в природе (апрель – июнь) был проведен сравнительный анализ размерно-массовых характеристик талломов S. latissima, которые были вплетены в возрасте 0+ (сеголетки) в вертикальные субстраты (поводцы) на плантации с глубины 2,5 метра с одновозрастными растениями, обитающими в районе постановки плантации на аналогичной глубине. Функциональные показатели у талломов-сеголеток S. latissima, размещенных на плантации, незначительно выше, чем у одновозрастных особей этого вида из природных зарослей. За период эксперимента (2 месяца: апрель–июнь) у S. latissima на плантации масса увеличилась в 4 раза, ширина в 1,5, а длина в 2 раза. Относительная скорость роста у сахарины в интеркалярной зоне в весенний период (апрель-июнь) очень высока и составляет на глубине 2,5 метра в среднем 4–5% в сутки. В море с увеличением глубины у S. latissima увеличивается количество фотосинтетических пигментов (Рис. 5), а также изменяется интенсивность фотосинтеза и дыхания. Максимальная интенсивность фотосинтеза регистрируются у растений, произрастающих на глубине 10 м, а с дальнейшим увеличением глубины интенсивность фотосинтеза начинает снижаться. Интенсивность дыхания с глубиной увеличивается. Данные результаты находятся в соответствии с общепринятыми представлениями о влиянии интенсивности света на физиологические процессы у растений (Рис. 6).
Рис. 5. Количество фотосинтетических пигментов у S. latissima при произрастании на различной глубине
Рис. 6. Интенсивность фотосинтеза и дыхания у S. latissima при произрастании на различной глубине
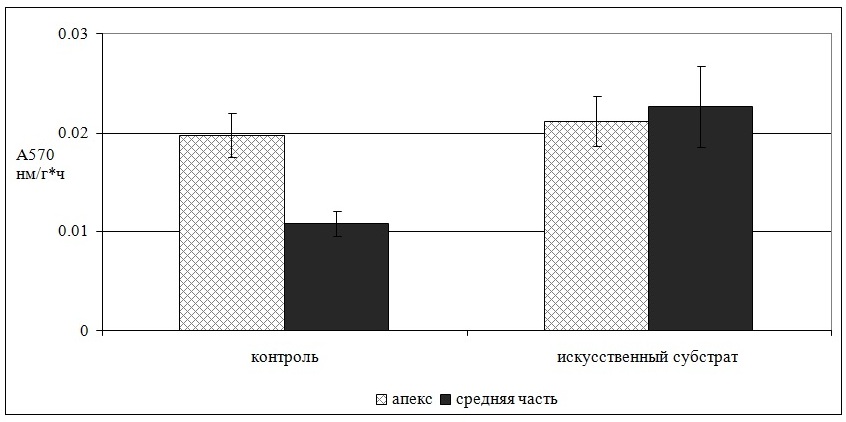
2.1.2. Морфо-функциональные показатели у F. vesiculosus при плантационном выращивании У фукусовых водорослей Баренцева моря процессы роста начинают регистрироваться с конца января месяца, с окончанием полярной ночи. Максимальные темпы роста наблюдаются в весенний период: апрель–май месяцы – до 4,2% в день. Мониторинг состояния фукусовых водорослей на плантации на горизонтальном субстрате в поверхностном слое воды показал, что по скорости роста, размерно-массовым показателям, интенсивности фотосинтеза они не уступали аналогичным макрофитам в природе. Исследование показало, что у растений, перенесенных на искусственный субстрат из природных зарослей, метаболическая активность (МА) апикальной части остается на контрольном уровне, а в средней части увеличивается, что вызывает общее повышение МА (Рис. 7).
Рис. 7. Метаболическая активность тканей у Fucus vesiculosus
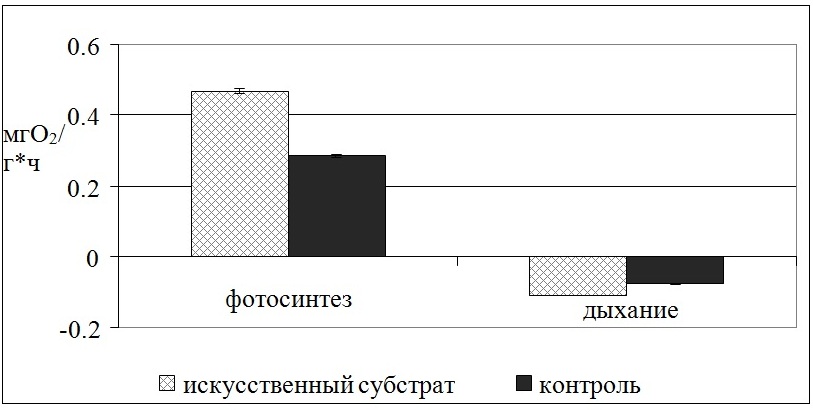
У растений, перенесенных на искусственный субстрат, также отмечается увеличение интенсивности фотосинтеза (ИФ) и дыхания (ИД) по сравнению с контрольными образцами (Рис. 8).
Рис. 8. Интенсивность фотосинтеза и дыхания у F. vesiculosus
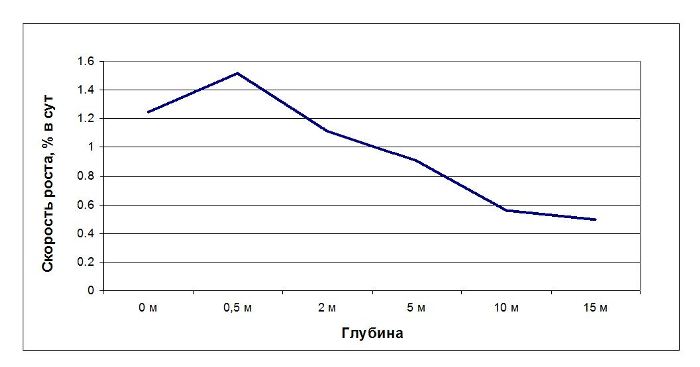
Водоросли на плантации постоянно находятся в толще воды и не подвергаются периодическому осушению. В этих условиях изменяются характеристики среды обитания водорослей: изменяется режим освещенности (практически отсутствует затенение), увеличивается интенсивность движения воды (ИДВ) и, соответственно, приток питательных веществ и отток метаболитов. Это приводит к увеличению МА и скорости роста фукуса, что согласуется с работами других исследователей (Gessner, 1955; Рыжик и др., 2014). Натурные и лабораторные эксперименты позволили построить линейку устойчивости ламинарии и фукусовых водорослей к распреснению: Fucus vesiculosus ≥ F. distichus ≥ A. nodosum ≥ F. serratus ≥ Saccharina latissima Если у S. latissima наблюдается снижение скорости роста, гибель растений при солености ниже 18‰, то для F. vesiculosus минимальная соленость, при которой время существования ограничено, составляет 5‰. В кутовых зонах заливов достаточно часто наблюдается значительное опреснение за счет береговых стоков. В этой ситуации при постановке СВП встает вопрос о замещении S. latissima на вертикальных канатах на F. vesiculosus, которые, как было показано выше, более устойчивые к низким соленостям. Было проведено исследование морфофункционального состояния фукуса при выращивании на разных глубинах. Талломы растений F. vesiculosus в возрасте 2+ – 3+ были собраны с литорали и помещены на канате на глубину 0, 0,5, 2, 5, 10 и 15 м. В течение эксперимента, продолжительность которого составляла 2 месяца, регистрировались изменения внешнего вида талломов, обрастания растений, произраставших на разных глубинах, определялось их физиологическое состояние, в том числе относительная скорость роста апикальных частей (Рис. 9). Наибольшие изменения были отмечены у растений, произраставших на глубинах 10–15 метров. У них практически отсутствует апикальная часть таллома. Водоросли с глубины 15 метров сохранили только срединную жилку. На талломах отмечается присутствие литторин. Содержание и соотношение фотосинтетических пигментов в клетках F. vesiculosus показывают, что глубина 10 м является критической для произрастания данного вида водорослей. При дальнейшем увеличении глубины произрастания фотосинтетический аппарат водорослей не может адаптироваться к низкому уровню освещенности и спектральному составу проникающего в толщу воды света. Минимальное содержание фотосинтетических пигментов и низкое соотношение каротиноидов и хлорофиллов в клетках водорослей, находившихся на глубине 0,5 м, показывают, что данная глубина является оптимальной для функционирования фотосинтетического аппарата F. vesiculosus. Интенсивность фотосинтеза у F. vesiculosus уменьшается с увеличением глубины: с 0 метров до 15 метров она снизилась практически в 8 раз (Макаров и др., 2010).
У растений с глубины 10 м разрушалась апикальная часть и «листовая» пластинка на средней части таллома. Эпифиты отсутствовали, на талломах обнаруживались брюхоногие моллюски. У растений, произраставших на глубине 15 м, сохранилась только срединная жилка. Апексы, листовая часть и воздушные пузыри были разрушены. Эпифитов не обнаружено. На талломе присутствовало большое количество брюхоногих моллюсков, по-видимому, питавшихся разрушающимися участками таллома.
Рис. 9. Внешний вид талломов F. vesiculosus, произраставших на разных глубинах
Скорость роста F. vesiculosus, как показатель его физиологического состояния, также изменяется с увеличением глубины произрастания растений. Максимальная скорость роста наблюдается на глубине 0,5 м (Рис. 10). Рис. 10. Изменение скорости роста F. vesiculosus при произрастании на разных глубинах
Таким образом, при постановке плантации вместо талломов сахарины большой на вертикальных канатах до глубины 5–8 метров можно размещать талломы фукуса пузырчатого. Это особенно важно для акваторий с большим уровнем опреснения, что достаточно часто встречается в кутовых зонах заливов, вблизи от нахождения на берегу потенциальных источников загрязнения морской воды нефтепродуктами.
2.1.3. Влияние хронического загрязнения нефтепродуктами на литоральные водоросли Многолетние наблюдения за постоянно загрязненными прибрежными районами Мурманского побережья Баренцева моря выявили угнетенное состояние или гибель большинства видов водорослей под воздействием нефтепродуктов. Вместе с тем на камнях в зоне литорали, даже в черном слое мазута обнаруживались особи F. vesiculosus (Phaeophyceae). У фукуса пузырчатого из постоянно загрязненных мест обитания наблюдалось уменьшение размеров, массы и продолжительности жизни, а также значительное снижение скорости роста по сравнению с одновозрастными особями этого же вида из чистых мест обитания. Вместе с тем, практически все фукусы, отобранные в загрязненных местах, проявили способность к росту, фотосинтезу, синтезу пигментов, углеводов, липидов. Полученные данные свидетельствовали о высокой степени устойчивости данных видов водорослей к нефтяному загрязнению (Воскобойников и др., 2004). В связи с этим в предлагаемой технологии СВП основная нагрузка по задержанию нефтяной пленки и нейтрализации нефтепродуктов в поверхностном слое воды ложится на F. vesiculosus.
2.2. Микробиологическая компонента симбиотической ассоциации
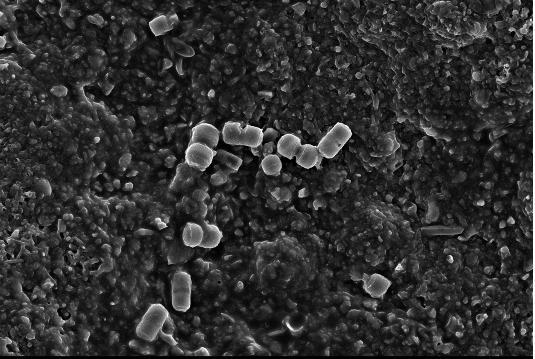
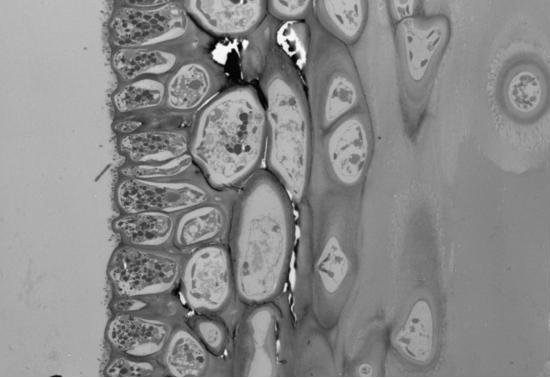
2.2.1. Электронно-микроскопические исследования поверхности водорослей F. vesiculosus и эпифитных бактерий (ЭБ) У фукуса пузырчатого поверхность таллома неоднородна и не является гладкой. На ней имеются неровности и трещины, которые позволяют микроорганизмам легче закрепиться. Количество бактерий в таких местах значительно больше, чем на ровных участках таллома. При значительном загрязнении водной среды (и водорослей) нефтяными углеводородами (НУ), большая часть бактерий располагается непосредственно в слизистом слое на поверхности талломов водорослей (Рис. 11, Б), либо концентрируется на пленке или под пленкой нефтепродуктов, адсорбирующейся на талломах фукуса и создающей дополнительные благоприятные условия для бактериальной колонизации. Помимо гетеротрофных бактерий, на поверхности водорослей в этом случае присутствует и большое количество цианобактерий (Рис. 11, Б, В). Отмечаются как одиночные клетки, так и цепочки. Обнаружены также их колониальные формы, представляющие собой «упакованные» мелкие (1–2 мкм) клетки, заключенные в единую оболочку (Рис. 11, В.). Характерной особенностью цианобактериальных сообществ водорослей, обитающих в акватории с ярко выраженным хроническим загрязнением НУ, является отсутствие гетероцист у колониальных форм.
Рис. 11. Электронно-микроскопические фотографии поверхности водорослей F. vesiculosus.
На поверхности водорослей из чистых акваторий отмечено значительно меньшее количество гетеротрофных ЭБ, чем на водорослях из загрязненных НУ районов (Рис. 11, Г). Колоний и отдельных клеток цианобактерий при этом не выявлено.
2.2.2. Количественное распределение сапротрофных культивируемых бактерий на поверхности талломов водорослей Анализ апикальной, центральной частей и основания таллома фукуса, взятого из незагрязненной НУ акватории показал, что количество эпифитных сапротрофных бактерий (СБ) увеличивается от верхушечной части таллома к его нижней части. Максимальная численность СБ была обнаружена в нижней части таллома фукуса, она колебалась в различные сезоны года от 9926 до 14304 кл/см2. В верхушечной части таллома фукуса наиболее вероятное число (НВЧ) культивируемых бактерий составляло 248–1464 кл/см2, а в центральной части таллома – от 1453 до 11137 кл/см2. Причины подобного количественного распределения СБ по поверхности таллома F. vesiculosus заключаются в особенностях роста фукуса. Для фукусовых водорослей характерен апикальный рост, который осуществляется за счет апикальной меристематической ткани (Камнев, 1989). Минимальное количество эпифитных СБ в этой части таллома можно объяснить тем, что в период роста на этих участках фукус выделяет бактериостатические или бактерицидные вещества (Mikulski, 1982), а также тем, что поверхность у молодых частей растения более гладкая, что затрудняет закрепление микроорганизмов. В нижней же части таллома фукуса происходит затухание его метаболической активности и наблюдается деградация листоподобных структур, что способствует выделению органических веществ, которые могут служить пищевыми субстратами для СБ. По этой причине здесь наблюдается их наибольшая численность. Учитывая высокую погрешность метода предельных разведений, можно заключить, что сезонные изменения численности эпифитных СБ на одних и тех же участках талломов фукусов из губы Зеленецкой были невелики и составляли менее одного порядка. На фукусе из загрязненной НУ акватории (Мурманский порт) количество эпифитных СБ многократно превышало таковое на фукусе из чистой акватории – губа Зеленецкая (Рис. 12).
Рис. 12. Сравнение наиболее вероятного числа эпифитных сапротрофных (СБ) и углеводородокисляющих (УОБ) бактерий на фукусе из акватории Мурманского морского порта (МП), загрязненной нефтепродуктами, и из чистой акватории вблизи пос. Дальние Зеленцы (ДЗ)
При этом у фукусов из обоих мест обитания был отмечен сходный характер количественного распределения бактерий по таллому. Максимальная численность СБ на поверхности фукуса из акватории морского порта превышала 17 млн. кл/см2 и была обнаружена в нижней части таллома. Минимальное количество этих бактерий отмечено в верхушечной части таллома фукуса – около 2 млн. кл/см2. Количество УОБ на талломе фукуса из акватории МП было на два–три порядка меньше, чем сапротрофных бактерий, и колебалось от 9,5 тысяч кл/см2 до 17,4 тысяч кл/см2. Максимальное количество УОБ было обнаружено также на нижнем участке таллома, минимальное – на верхушечном. УОБ на поверхности талломов фукусовых водорослей, отобранных из чистой акватории, обнаружить не удалось. Возможно, что их численность оказалась ниже чувствительности использованного метода ее определения – 10 кл/мл смыва с поверхности водорослей.
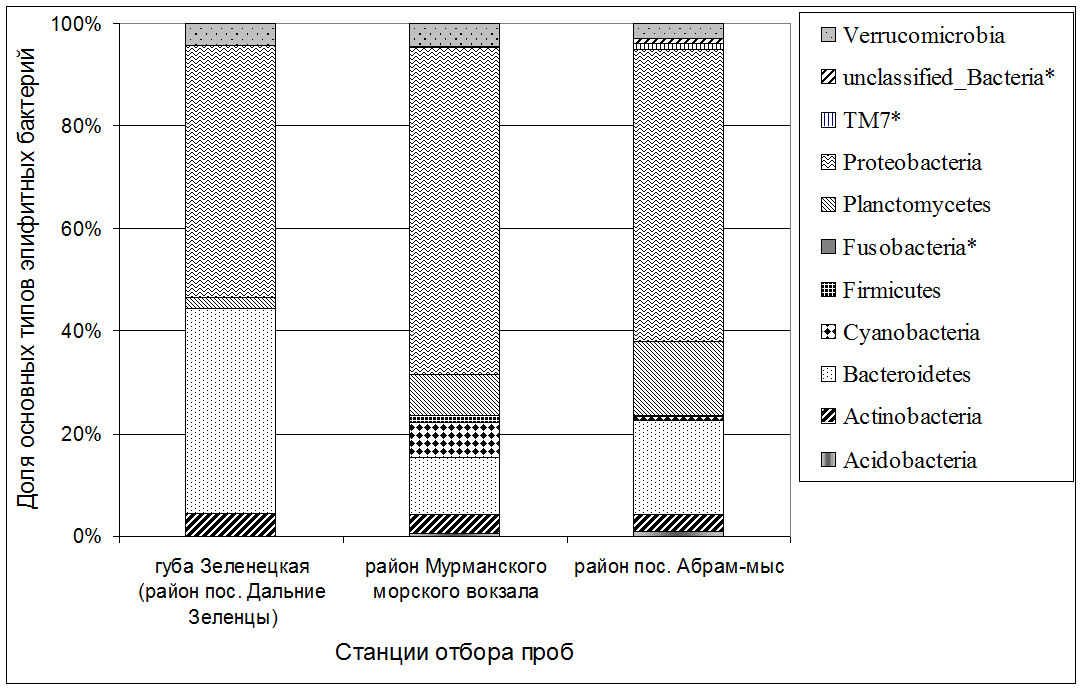
2.2.3. Таксономическая структура некультивируемых эпифитных бактериальных сообществ фукусов из трех акваторий с разным уровнем загрязнения Согласно результатам типирования нуклеотидных последовательностей, принадлежащих сообществу ЭБ фукуса с использованием метода секвенирования нового поколения (NGS) было обнаружено, что они принадлежат микроорганизмам 82-х родов, 16 классов и 11 типов. Среди последних присутствовали: Actinobacteria, Bacteroidetes, Planctomycetes, Proteobacteria, Verrucomicrobia, Acidobacteria, Cyanobacteria, Firmicutes, Fusobacteria, TM7 (Candidatus Saccharibacteria), к отдельному 11-му типу были отнесены нуклеотидные последовательности, принадлежащие неидентифицированным бактериям (Unclassified_Bacteria) (Рис. 13).
Рис. 13. Доминирующие типы эпифитных бактерий водорослей F. vesiculosus из трех различных по степени загрязнения нефтяными углеводородами акваторий
На фукусах из акватории ДЗ были обнаружены только 5 из упомянутых выше 11-ти типов эпифитных бактерий: Actinobacteria, Bacteroidetes, Planctomycetes, Proteobacteria, Verrucomicrobia, и еще один тип, который содержал незначительное количество неклассифицированных бактерий. При этом, независимо от места отбора материала для исследований, в бактериоценозах ЭБ из трех мест обитания доминировали бактерии двух типов – Bacteroidetes и Proteobacteria. Таким образом, наименьшее разнообразие сообщества ЭБ водорослей F. vesiculosus наблюдалось в чистой от нефтепродуктов губе Зеленецкой (ДЗ). Это может быть обусловлено более узким по сравнению с двумя другими акваториями спектром присутствующих в ней органических субстратов, доступных для гетеротрофных бактерий. Среди нуклеотидных последовательностей бактерий, обнаруженных в данной акватории, отмечены представители 28 родов, относящиеся к 8 классам и 5 типам: Actinobacteria, Bacteroidetes, Planctomycetes, Proteobacteria, Verrucomicrobia. Основными доминантами среди них были представители типов Proteobacteria (49,21%) и Bacteroidetes (40,13%) (Рис. 13). Известно, что бактерии типов Proteobacteria и Bacteroidetes являются обычным компонентом эпифитных бактериальных сообществ некоторых морских макрофитов в незагрязненных районах мирового океана (Коронелли, 1996; Ильинский, 2006; Tujula et al., 2010; Burke et al., 2011). Среди ЭБ фукусов из акваторий морского порта (МП) и Абрам мыса (АМ), доминировали протеобактерии (63,72% и 56,93% соответственно), наряду с ними была отмечена большая доля представителей типа Bacteroidetes (11,10% и 18,45% соответственно). Значительную часть бактериоценоза фукуса пузырчатого из загрязненной нефтепродуктами акватории МП составляли цианобактерии. В смывах с талломов фукусов, отобранных из акваторий АМ и МП, среди прочих были обнаружены нуклеотидные последовательности, принадлежащие к группе TM7. Доля этих нуклеотидных последовательностей от общего их количества составила 0,025% и 1,045% соответственно.
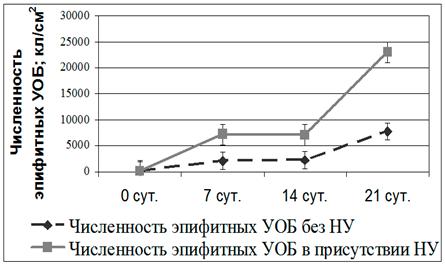
2.2.4. Роль бактериально-водорослевой ассоциации (БВА) в процессах биодеградации нефтяных углеводородов (НУ) Для определения роли бактериально-водорослевой ассоциации (БВА) в процессах биодеградации НУ были проведены лабораторные эксперименты, в ходе которых еженедельно определяли содержание в экспериментальных сосудах дизельного топлива (ДТ) в воде, численность по посеву эпифитных УОБ, интенсивность фотосинтеза (ИФ) и метаболическую активность клеток (МАК) талломов F. vesiculosus. Определение физиологического состояния водорослей показало, что превышение ПДК нефтепродуктов в воде (до 20 раз) не оказывает ингибирующего действия на физиологическую активность фукусов. Присутствие ДТ в опытных сосудах приводило к возрастанию численности эпифитных УОБ на талломах фукусов по сравнению с контролем без ДТ (Рис. 14).
Рис. 14. Изменение численности эпифитных углеводородокисляющих бактерий в морской воде в присутствии нефтяных углеводородов и без них
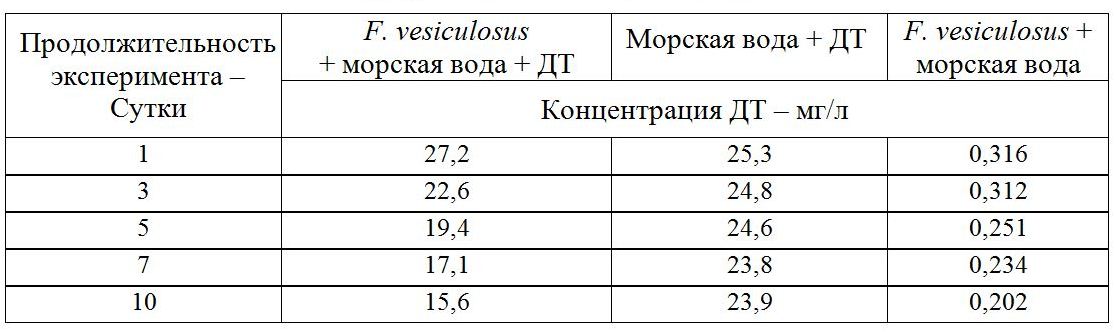
Численность УОБ в контрольных сосудах тоже постепенно возрастала в ходе эксперимента, однако в значительно меньшей степени. При оценке полученных результатов необходимо учитывать, что экспериментальные и опытные емкости представляли собой закрытые системы, поэтому в процессе эксперимента количество УОБ на талломах F. vesiculosus могло постепенно увеличиваться за счет накопления в среде продуктов метаболизма данного макрофита. Ранее было показано (Хайлов, 1971), что макроводоросли, за счет выделения метаболитов, доступных для микробной утилизации, могут создавать вокруг себя благоприятную среду для развития микроорганизмов (в том числе и УОБ), при этом формируя и контролируя их видовой состав. Известно также, что микробное окисление НУ может приводить к значительному снижению токсического эффекта НП на макрофиты, а выделение в среду метаболитов микроорганизмов может стимулировать развитие самих водорослей (Wrabel, Peckol , 2000). Для подтверждения высказанного нами ранее предположения о способности F. vesiculosus в ассоциации с УОБ к нейтрализации нефтепродуктов в воде была проведена серия экспериментов, результаты которых приведены в табл. 1.
Таблица 1. Динамика изменения содержания дизельного топлива (ДТ) летнего
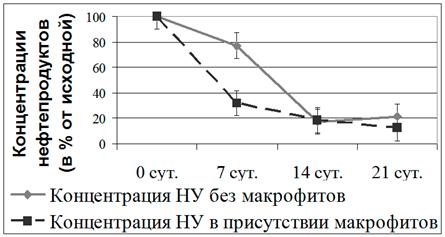
Опыты проводились в стеклянных емкостях (1 и 3 л) с морской водой 33‰, при температуре + 8–10ºС, освещенности около 5 Вт/м2 и постоянном перемешивании воды (магнитные мешалки). Емкости с фильтрованной морской водой содержали летнее дизельное топливо (ДТ) в концентрациях значительно превышающих ПДК (до 500 раз). В емкости вносились фрагменты молодых частей F. vesiculosus, взятого в природе. Контролем служили емкости с морской водой без фукуса с внесенным ДТ и емкости с морской водой с фукусом без ДТ. Одним из условий постановки экспериментов было отсутствие на поверхности воды пленки ДТ. Данные, полученные при помощи метода инфракрасной фотометрии, наглядно демонстрируют, что в присутствии F. vesiculosus снижение концентрации нефтепродуктов в воде происходит с гораздо большей интенсивностью. Содержание нефтепродуктов в присутствии F. vesiculosus уменьшилось за 10 дней на 11,6 мг, и всего на 1,4 мг в емкости без фукуса. Уменьшение содержания нефтепродуктов в воде без фукуса, по-видимому, является следствием испарения ДТ. Проведенные аналогичные, но более длительные эксперименты, также показали, что в присутствии фукусов НУ наиболее активно разрушались в первую неделю эксперимента, при этом их содержание в воде снижалось почти на 50% по сравнению с контролем без фукусов, но далее скорость этого процесса замедлялась. На 14-й день опыта остаточное количество ДТ в опытных сосудах (с фукусами) уже не отличалось от такового в контрольных. В сосудах без растений в первую неделю опыта содержание НУ уменьшалось только на 20–25%, а через 14 сут – на 80% и далее не изменялось (Рис. 15).
Рис. 15. Изменение содержания нефтяных углеводородов (НУ) в экспериментальных сосудах в присутствии фукуса и без него
Таким образом, наиболее эффективно удаление ДТ из экспериментальных сосудов происходит в течение первых семи дней после внесения ДТ. Можно полагать, что это происходит в первую очередь за счет его утилизации эпифитными УОБ фукуса при непосредственном участии также и самого макрофита. На это указывает большая разница между содержанием ДТ в опытных и контрольных сосудах, составляющая почти 50%. Что касается контрольных сосудов без фукусов, то ДТ из них удаляется исключительно за счет испарения фракции летучих углеводородов, входящих в состав ДТ.
3. Апробация санитарной водорослевой плантации в губе Оленья Мурманского побережья Баренцева моря
3.1. Особенности технологии постановки СВП в губе Оленья Санитарная водорослевая плантация является инженерным сооружением. Ее постановка и режим эксплуатации в Мурманском регионе требовали согласований с морской инспекцией, Министерством экологии и рядом контролирующих организаций, что связано с потенциальной возможностью, как любого инженерного сооружения в море, нанести ущерб окружающей среде, а также безопасности судоходства. Апробация СВП была начата в 2007 году на побережье Кольского залива (2007–2010 гг.), а промышленное использование – в 2011 году в Кандалакшском заливе Белого моря (ликвидация разлива нефтепродуктов в акватории Беломорской нефтебазы и нейтрализация нефтяного загрязнения в районе причала в губе Зеленецкая), а позже в акваториях нефтебазы и береговых предприятий г. Мурманска (2013–2015 г.). Для апробации технологии СВП был выбран участок в губе Оленья Кольского залива Баренцева моря – акватория Головного филиала ФГУП «ЦС «Звездочка» – Судоремонтного завода «Нерпа» (СРЗ «НЕРПА»). СРЗ «НЕРПА» более 30 лет специализируется на ремонте, утилизации атомных подводных лодок (Рис. 16–18).
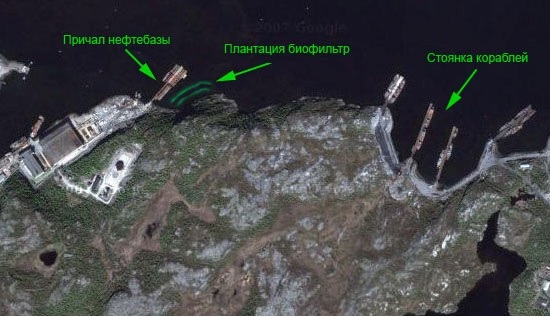
Рис. 16. Фрагмент губы Оленья с расположением плантации-биофильтра и источниками загрязнения:
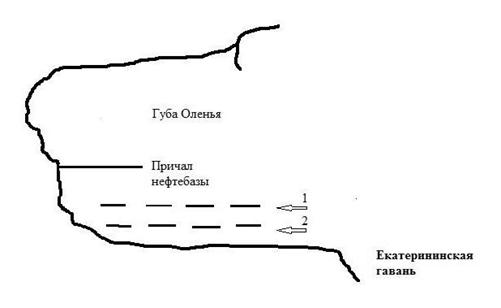
На разных этапах процесса утилизации (буксировка лодок к доку, разделка), в акваторию губы Оленья поступают нефтепродукты. В кутовой части губы Оленья, помимо СРЗ «НЕРПА», находится причал нефтебазы, куда регулярно подходят танкеры, доставляющие дизельное топливо для СРЗ «НЕРПА» и частично для нужд г. Снежногорска, т.е. первый потенциальный и реальный источник загрязнения находится в кутовой зоне губы.
Рис. 17. Карта-схема Кольского залива (стрелкой показано расположение губы Оленья)
Вторым, практически постоянным источником загрязнения нефтепродуктами является место дислокации кораблей Военно-морского флота (ВМФ), находящееся на выходе из губы Оленья в Екатерининской гавани. Нефтяная пленка, которая приносится восточными ветрами из Екатерининской гавани, покрывает водную поверхность губы Оленья.
Рис. 18. Рабочий участок – место постановки СВП в губе Оленья с двумя источниками загрязнения: 1) Кутовая зона губы: причал нефтебазы и СРЗ «НЕРПА», 2) Екатерининская гавань – место стоянки кораблей ВМФ. Пунктиром обозначены линии плантации: 1 – наружная и 2 – внутренняя, образующие «рабочий участок».
Окружить источники загрязнения плантациями было невозможно, так как это мешало бы перегрузке топлива и движению кораблей ВМФ. Вместе с тем, постановка плантаций в местах, не мешающих судоходству, могла обеспечить снижение негативного воздействия НП на прибрежную биоту в г. Оленья. Непосредственная защита от источников загрязнения осуществлялась для части южного берега (длина около 200 м, параллельно причалу нефтебазы) с помощью двух линий плантации – «рабочий участок» (Рис. 18). В сентябре – октябре 2007 г. была проведена установка якорей на глубине от 6–8 метров в кутовой части и на глубине 20–24 м в открытой части губы. Также было установлено по 1 якорю, ограничивающих плантацию для крепления шестов с сигнальными фонарями и вехами. От якорей к поверхности воды были протянуты «вертикальные» канаты диаметром 5 см. На поверхности к концам «вертикальных» канатов были прикреплены кухтыли-наплава. Длина вертикальных канатов незначительно превышала расстояние от дна до поверхности воды на момент максимального прилива («полной» воды). Собранные на литорали талломы фукуса вплетались в синтетические «горизонтальные» канаты: диаметром 3 см, длиной 26–27 м (25 м рабочих + 1–2 м на обвязку наплавов). В каждый канат было вплетено от 750 до 1000 талломов фукуса, в возрасте 3+, группами по 3–4 таллома. Работы по вплетению фукуса проводились при температуре +2 – +5 градусов. Горизонтальные канаты с вплетенными талломами доставлялись на плантацию и крепились на поверхности воды между вертикальными концами с наплавами, установленными на поверхности (Рис. 19 а). Для выращивания ламинарии нарезались поводцы: синтетические канаты длиной 5 м, диаметром 5–6 мм для последующего оспоривания S. latissima. Поводцы сутки промывали в море, укладывали в ванны с морской водой, после чего в ванну вносили суспензию спор сахарины в необходимой концентрации. Время выдержки поводцов в ваннах составляло 24 часа. Для контроля за оседанием, развитием спор, параллельно с субстратами в ванне закрепляли предметные стекла. Через 1,5 суток более 70% спор закрепилась на стеклах и проросла. Это дало основание предполагать закрепление, развитие спор ламинарии и на поводцах. Транспортировку оспоренных поводцов на плантацию осуществляли в ваннах или в пластиковых мешках с морской водой. На горизонтальных канатах поводцы закрепляли с промежутком 1 м друг от друга. К нижнему концу каждого поводца подвязывался груз, способствующий нахождению поводца в вертикальном растянутом положении. Растяжка поводцов противодействовала их перехлестыванию при штормовой погоде. Всего было оспорено и закреплено на горизонтальных канатах 300 поводцов. После закрепления поводцов с ламинарией на горизонтальные канаты, на последние крепили дополнительные кухтыли, чтобы талломы фукуса находились в поверхностном горизонте воды. В процессе реализации проекта осевшие споры S. latissima прошли стадии развития от прорастания до молодых спорофитов: растений в несколько сантиметров. Средняя масса талломов ламинарии, развившихся из осевших спор в ноябре 2007 г. и достигших стадии молодых спорофитов, составила на конец августа 26±9,2 г, длина пластины 32±6 см, ширина 9±2,3 см, площадь 288±14 см2. Их среднее число в конце августа – начале сентября составило на 1 поводце 140–170 штук. В апреле месяце в канаты-поводцы были вплетены спорофиты S. latissima в возрасте 0+ (сеголетки), длиной 15–30 см, взятые водолазами с глубины 5–7 метров на выходе из губы Оленья. Молодые спорофиты успешно прошли адаптацию на плантации. С апреля по июнь их масса увеличилась в 4 раза, ширина в 1,5, а длина в 2 раза. Фотосинтез у ламинарии за период существования на плантации вырос в 2 раза, составил 0,48 мгС/г сырого веса в час. В августе – сентябре средняя масса талломов ламинарии, развившихся из вплетенных молодых спорофитов, составила 290±36,2 г (сырой вес), длина пластины 98 см + (135+75), ширина 25 см, площадь 2450 см2 (Рис. 19 в).
Рис. 19 А. Санитарная водорослевая плантация в губе Оленья.
3.2. Обслуживание СВП, мелиоративные мероприятия Мелиоративные работы при плантационном выращивании водорослей делятся на две группы: часть проводится регулярно с периодичностью в 2–4 недели, а часть – по мере необходимости, обычно при повреждении элементов плантации. В декабре 2007 г. и в феврале 2008 г. поставленная плантация подверглась испытанию штормами (ветер 7–8 баллов, волнение 6–7 баллов). Остов плантации не получил повреждений, однако потребовалось проведение мелиоративных мероприятий: распутывание оспоренных поводцов, подтягивание канатов, подвешивание дополнительных кухтылей у сигнальных вех. После штормов осуществлялась ликвидация перехлестов канатов, чтобы избежать перетирания водорослей. В связи с тем, что на отдельных участках горизонтальных канатов растения фукуса были выбиты из субстрата, в эти места были вплетены новые талломы. Весна (март–июнь месяцы) характеризуются на Мурманском побережье Баренцева моря увеличением фотопериода, который стимулирует повышение скорости роста водорослей-макрофитов, компенсируя низкие температуры воды (март–начало апреля: 0º – -1,5º). В мае – первой половине июня условия произрастания для водорослей на плантации близки к оптимальным. В период активного роста у водорослей параллельно с увеличением площади макрофитов происходит и увеличение биомассы. На субстратах – канатах, сигнальных вехах в этот период появлялись зоо- и фито- обрастатели, в большом количестве обнаруживались мидийные «щетки». Вследствие этого многие горизонтальные канаты погружались в воду до 2 м, а иногда на большую глубину до полного затопления сигнальных вех. Чтобы удержать конструкцию на плаву каждые две недели проводилась регулировка плавучести, подтягивались канаты и подвязывались дополнительные кухтыли. Всего для этих целей было дополнительно закреплено на плантации около 100 наплавов.
4. Мониторинг за состоянием водной среды в районе плантации в период ее существования и функционирование СВП по очистке морской воды от загрязнения нефтепродуктами
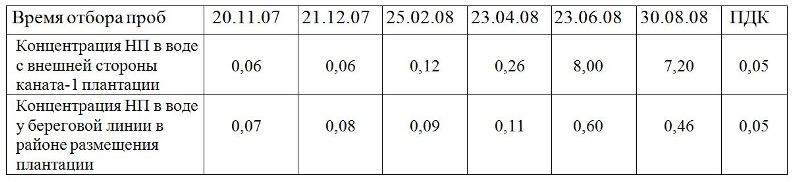
4.1. Нефтепродукты в морской воде в районе постановки СПВ Наблюдения за температурой, прозрачностью воды, химическим составом в период функционирования плантации не показали существенных отклонений в сезонных изменениях вышеуказанных характеристик от аналогичных в других губах Баренцева моря. Различия отмечены лишь в незначительном опреснении поверхностного слоя воды в весенне-летний период: в центральной части до 33,2, а в кутовой части губы Оленья до 29,5 единиц солености, из-за небольшого количества пресноводных стоков. Особое внимание было уделено содержанию нефтепродуктов. Если в осенне-зимний период отмечалось незначительное превышение ПДК, то в конце апреля месяца, по-видимому из-за усиления судоходства, содержание нефтепродуктов в районе плантации превысило пятикратное значение ПДК. В июне–августе месяце поверхность губы Оленья оказывалась достаточно часто затянутой нефтяной пленкой в результате поступления на акваторию большого объема НП. При восточных ветрах нефтяную пленку приносило из Екатерининской гавани, но основным источником загрязнения было выброшенное на берег бухты Незаметная аварийное судно, откуда в губу Оленья вылилось более тонны дизельного топлива и машинного масла. Визуальные наблюдения, анализ фотографий, выполненных в разных частях плантации в июне–августе показал, что у внешней линии плантации локализуется значительно больше НП, чем у внутренней. У внешнего каната наблюдаются нефтепродукты на разной стадии преобразования: от пленки, дающей блики всех оттенков до пены (Рис. 19 б). У внутреннего каната на поверхности воды видны небольшие пятна НП. Фукусовые водоросли на горизонтальных канатах выполняют функцию бонового заграждения, задерживая НП и предотвращая их распространение по акватории. Основной прессинг испытывала наружная линия плантации, расположенная ближе к средней части губы. Вторая линия задерживала остатки нефтепродуктов, прошедшие через первую. Таким образом, береговая зона в районе плантации оказывалась защищенной и не подверженной прямому воздействию нефтепродуктов. Визуальные наблюдения полностью подтверждаются результатами анализов содержания НП в районе плантации. В воде с внешней стороны каната-1 плантации, наиболее подверженной влиянию загрязнения, содержание НП в июне месяце достигало 8,0 мг/л, т.е. превышало ПДК более чем в 150 раз (табл. 2). В этот период концентрация НП в воде у берега также превышала ПДК, но всего в 12 раз. По-видимому, если пленочные формы НП задерживались фукусовыми водорослями, то растворенная часть углеводородов достигала береговой зоны.
Таблица 2. Содержание нефтепродуктов в воде в районе плантации (мг/л)
4.2. Нефтепродукты на поверхности и в тканях водорослей До настоящего времени в литературе дискутировался вопрос о роли водорослей в биоремедиации. В частности выполняют водоросли на плантации только роль бонового заграждения, препятствуя распространению НП по поверхности воды, или водоросли в ассоциации с УО-бактериями способны поглощать и нейтрализовать нефтяные углеводороды. Положительный ответ на этот вопрос заставляет по-новому взглянуть на роль водорослей-макрофитов в биоремедиации морских прибрежных акваторий. Для решения этого вопроса на базе ВНИИ метрологии им. Д.И. Менделеева (СПб) была разработана специальная методика по определению НП в водорослях-макрофитах. По содержанию НП в водорослях, проанализированных с момента постановки плантации в губе Оленья, в декабре, в феврале и в апреле достоверных отличий не отмечено. Резкое увеличение содержания нефтепродуктов у фукусов выявлено в июне месяце после поступления большого количества НП в губу Оленья. При визуальном осмотре было видно, что поверхность фукусовых водорослей покрыта слоем нефтепродуктов, часть из которых при поднятии каната стекала с водорослей вместе с водой, а часть оставалась на поверхности. При соприкосновении с поверхностью водорослей руки покрывались слоем НП, от водорослей исходил специфический запах.
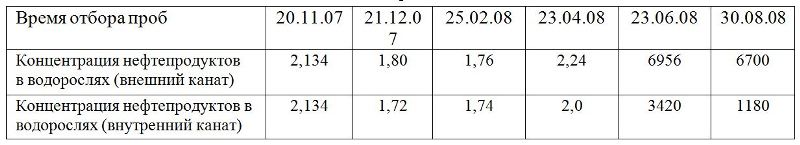
Таблица 3. Содержание нефтепродуктов в фукусовых водорослях на плантации в период эксперимента (мг/кг) сырой массы
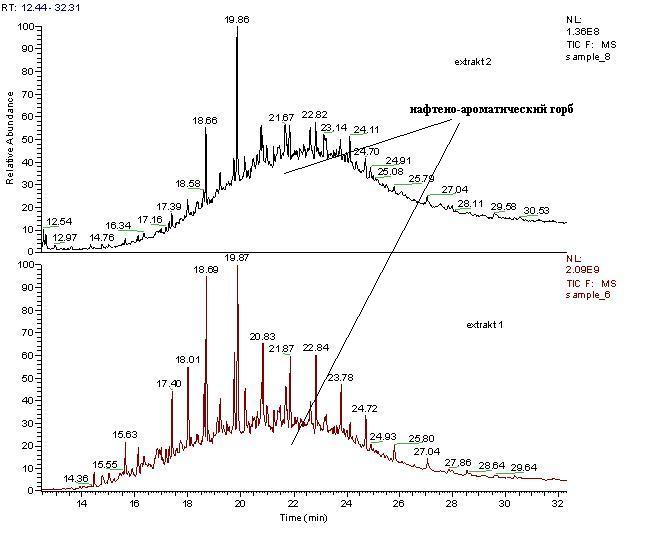
В лаборатории для определения количества нефтепродуктов, осевших на поверхности водорослей, осуществляли снятие нефтепродуктов с поверхности ватным тампоном, смоченным гексаном. После снятия нефтепродуктов с поверхности водоросли измельчали, смешивали с безводным сульфатом натрия и экстрагировали гексаном на УЗ-бане. Измерение проводили методом газовой хроматографии/масс-спектрометрии в режиме сканирования полного масс-спектра. Количественный анализ проводили методом абсолютной градуировки. Расчеты проводили в миллиграмм на килограмм (мг/кг) сухой массы. Анализы показали, что массовая доля НП в грязных водорослях (внешний канат, центральная часть плантации) 6956 мг/кг, из них 3238 мг/кг снято с поверхности и 3718 мг/кг экстрагировано из ткани (табл. 3). На рис. 20 приведены масс-хроматограммы, полученные для смыва с поверхности (1) и для экстракта тканей (2). В смыве с загрязненных водорослей были идентифицированы нефтяные углеводороды от С15 до С25 со значительным преобладанием н-алканов, а также реликтовые углеводороды нефти фитан и пристан. На хроматограмме экстракта тканей преобладающими являются пристан и фитан, значительно возрастает роль нафтено-ароматического горба, н-алканы практически отсутствуют. Такая картина характерна для нефтепродуктов, подвергшихся деградации. Можно предположить, что нефтепродукты частично впитываются в водоросли, где происходит их деградация.
Рис. 20. Масс-хроматораммы нефтепродуктов, извлечённых из загрязненных фукусовых водорослей: 1 – смыв с поверхности, 2 – экстракт тканей
Как отмечалось выше, горизонтальные канаты внутренней линии плантации подвергались меньшему воздействию нефтепродуктов. Соответственно меньше оказалось и максимальное накопление – 3420 мг/кг. Содержание нефтепродуктов в молодых спорофитах S. latissima при закреплении на субстраты плантации в апреле месяце было значительно меньше ПДК. В июне же и в августе месяце после нефтяных разливов содержание нефтепродуктов в ламинарии на плантации было весьма значительно: 725 мг/кг, хотя и меньше, чем у фукусовых водорослей. К сожалению, определить долю нефтепродуктов на поверхности таллома и внутри не удалось. При анализе динамики поглощения фукусовыми водорослями НП при постоянном источнике загрязнения, отмечается период стабилизации в накоплении НП. Можно предположить, что у водорослей существует определенный период насыщения нефтяными углеводородами, когда необходимо время для усвоения. Вместе с тем, эксперименты по влиянию присутствия фукусовых водорослей на содержание НП в воде, анализы содержания НП на поверхности и в ткани свидетельствуют в пользу роли водорослей не только как «фитобонов» или субстратов для УО-микрорганизмов, а и определяют их возможную роль в поглощении и нейтрализации нефтяных углеводородов. Проведенные расчеты на основании результатов экспериментов по влиянию ассоциации водоросли/бактерии на содержание НП в воде показали, что один квадратный метр плантации за 4–5 дней способен нейтрализовать пленку, образующуюся при разливе на этой площади 100 мл нефти или более 80 г углеводородов.
5. Опыт функционирования санитарных водорослевых плантаций В губе Оленья санитарная водорослевая плантация просуществовала 2,5 года. Она выдержала несколько штормов, разливов нефтепродуктов. Мониторинг за плантацией показал правильность технологии постановки. На плантации отмечался рост фукусовых водорослей, появление молодых проростков ламинарии, по-видимому, в результате самозасева спорами. Таким образом, можно считать СВП самовоспроизводящейся системой. К сожалению, из-за человеческого фактора, повреждения остова СВП в результате захода в район рабочего участка катера ВМФ, плантация прекратила существование. По аналогичной схеме была поставлена санитарная плантации в Кандалакшской губе Белого моря в акватории Беломорской нефтебазы, где происходила постоянная утечка нефтепродуктов. Впервые постановка плантации осуществлялась параллельно с постановкой силами МЧС бонового заграждения. В этом случае, если боны предотвращали распространение НП по поверхности воды, то на СВП ложилась задача по очистке ограниченной бонами акватории от нефтепродуктов. Плантация-биофильтр функционировала в районе Беломорской нефтебазы 4 месяца до ликвидации источника загрязнения. Данная работа имела особую значимость в связи с близостью к Беломорской нефтебазе береговой зоны Кандалакшского Государственного заповедника. Положительный опыт в использовании технологии СВП был отмечен в губе Зеленецкая, где из затонувшего у причала судна началась утечка дизельного топлива. Постановка плантации позволила предотвратить распространение НП по губе и возможную токсикацию нефтепродуктами гидробионтов, культивируемых в садках.
Заключение В основе санитарной водорослевой плантации лежит симбиотическая ассоциация водорослей и эпифитных углеводородокисляющих бактерий. Результаты проведенных лабораторных экспериментов позволяют утверждать, что данная ассоциация обладает более высоким потенциалом в отношении деструкции НУ по сравнению со свободноживущими планктонными формами бактерий. ЭБ принимают активное участие в биологической деструкции НУ, при этом они могут успешно адаптироваться даже к высокому уровню нефтяного загрязнения среды. Важную роль в этой ассоциации играют также и сами фукусовые растения как субстрат для развития углеводородокисляющих бактерий, а также в обеспечении УОБ кислородом, тем самым повышая их окисляющую активность. Вместе с тем, поглощение нефтяных углеводородов водорослями становится возможным только после того, как эпифитные бактерии переводят их в доступные формы. К сожалению, мы не можем пока ответить на вопрос о механизмах поглощения нефтяных углеводородов водорослями и их дальнейших превращениях. Предложенная нами технологическая схема СВП является универсальной не только для северных морей, но и для дальневосточных и южных. Отличием является биологическая компонента, при подборе которой необходимо учитывать региональные особенности. Так, на дальневосточных морях это могут быть саргассумы и ламинарии, а на южных морях – цистозира. Естественно, меняется и состав эпифитных микроорганизмов. Исследования последних лет показали перспективность использования для нейтрализации нефтяных загрязнений новых технологий СВП, обеспечивающих большую скорость и более низкую стоимость постановки плантации, возможность долгого хранения модулей плантации, большую устойчивость последних к штормовой погоде. И хотя в этих технологиях основной альгологической компонентой являются фукусовые водоросли, мы не исключаем, что продолжающиеся исследования позволят выявить новые объекты для использования в санитарной аквакультуре. В частности, требует дальнейшего изучения возможная роль ламинариевых водорослей, образующих заросли в сублиторали с запасами только в Баренцевом море до 300 тыс. тонн, в нейтрализации растворенных форм углеводородов. Полученные нами результаты позволяют приблизиться к пониманию значения симбиотических ассоциаций водорослей-макрофитов и эпифитных бактерий в процессах естественного очищения водной среды от нефтепродуктов и могут способствовать созданию новых и модернизации уже существующих технологий очистки от нефтяного загрязнения прибрежных зон Мирового океана.
Работа выполнена при финансовой поддержке Минобрнауки России в рамках проекта «Разработка методов экосистемного мониторинга заливов и шельфа Баренцева моря и высокоширотной Арктики, сценарного моделирования аварийных ситуаций при транспортировке нефтепродуктов и радиоактивных отходов и экспериментальных технологий их защиты от загрязнения в условиях морского перигляциала». Уникальный идентификатор проекта RFMEFI61616X0073.
Список литературы 1. Возжинская В.Б. Донные макрофиты Белого моря. – М.: Наука, 1986. – 191 с. 2. Воскобойников Г.М. Механизмы адаптации, регуляции роста и перспективы использования макрофитов Баренцева моря: Автореф. дис. докт. биол. наук. – Мурманск, 2006. – 46 с. 3. Воскобойников Г.М., Ильинский В.В., Лопушанская Е.М., Пуговкин Д.В. О возможной роли морских макрофитов в очистке поверхности воды от нефтяного загрязнения // Нефть и газ арктического шельфа. Материалы международной конференции. – Мурманск, 2008. – С. 63–65. 4. Воскобойников Г.М., Макаров М.В., Пантелеева Н.Н. Проблемы и перспективы биотехнологии культивирования бурых водорослей в Баренцевом море // Современные информационные и биологические технологии в освоении ресурсов шельфовых морей. – М.: Наука, 2005. – С. 256–273. 5. Воскобойников Г.М., Матишов Г.Г., Быков О.Д, Маслова Т.Г., Шерстнева О.А., Усов А.И. Об устойчивости морских макрофитов к нефтяному загрязнению // Доклады АН. Общая биология. 2004. Т. 397. № 6. С. 842–844. 6. Воскобойников Г.М., Пуговкин Д.В. О возможной роли Fucus vesiculosus в очистке прибрежных акваторий от нефтяного загрязнения // Вестник МГТУ. 2012. Т. 15. В. 4. С. 716–720. 7. Воскобойников Г.М., Степаньян О.В. Морфофункциональные изменения макроводорослей и прогноз развития прибрежных фитоценозов Мурманского побережья под влиянием нефтяного загрязнения. // Динамика морских экосистем и современные проблемы сохранения биологического потенциала морей России. – Владивосток: Дальнаука, 2007. – С. 392–417. 8. Ильинский В.В. Гетеротрофный бактериопланктон: экология и роль в процессах естественного очищения среды от нефтяных загрязнений: Автореф. дис. докт. биол. наук. – Москва, 2000. – 53 с. 9. Ильинский В.В. Гетеротрофный бактериопланктон // Практическая гидробиология: Под ред. В.Д. Федорова и В.И.Капкова. – М.: ПИМ, 2006. – 367 с. 10. Ильинский В.В., Воскобойников Г.М., Пуговкин Д.В., Комарова Т.И., Адейкина А.А. Влияние нефтяного загрязнения среды на состав и численность гетеротрофных эпифитных бактерий бурой водоросли Fucus vesiculosus // Вестник Южного научного центра РАН. 2010. Т. 6. № 2. С. 98–100. 11. Камнев А.Н. Структура и функции бурых водорослей. – М., 1989. – 200 с. 12. Коронелли Т.В. Принципы и методы интенсификации биологического разрушения углеводородов в окружающей среде (обзор) // Прикладная биохимия и микробиол. 1996. № 6. С. 579–585. 13. Кузнецов В.В. Белое море и биологические особенности его флоры и фауны. – М., Л.: Изд-во АН СССР, 1960. – 322 с. 14. Макаров М.В. Влияние ультрафиолетовой радиации на рост и размножение доминантных видов водорослей-макрофитов Баренцева моря: Автореф. дис. канд. биол. наук. – СПб, 1999. – 22 с. 15. Макаров М.В., Рыжик И.В., Воскобойников Г.М., Матишов Г.Г. Дифференциация пластины Laminaria saccharina (L.) Lamour как приспособление к длительному отсутствию освещения // Докл. РАН. 2006. Т. 409. № 5. С. 710–711. 16. Макаров М.В., Рыжик И.В., Воскобойников Г.М., Матишов Г.Г. Влияние интенсивности движения воды на морфологические и физиологические показатели Fucus vesiculosus L. Баренцева моря // ДАН. Общая биология. 2007. Т. 415. № 4. С.569–570. 17. Макаров М.В. Адаптация водорослей Баренцева моря к условиям освещения: дис. ... докт. биол. наук. – Мурманск, 2010. – 359 с. 18. Макаров В.Н., Джус В.Е., Матишов Г.Г., Хоряков К.Б., Воскобойников Г.М., Денисенко К.В., Шошина Е.В. Научно-практические аспекты культивирования ламинарии сахаристой в Баренцевом море – Препр. Апатиты: Изд. КНЦ РАН, 1986. – 35 с. 19. Макаров М.В., Рыжик И.В., Воскобойников Г.М., Матишов Г.Г. Влияние глубины произрастания на морфофизиологические показатели Fucus vesiculosus L. Баренцева моря // Доклады АН. 2010. Т. 430. № 3. С. 427–429. 20. Миронов О.Г. Взаимодействие морских организмов с нефтяными углеводородами. – Л.: Гидрометиоиздат, 1985. – 127 с. 21. Морозов Н.В., Телитченко М.М. Ускорение очищения поверхностных вод от нефти и нефтепродуктов вселением в них макрофитов // Водные ресурсы. 1977. № 6. С. 120–131. 22. Перетрухина И.В., Ильинский В.В., Кудасов В.И., Литвинова М.Ю., Балина Т.В. Определение углеводородокисляющей активности бактериальных сообществ в воде Кольского залива // Тез. докл. Международной научно-практической конференции «Наука и образование-2006». – Мурманск: МГТУ, 2006. – С. 593–596. 23. Пуговкин Д.В., Ляймер А.В., Йенсен Дж.Б. Эпифитные бактериальные сообщества водорослей Fucus vesiculosus в разных по степени загрязнения нефтепродуктами акваториях Баренцева моря // Доклады АН. 2016. Т. 471. № 3. С. 371–373. 24. Рыжик И.В., Макаров М.В., Воскобойников Г.М. Физиологическое состояние литоральных бурых водорослей Fucus serratus Linnaeus, 1753 и Fucus distichus Linnaeus, 1767, произраставших на плантации-биофильтре в Баренцевом море // Биология моря. 2014. Т. 40. № 2. С. 131–136. 25. Семенов А.М., Федоренко В.Н., Семенова Е.В. Микроорганизмы на поверхности морских макрофитов в северных морях России и их возможное практическое использование // Междисциплинарный научный и прикладной журнал «Биосфера». 2014. Т. 6. № 1. С. 60–76. 26. Хайлов К.М. Экологический метаболизм в море. – Киев: Наука думка, 1971. – 252 с. 27. Burke C., Thomas T., Lewis M., Steinberg P.,Kjelleberg S. Composition, uniqueness and variability of the epiphytic bacterial community of the green alga Ulva australis // The ISME J. 2011. V. 5. № 4. P. 590–600. 28. Gessner F. Hydrobotanik. Die physiologischen Grundlagen der Pflanzenverbreitung im Wasser. 1. Energiehaushalt. – Berlin: VEB Deutscher Verlag der Wissenschaften, 1955. – 517 pp. 29. Mikulski J.S. Biologia wod srodladowych. – Warszawa: PWN, 1982. – 491 pp. 30. Tujula N.A., Crocetti G.R., Burke C., Thomas T., Holmstrom C., Kjelleberg S. Variability and abundance of the epiphytic bacterial community associated with a green marine Ulvacean alga // ISME Journal. 2010. V. 4. P. 301–311. 31. Wrabel M.L., Peckol P. Effects of bioremediation on toxicity and chemical composition of No. 2 Fuel Oil: Growth responses of the brown alga Fucus vesiculosus // Mar. Pollut. Bull. 2000. V. 40. № 2. P. 135–139. Статья поступила в редакцию 2.03.2017
Sanitary algae plantation for the bioremediation of coastal waters from oil: from theory to practice Grigory M. Voskoboynikov1, Vladimir V. Il'inskii 2, Elena M. Lopushanskaya3, Mikhail V. Makarov1, 1Murmansk marine biological institute KSC RAS (Murmansk, Russia)
The scheme of sanitary algae plantation was depicted and successfully aprobated in the Barents and the White seas. The plantation is based on symbiotic association of brown algae: Fucus vesiculosus, Saccharina latissima and hydrocarbon oxydizing bacteria. The analysis of speed of growth and other physiological features of plantation. Biochemical and physiological characteristics for F. vesiculosus were identified which is capable to long life under conditions of constant oil pollution. The role of F. vesiculosus in the purification of sea waters from petroleum products (PP) was shown. This type is able to accumulate and to involve PP in metabolism. The dynamics of PP degradation with fucus was shown. It was found out that the oil pollution of the marine environment leads to increasing of total number of bacteria including the saprotrophic and hydrocarbon-oxidizing. The data of the taxonomic assignment of hydrocarbon bacteria dominant on the fucus surface was obtained. Updatel information of the nature symbiotic association of algae and oil-oxidizing bacteria enhances greatly understanding of the role of biological factors in the clean-up of sea waters from oil and may become the basis for the development of sanitary aquaculture. Key words: sanitary aquaculture; symbiotic association of brown algae; hydrocarbon oxydizing bacteria; oil pollution of the marine environment.
Об авторах Воскобойников Григорий Михайлович - Voskoboynikov Grigory M. доктор биологических наук grvosk@mail.ru Ильинский Владимир Викторович – Il'inskii Vladimir V. доктор биологических наук, профессор vladilinskiy@gmail.com Лопушанская Елена Михайловна – Lopushanskaya Elena M. ведущий научный сотрудник, ведущий специалист НИО госэталонов в области органического и неорганического анализа, ВНИИМ им. Д.И. Менделеева, Санкт-Петербург, Россия (All-Russian scientific research Institute of Metrology, St.Petersburg, Russia) lem@b10.vniim.ru Макаров Михаил Владимирович - Makarov Mikhail V. доктор биологических наук zelentsy@yandex.ru Пуговкин Дмитрий Витальевич – Pugovkin Dmitry V. кандидат биологических наук pugovkin2005@yandex.ru Рыжик Инна Валериевна – Ryzhik Inna V. кандидат биологических наук alaria@yandex.ru Ляймер Антон Владимирович – Anton V. Liaimer доцент, Арктический университет Норвегии (Университет Тро́мсё), Тро́мсё, Норвегия (The Arctic University of Norway, Tromsø, Norway), кафедра Арктической и морской биологии anton.liaimer@uit.no Йенсен Джон Бек – Jensen John B. доцент, Арктический университет Норвегии (Университет Тро́мсё), Тро́мсё, Норвегия (The Arctic University of Norway, Tromsø, Norway), кафедра Арктической и морской биологии John.jensen@uit.no Корреспондентский адрес: Россия, 183010, ул. Владимирская, 17, Мурманск, ММБИ КНЦ РАН; тел. 8-8152-250696, факс 8-8152-253994.
ССЫЛКА НА СТАТЬЮ: Воскобойников Г.М., Ильинский В.В., Лопушанская Е.М., Макаров М.В., Пуговкин Д.В., Рыжик И.В., Ляймер А., Йенсен Дж.Б. Санитарная водорослевая плантация для очистки прибрежных акваторий от нефтепродуктов: от теории к практике // Вопросы современной альгологии. 2017. № 3 (15). URL: http://algology.ru/1184
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮ
|
|||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||