|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Динамика жизнеспособности и компонентов биохимического состава Arthrospira (Spirulina) platensis (Nords) Gomont в зависимости от температуры дегидратации при переводе в состояние ангидробиоза
Харчук И.А. Irina A. Kharchuk
Институт морских биологических исследований им. А.О.Ковалевского (г. Севастополь)
УДК 582.232:577.115
Изучена жизнеспособность и биохимический состав клеток Arthrospira (Spirulina) platensis в зависимости от температуры обезвоживания через год пребывания в состоянии ангидробиоза и после реактивации. Сравнительный анализ биохимических компонентов обезвоженных клеток А. platensis зафиксировал изменения в содержании пигментов с повышением температуры дегидратации от 30 до 70°С. Во время хранения (в течение одного года) количество всех биохимических показателей практически не изменялось, отмечена только деструкция ДНК. В процессе реактивации повреждения репарируются и клетки переходят к метаболизму. Установлено, что жизнеспособность сохраняемых образцов изменяется с увеличением температуры дегидратации. Ключевые слова: ангидробиоз; жизнеспособность; обезвоживание; реактивация; Arthrospira (Spirulina) platensis.
Среди научных и практических задач, тесным образом связанных с проблемами покоя и анабиоза, важное значение имеет задача надежной консервации коллекционных культур микроорганизмов (Бекер, Райпулис, 1990; Похиленко и др., 2009; Borovikova, 2014), длительного сохранения их в некотором исходном состоянии, свойственном им в природе или созданном человеком в результате генетических, физиологических и других манипуляций. Перевод микроводорослей в неактивное состояние путем глубокого и длительного торможения метаболизма клеток, но обратимое при благоприятных условиях среды, можно использовать как способ длительного хранения. Его можно достичь с помощью обезвоживания микроводорослей, в результате чего клетки переходят в анабиотическое состояние. Процесс обезвоживания (дегидратации) микроорганизмов всегда связан с определенными изменениями в рассматриваемой системе (Беккер и др., 1981; Беккер, 1987; Alpert, 2006; Rebecchi, 2007; Roda, 2014). На популяционном уровне наблюдается уменьшение числа жизнеспособных клеток; на клеточном уровне четко видны изменения на поверхности клетки, в ядре и, особенно, в мембранных структурах (Беккер, 1987; Billi, Potts, 2002; Borovikova, 2014); на молекулярном уровне после пребывания клеток в анабиотическом состоянии можно констатировать определенные изменения молекул биополимеров, особенно их функций (Клочкова и др., 2015; Borovikova, 2014, Wolkers et al., 2002). Цель данной работы – изучить жизнеспособность и изменение биохимического состава клеток прокариотических микроводорослей в зависимости от температуры обезвоживания, а также через год пребывания в состоянии ангидробиоза и после реактивации.
Материал и методы Объектом исследования был штамм цианобактерии Arthrospira (Spirulina) platensis (штамм IMBR-31), сохраняемый в отделе биотехнологии и фиторесурсов ИМБИ РАН. Цианопрокариоты культивировали в накопительном режиме, при постоянном круглосуточном освещении и автоматическом перемешивании с использованием насоса для удаления избытка кислорода из среды и равномерного прогрева всего слоя питательного раствора культуры. Интенсивность света на поверхности раствора составляла 10,7 клк. Температура среды колебалась в диапазоне 20–25°С. В качестве питательной среды использовали среду Заррука (Faucher et al., 1979). Культиваторами для выращивания прокариотов служили стеклянные стаканы объемом 2 дм3, объем среды в которых составлял 1 дм3, при высоте слоя 14–15 см. На стационарной фазе роста проводили концентрирование трихомов на планктонном сите 100 ПЭ (Richmond et al., 1990). Сконцентрированную культуру А. platensis промывали дистиллированной водой в соотношении 1:3 (вода:клетки). Затем полученную пасту водорослей разделяли на три части и высушивали до воздушно-сухого состояния в термостате при температуре 30, 60 и 70°С. Продолжительность обезвоживания – 24 часа. Обезвоженные клетки цианопрокариотов хранили в герметично закрытых полиэтиленовых упаковках в темноте при температуре 15–20°С. Влажность в обезвоженных культурах определяли стандартным методом доведения до постоянной массы (Методы …, 1975). Массовую долю белка в водоростях определяли по методике Лоури (Lowry et al., 1951), содержание пигментов – спектрофотометрическими методами на приборе СФ-2000 (Rowan, 1989). Хлорофилл а (Хл а) из сухих клеток А. platensis экстрагировали 90%-ным ацетоном; оптическую плотность полученных супернатантов регистрировали при длине волны 663 нм (Jeffrey, Humphrey, 1975). Содержание хлорофилла в клетках подсчитывали с помощью специфического коэффициента экстинкции, равного 88,15 дм3ּг-1×см-1 (при λ= 663 нм) (Jeffrey, Humphrey, 1975). Каротиноиды (КР) оценивали в суммарной вытяжке пигментов А. platensis по поглощению в области 480 нм (Rowan, 1989). Общее содержание липидов находили весовым методом (Методы …, 1975). Количество свободных нуклеотидов (СН), РНК и ДНК определяли спектрофотометрическим методом (Спирин, 1958). Регистрируемые показатели химического состава выражали в пересчете на сухую массу (СМ). Через 1 год пребывания А. platensis в состоянии ангидробиоза изымали навески для биохимического анализа и реактивации. Определение живых и мертвых клеток проводили методом дифференциального окрашивания с помощью реактива метиленового синего (Методы …, 1975). Реактивированную культуру выращивали в накопительном режиме при тех же условиях, как описано выше. По достижению ею стационарной стадии роста, трихомы А. platensis концентрировали на планктонном сите, промывали дистиллированной водой, высушивали и проводили биохимический анализ клеток как приведено выше. Результаты подтверждены статистически.
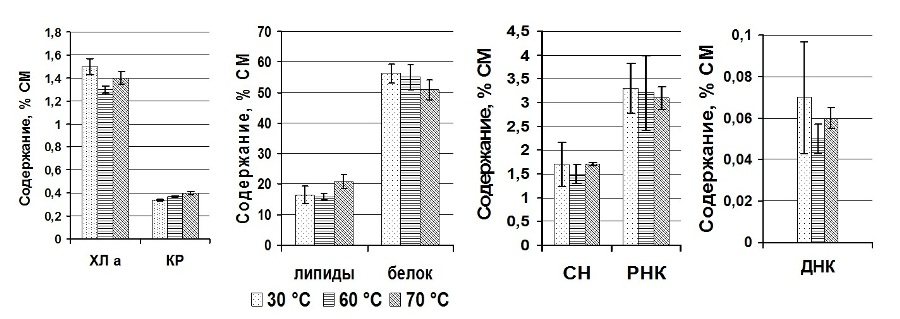
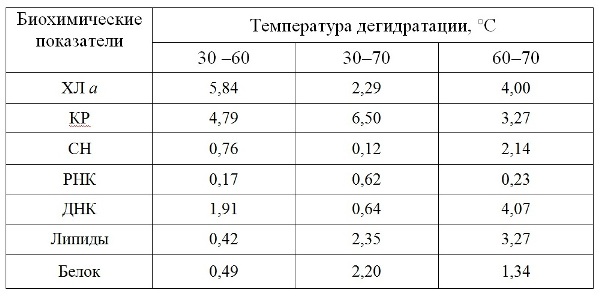
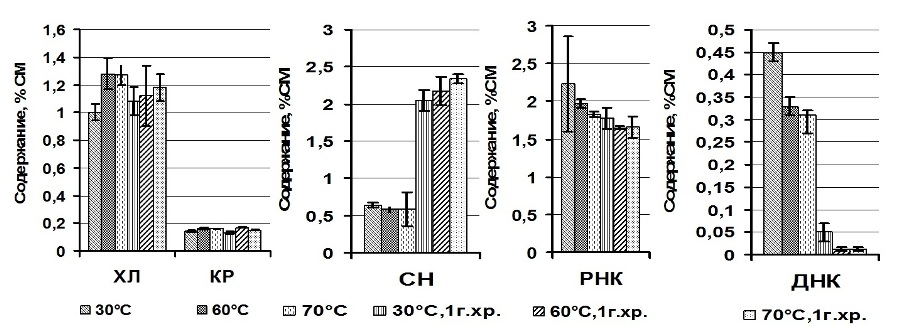
Результаты и обсуждение С целью выбора температуры обезвоживания исследовали динамику компонентов биохимического состава в зависимости от температуры дегидратации (рис. 1). Анализ пигментного комплекса А. platensis выявил снижение содержания Хл a – на 16% с увеличением температуры дегидратации от 30 до 60°С. В то время как доля КР статистически значимо повышалась при температуре от 30 до 60°С – на 9%, и от 30 до 70°С – на 17%. Данное явление обусловлено тем, что хлорофиллы – лабильная пигментная фракция, подверженная действию высоких температур, а КР – более стабильный компонент пигментной системы. Изучение нуклеинового комплекса выявило, что содержание СН, РНК, ДНК и белков не зависело от температуры обезвоживания, данные подтверждены статистически с помощью критерия t–Стьюдента (табл. 1). Через год пребывания прокариотов в состоянии ангидробиоза изымали аликвоту сохраняемых образцов для проведения биохимических исследований и реактивации. Анализ биохимических показателей А. platensis, находящихся в анабиотическом состоянии в течение года, выявил статистически незначительное снижение концентрации Хл а, КР и РНК (рис. 2) по сравнению с этими показателями перед закладкой на хранение, что может свидетельствовать о стабильности пигментной системы и РНК в течение сохраняемого срока. Доля свободных нуклеотидов в клетках за этот же период возросла в 4 раза, а ДНК снизилась в 9, 27 и 26 раз при 30, 60 и 70°С соответственно. Резкое возрастание концентрации свободных нуклеотидов у А. platensis произошло, возможно, из-за деструкции ДНК и РНК. Далее клетки цианопрокариотов подлежали реактивации.
Рис.1. Содержание компонентов сухого вещества Arthrospira (Spirulina) platensis в зависимости от температуры дегидратации (доверит. интервал, при Р = 0,95) Fig.1. The content of dry matter components of Arthrospira (Spirulina) platensis depending on temperature of dehydration (confidence interval at P = 0.95)
Табл. 1. Критерий t–Стьюдента для различных биохимических компонентов в зависимости от температуры обезвоживания Arthrospira (Spirulina) platensis (t05 = 2,781) Table 1. T-Student's test for various biochemical components depending on the dehydration temperature of Arthrospira (Spirulina) platensis (t05 = 2,781)
Рис. 2. Содержание компонентов сухого вещества Arthrospira (Spirulina) platensis в зависимости от температуры дегидратации и срока хранения (доверит. интервал, при Р = 0,95) Fig. 2. The content of dry matter components of Arthrospira (Spirulina) platensis depending on the dehydration of temperature and storage time (confidence interval at P = 0.95)
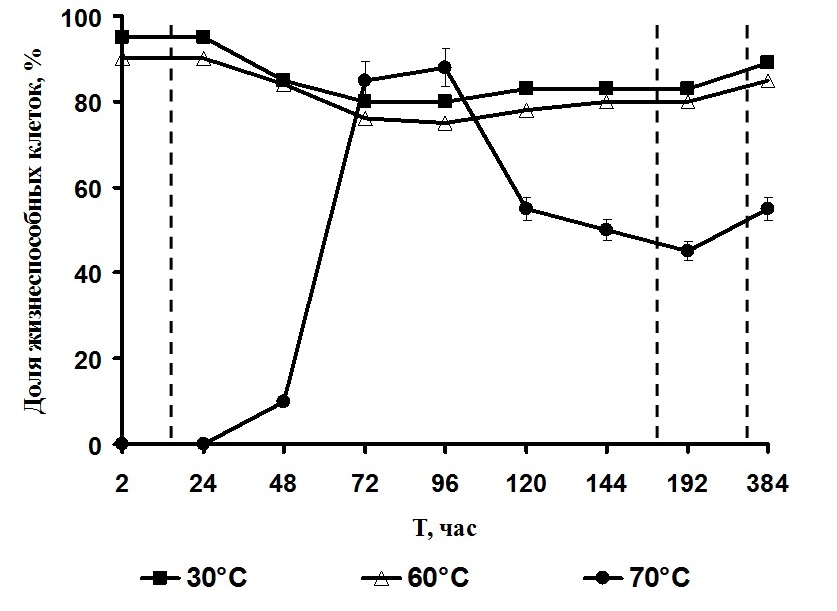
В первые часы реактивации А. platensis наиболее высокая доля жизнеспособных клеток (90–95%) была выявлена в культурах, обезвоженных при температуре 30 и 60°С (рис. 3). Отсутствие жизнеспособных клеток и наличие лизированных наблюдали в культурах, обезвоженных при 70°С. В культурах, обезвоженных при температурах 30 и 60°С, в течение 24–72 ч отмечали снижение количества жизнеспособных клеток до 80–75%, начиная с 96 до 192 ч их количество оставалось стабильным и составляло 75–83%. У культуры А. platensis, высушенной при температуре 70°С, через 48 ч от начала реактивации доля жизнеспособных клеток составила 10%, а через 72 ч наблюдали увеличение доли жизнеспособных клеток до 85%.
Рис. 3. Влияние температуры обезвоживания Fig. 3. Influence of temperature of dehydration
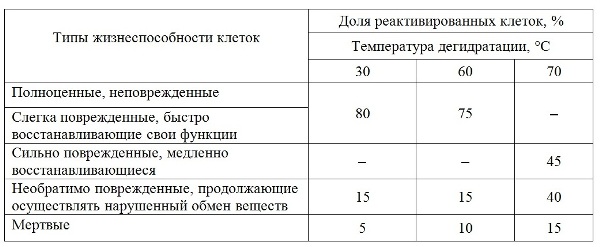
Однако после 96 ч их количество вновь снижалось и продолжало убывать до 192 ч, после чего стабилизировалось (рис. 3). Во всех исследуемых образцах через 384 ч реактивации отмечали увеличение числа жизнеспособных клеток. Анализ полученных данных показал, что согласно классификации клеток по жизнеспособности, разработанной М.Н. Мейсель с соавт. (Мейсель и др., 1961), в реактивированных культурах присутствуют клетки 5-ти типов (табл. 2). В культурах А. platensis, обезвоженных при 30 и 60°С, разделение на 1-й и 2-й тип клеток следует считать условным из-за трудности их дифференциации. Сильно поврежденные, медленно восстанавливающиеся клетки были отмечены только в культуре, обезвоженной при 70°С, на репарацию повреждений им потребовалось 8 дней. Общая потеря клеток во время реактивации составляла в культуре, дегидратированной при 30°С, – 20%, при 60°С – 25%, а при 70°С – 55%. Учитывая данные биохимических исследований и жизнеспособности клеток, можно предположить, что гибель клеток вызвана нарушениями ферментативных процессов в клетках во время обезвоживания при температуре 70°С, в связи с чем увеличилось количество необратимо поврежденных клеток. Таким образом, экспериментально установлено, что количество жизнеспособных клеток зависит от температуры обезвоживания. Оптимальная температура дегидратации А. platensis находится в диапазоне от 30 до 60°С. Дегидратация при температуре 70°C сопровождается повреждением большего количества клеток. Для вступления А. platensis в лог-фазу клеткам необходимо восстановить все повреждения, которые имели место при дегидратации.
Табл. 2. Классификации клеток Arthrospira (Spirulina) platensis по жизнеспособности при различных температурах дегидратации Table. 2. Classification of Arthrospira (Spirulina) platensis cells by viability depending on the dehydration of temperature
Реактивированные клетки А. platensis были выведены в накопительную культуру и по достижению ими стационарной стадии роста проводился анализ содержания биохимических компонентов. Биохимические показатели реактивированных культур А. platensis практически не отличались от контрольной (не подвергавшейся обезвоживанию) и не зависели от сроков пребывания в обезвоженном состоянии.
Заключение Отмечены изменения в содержании пигментов в зависимости от температуры обезвоживания. Однако во время хранения в течение одного года количество всех биохимических показателей практически не изменялось, кроме ДНК, доля которого значительно снизилась. Тем не менее, в процессе реактивации происходит репарация повреждений и восстановление фотосинтетического аппарата клетки, после чего клетки переходят в лог-фазу развития. В клетках, обезвоженных при 70°С, эти процессы были замедлены, и отмечено большое количество поврежденных клеток. Биохимические показатели восстановленных клеток идентичны контрольной культуре, что также свидетельствует о полной реактивации.
Работа выполнена в рамках госзадания № 1001-2014-0017 «Разработка научных основ решения гидробиологических и биотехнологических проблем интегрированного управления прибрежными зонами»
Список литературы 1. Бекер М.Е., Дамберг Б.Э., Рапопорт А.И. Анабиоз микроорганизмов. – Рига: Зинатне, 1981. – 252 с. 2. Бекер М.Е. Современные представления об анабиозе микроорганизмов // Торможение жизнедеятельности клеток. – Рига: Знатнее, 1987. – С. 9–19. 3. Бекер М.Е., Райпулис Е.П. Живая клетка и ее жизнедеятельность // Биотехнология. – Москва: ВО «Агропромиздат», 1990. – С. 7–41. 4. Клочкова Т.А., Клочкова Н.Г., Очеретяна С.О., Ким Г.Х. Влияние долговременного обезвоживания на морские зеленые водоросли Prasiola delicata и Rosenvingiella constricta (Chlorophyta, Prasiolales) // Вестник КамчатГТУ. 2015. №34. С. 33–45. [doi: 10.17217/2079-0333-2015-34-33-45/ 5. Мейсель М.Н., Медведева Г.А., Алексеева В.М. О выявлении живых, повреждённых и мертвых микроорганизмов // Микробиология. 1961. Т.30, вып. 5. С. 855–862. 6. Методы физиолого-биохимического исследования водорослей в гидробиологической практике // А.В. Топачевский (отв. ред.) – Киев: Наук. думка, 1975. – 247 с. 7. Похиленко В.Д., Баранов А.М., Детушев К.В. Методы длительного хранения коллекционных культур микроорганизмов и тенденции развития // Известия высших учебных заведений. Поволжский регион. 2009. № 4. C. 99–121. 7. Спирин А.С. Спектрофотометрическое определение суммарного количества нуклеиновых кислот // Биохимия. 1958. Т.23, №5. С. 656–662. 9. Alpert P. Constraints of tolerance: why are desiccation tolerant organisms so small or rare? // Journal of Experimental Biology. 2006. V.209. P. 1575–1584. doi:10.1242/jeb.02179. 10. Billi D., Potts M. Life and death of dried prokaryotes // Research in Microbiology. 2002. V.153. P. 7–12. http://dx.doi.org/10.1016/S0923-2508(01)01279-7. 11. Borovikova D. Anhydrobiosis of yeast: changes of cell surface structures and non-conventional applications of anhydrobiosis: Doctoral thesis, Submitted for the degree of Doctor of Biology Subfield of Microbiology. – Riga, 2014. – C. 105. 12. Faucher O., Coupal B., Leduy A. Utilization of scawater – urea as a culture medium for Spirulina maxima // Can Journ. Microbiol. 1979. V.25, №6. P. 752–759. 13. Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c1, and c2 in higher plants, algae and natural populations // Biochem. Physiol. Planten. 1975. №167. P. 191–194. 14. Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent // Journ. Biol. Chem. 1951. V.193, №1. P. 265–275. 15. Rebecchi L., Altiero T., Guidetti R. Anhydrobiosis: the extreme limit of desiccation tolerance // Invertebrate Survival Journal. 2007. V.4. P. 65–68. 16. Richmond A., Lichtenberg E., Stahl B., Vonshak A. Quatitative assessment of the major limitations on productivity of Spirulina platensis in open raceways // Journ. Appl. Phycol. 1990. V.2, №3. Р. 195–206. 17. Roda F. Al-Thani. Hypolithic cyanobacteria colonization of quartz at south desert // OnLine Journal of Biological Sciences. 2014. V.14. №1. P. 57–63. doi: 10.3844/ojbssp.2014.57.63 (http:// www.thescipub.com/ ojbs.toc) 18. Rowan K.S. Photosynthetic Pigments of Algae. Cambridge: Cambridge Univ. Press, 1989. 334 p. 19. Wolkers W.F., Tablin F., Crowe J.H. From anhydrobiosis to freeze – drying of eukaryotic cells // Comparative Biochemistry and Physiology Part A. 2002. V.131. P. 535–543. Статья поступила в редакцию 15.12.2017
Dynamics of viability and components of biochemical composition Arthrospira (Spirulina) platensis (Nords) Gomont depending on the dehydration temperature transferring at anhydrobiosis state Irina A. Kharchuk Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) There were investigated viability and biochemical composition of Arthrospira (Spirulina) platensis cells depending on the dehydration temperature through a year in anhydrobiosis state and after reactivation. Comparative analysis of biochemical components of dehydrated cells of A. platensis recorded changes of pigment content at increasing of dehydration temperature from 30 to 70°C. During storage (for one year) the values of biochemical parameters did not change almost, just DNA degradation was noticed. The damages are repaired and cells pass to metabolism during the reactivation. It was found the viability of stored samples were varied with increasing temperature of dehydration. Keywords: anhydrobiosis; viability; dehydration; reactivation; Arthrospira (Spirulina) platensis.
Об авторе Харчук Ирина Алексеевна - Kharchuk Irina A. кандидат биологических наук seaferm@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ: Харчук И.А. Динамика жизнеспособности и компонентов биохимического состава Arthrospira (Spirulina) platensis (Nords) Gomont в зависимости от температуры дегидратации при переводе в состояние ангидробиоза // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1258 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||
|
| ||