№ 3 (18) 2018
Динамика полисахаридов в непрерывной культуре
микроводоросли Тetraselmis viridis
Dynamics of polysaccharides in continuous culture Tetraselmis viridis
Новикова Т.М.
Tatyana M. Novikova
Институт морских биологических исследований им. А.О.Ковалевского РАН (Севастополь, Россия)
УДК 582.26/.27:579:581.19:57.083.1
В работе сравниваются продукционные характеристики Teraselmis viridis при непрерывном (а именно плотностатном) и накопительном выращивании микроводоросли. Получены значения общих углеводов в культуре микроводоросли для семи стационарных состояний. Культура тетраселмис облучалась насыщающей интенсивностью, что привело к росту содержания полисахаридов в культуре микроводоросли.
Ключевые слова: удельная скорость роста; продуктивность; непрерывная культура.
Управление скоростью и качественной направленностью биосинтеза является одной из актуальных проблем современной теоретической и экспериментальной биологии. На сегодняшний день показано, что основным параметром, регулирующим рост клеток микроводорослей, является свет. Накопительные культуры микроводорослей, в которых происходит изменение абиотических и биохимических характеристик культуры, сложны для оценки продукционных характеристик и выявления фактора, определяющего фотобиосинтез. Применение непрерывного, а именно плотностатного культивирования имеет ряд важных особенностей. Главные из них связаны с разделением потоков энергетического фактора и потока элементов минерального питания.
Цель данного исследования – изучить влияние стационарной оптической плотности культуры на рост и накопление углеводов микроводоросли Teraselmis viridis.
Материалы и методы
Культура Tetraselmis viridis Rouch. была получена из коллекции Института морских биологических исследований им. А.О. Ковалевского РАН (г. Севастополь). T. viridis выращивали в унифицированной установке для культивирования микроводорослей (Тренкеншу и др., 2017), для приготовления среды растворяли в 1 л морской воды следующие вещества: NaNO3 – 1,8 г/л; NaH2PO4 × 2H2O – 0,3 г/л; Na2EDTA – 0,037 г/л; FeC6H5O7 × 3H2O – 0,042 г/л; MnCl2 × 4H2O – 0,008 г/л; Co(NO3)2 × 6H2O – 0,00625 г/л; (NH4)6Mo7O24 × 4H2O – 0,00183 г/л; K2Cr2(SO4)2 × 24H2O – 0,00238 г/л (Тренкеншу, 1984).
Фотобиореактор представлял собой емкость из стекла размером 400×200×50 (плоскопараллельный тип) с рабочей толщиной 50 мм, рабочий объем – 3 л. В качестве источника света использовалась горизонтальная световая решетка, состоящая из 10 ламп дневного света General Electric F18W/54-765, средняя освещенность на поверхность реактора составляла 54 Вт/м2. Барботаж культуры осуществляли газо-воздушной смесью с 3% по объему углекислого газа с помощью компрессорной установки, скорость подачи воздуха была установлена на уровне 1 л на литр культуры в минуту. Значение температуры составляло 28±2○С.
В эксперименте проводили измерение температуры, рН, оптической плотности суспензии. Перед проведением измерений в фотобиореактор добавляли дистиллированную воду с целью компенсации испарения. Температуру суспензии измеряли ртутным термометром непосредственно в культиваторе, абсолютная погрешность измерений составляла ±0,5°С. Освещенность поверхности фотобиореактора определяли люксметром Ю-116. Оптическую плотность при длине волны 750 нм использовали как косвенный показатель биомассы водорослей. Оптическую плотность рассчитывали по формуле:
D = - lg(T),
где Т – величина пропускания, определяемая на КФК-2 при длине волны 750 нм, абсолютная погрешность при измерении величины пропускания не превышала 1%. Культура была переведена в плотностатный режим культивирования, причем стационарные плотности были заданы в диапазоне от 0,4 до 1 г/л с шагом 0,1 г/л. Такой режим выращивания обеспечивал непрерывную постоянную скорость роста и позволял получать ежесуточно объем сливаемой культуры в количестве, необходимом для биохимических измерений. После того как культура адаптировалась к каждой плотности и наступало состояние стационарного динамического равновесия, в течение трех суток проводился отбор проб для определения углеводов в культуре T. viridis с использованием метода с L-триптофановым реактивом (Kopytov et al., 2015).
Результаты и обсуждения
Перед началом исследования инокулят культуры Teraselmis viridis, полученный из коллекции, был адаптирован к условиям эксперимента. Культура выращивалась в накопительном режиме с начальной оптической плотностью 0,1 единица. Через десять суток накопительного культивирования выделен линейный участок на кривой роста, где плотность составила 0,293 ед.опт.пл., что соответствует 0,234 г/л органического вещества. Линия кривой роста (см. рис. 1.1) – область работы плотностата.
После перевода культуры микроводоросли на плотностатный режим выращивания (см. рис. 1.2) потребовалось трое суток для выведения культуры на стационарный режим, когда удельная скорость роста культуры постоянна. Удельная скорость роста составила 0,37 сут-1, а прирост 0,295 единиц оптической плотности в сутки. С пятых по седьмые сутки отбирались пробы для определения содержания углеводов в культуре тетраселмис. Среднее значение содержания суммарных углеводов для стационарного состояния (см. рис. 1.2) оставило 0,164 г/л.
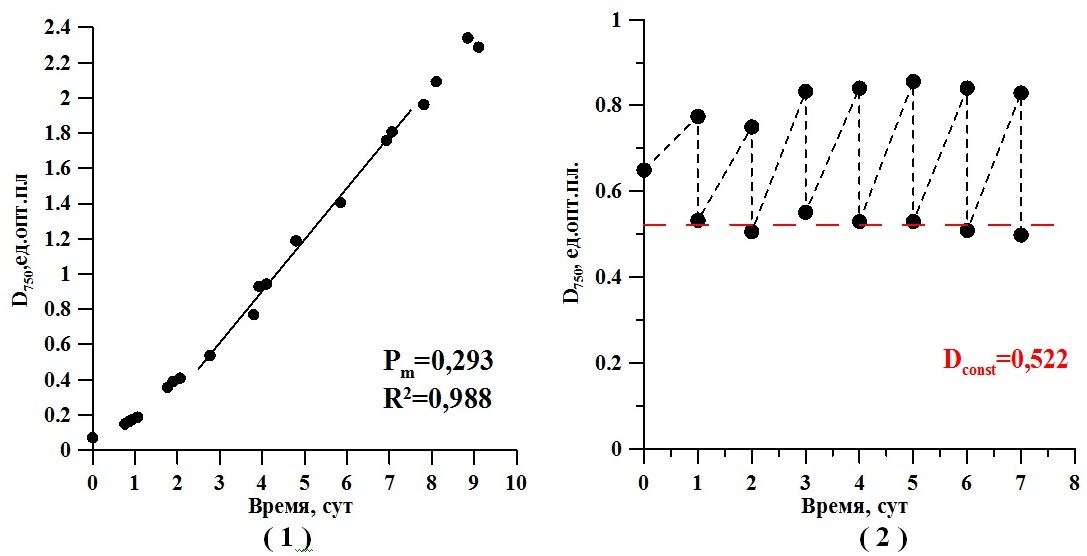
Рис. 1. Накопительная культура Teraselmis viridis. (1) Расчет продуктивности культуры в области работы плотностата; (2) Непрерывная культура микроводоросли при заданной стационарной плотности 0,522 единиц оптической плотности, измеренной при 750 нм
Fig. 1. The batch culture of Teraselmis viridis. (1) Calculation of productivity in the field of work density; (2) The continuous culture of microalgae at a given stationary density of 0.522 optical density units, measured at 750 nm
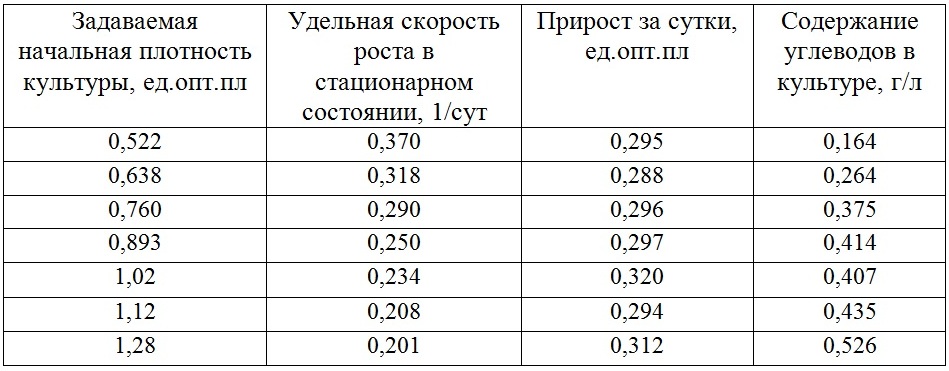
Последующие стационарные состояния плотностатного культивирования представлены в табл. 1. Для всех стационарных состояний характер кривых роста был аналогичен, как и для плотности 0,522 оптической единицы, представленной на рис. 1.2. Прирост, указанный в таблице, рассчитывался только после того, как культура стабилизировалась. Переходные состояния не учитывались. Свойство линейной фазы роста состоит в постоянстве скорости роста (продуктивности культуры, P = Pm = const). Как правило, на линейном участке скорость роста определяется величиной внешнего потока (света или углекислого газа), который полностью поглощается культурой и ограничивает продуктивность культуры в целом (Тренкеншу, 2005). Существует плотностатный режим, который позволяет зафиксировать необходимую плотность и наблюдать за ростовыми и биохимическими процессами. Применяя данный способ управления, можно моделировать изменяющиеся условия, которые происходят в накопительных культурах (Белянин и др., 1980). Полученные данные указывают на существование линейной фазы роста на S-образной кривой роста и подтверждают гипотезу о постоянстве продуктивности в линейной фазе роста культуры. Вероятно, изменяющиеся световые условия по-разному действуют на скорости синтеза биохимических составляющих, приводя в итоге к постоянству продукции биомассы. В последней колонке табл. 1 приведены средние значения содержания углеводов в плотностатной культуре микроводоросли, их количество изменялось от 0,164 до 0,526 г/л.
Таблица 1. Динамика ростовых и биохимических характеристик непрерывной культуры Teraselmis viridis.
Представлены усредненные значения для каждого стационарного состояния
Table 1. Dynamics of growth and biochemical characteristics of continuous culture Teraselmis viridis.
Averaged values for each constant state represented
На рис. 2 представлены суммарные углеводы за трое суток отбора в непрерывной культуре. Содержание углеводов при стационарной оптической плотности не постоянно по биохимическому показателю культуры и зависит от выбранной оптической плотности. Для диапазона плотностей культуры тетраселмис от 1 до 1,5 опт. единиц содержание углеводов в культуре не изменяется и колеблется в пределах от 0,3 до 0,4 г/л.
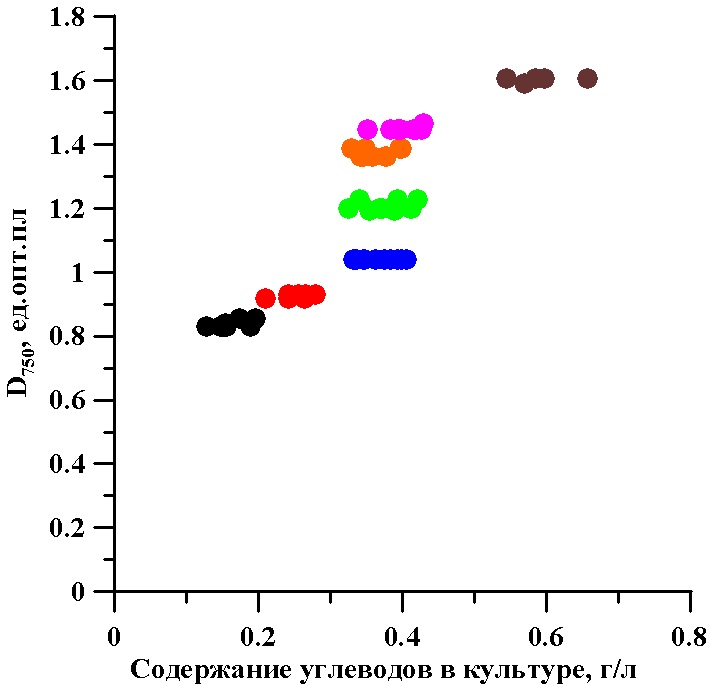
Рис. 2. Взаимосвязь оптической плотности (D750) и содержания суммарных углеводов в непрерывной культуре микроводоросли тетраселмис
Fig. 2. The relationship optical density (D750) and the total carbohydrate content in continuous culture of microalgae Tetraselmis
На рис. 3 показана зависимость удельной стационарной скорости роста культуры T. viridis от содержания общих углеводов в культуре. Со снижением удельной скорости роста культуры от 0,37 до 0,201 сут-1 содержание углеводов увеличивается с 0,164 до 0,526 г/л. Это указывает на опережающее снижение скорости деления клеток как реакции на уменьшение их пространственной облученности.
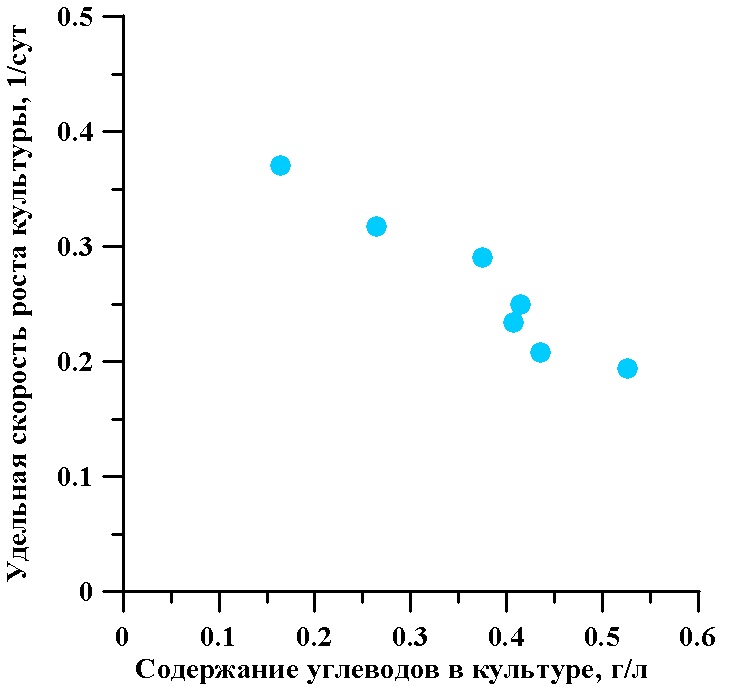
Рис. 3. Зависимость удельной стационарной скорости роста культуры от содержания суммарных углеводов в непрерывной культуре микроводоросли тетраселмис
Fig. 3. The dependence of the specific stationary growth rate of culture on the content of total carbohydrates in continuous culture of microalgae Tetraselmis
В работе (Тренкеншу, 1984) была приведена зависимость удельной скорости роста платимонаса в непрерывной культуре при стабилизации оптической плотности D680=0,369 ед.опт.пл. от поверхностной освещенности. В данной работе показано, что поверхностная освещенность, равная 55 Вт/м2, является насыщающей для культуры T. viridis. С учетом заданных условий эксперимента, рН, температура и минеральное обеспечение не лимитируют рост, а находятся в оптимальных для роста культуры концентрациях. Следовательно, можно предположить, что рост углеводов связан с «узким местом» ферментативных реакций. Ранее было показано, что для культур невысокой плотности в области насыщающих интенсивностей света увеличение освещенности не увеличивает скорость фотосинтеза (Белянин и др., 1980). При насыщающих интенсивностях происходит накопление углеводов.
Заключение
Изучение влияния средней пространственной освещенности на содержание полисахаридов в непрерывной культуре микроводоросли Тetraselmis viridis показало, что постоянство содержания полисахаридов в культуре наступает значительно позднее (более 7 дней), чем постоянство сухого вещества клеток микроводоросли. Данное явление необходимо учитывать в проведении экспериментов по изучению влияния факторов среды на содержание биохимических составляющих клеток микроводорослей в непрерывной культуре. Снижение средней облученности клеток при повышении оптической плотности приводит к уменьшению скорости деления клеток и накоплению продуктов фотосинтеза в виде полисахаридов.
Работа выполнена в рамках госзадания ФГБУН ИМБИ по теме «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации АААА-А18-118021350003-6).
Список литературы
- Белянин В.Н., Сидько Ф.Я., Тренкеншу А.П. Энергетика фотосинтезирующей культуры микроводорослей. – Новосибирск: Наука, 1980. – 136 с.
- Тренкеншу Р.П. Простейшие модели роста микроводорослей. 1. Периодическая культура // Экология моря. 2005. Вып.67. С. 89–97.
- Тренкеншу Р.П. Ростовые и фотоэнергетические характеристики морских микроводорослей в плотной культуре: Автореф. дис. канд. биол. наук. – Красноярск, 1984. – 28 с.
- Тренкеншу Р.П., Лелеков А.С., Боровков А.Б., Новикова Т.М. Унифицированная установка для лабораторных исследований микроводорослей// Вопросы современной альгологии. 2017. №1 (13). URL:http://algology.ru/1097 (дата обращения 1.11.2018)
- Kopytov Yu.P., Lelekov A.S., Gevorgiz R.G., Nekhoroshev M.V., Novikova T.M. The Method of Complex Determining of Biochemical Composition of Microalgae // International Journal on Algae. 2015. V.17, iss.4. P. 397–402. http://www.dl.begellhouse.com/ru/journals/7dd4467e7de5b7ef,4ed6f0d84b05d265,30335bfa07068b82.html
Статья поступила в редакцию 9.11.2018
.
Dynamics of polysaccharides in continuous culture Tetraselmis viridis
Tatyana M. Novikova
Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia)
The paper is compares the production characteristics Teraselmis viridis in continuous (namely density mode) and batch cultivation of microalgae. The values of total carbohydrates in the culture of microalgae for seven stationary conditions were obtained. Tetraselmis culture was irradiated with saturating intensity, which led to the growth of polysaccharides content in microalgae culture.
Key words: growth rate; productivity; continuous culture.
Об авторе
Новикова Татьяна Михайловна – Novikova Tatyana M.
младший научный сотрудник, Институт морских биологических исследований им. А.О.Ковалевского РАН, Севастополь, Россия (Kovalevsky Institute of Marine Biological Research of RAS, Russia, Sevastopol)
nowtanj@yandex.ru
Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ:
Новикова Т.М. Динамика полисахаридов в непрерывной культуре микроводоросли Тetraselmis viridis // Вопросы современной альгологии. 2018. № 3 (18). URL: http://algology.ru/1378
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Адрес - info@algology.ru
При перепечатке ссылка на сайт обязательна
На ГЛАВНУЮ
Карта сайта
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|

