|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VII Сабининские чтения 1 ноября - 25 декабря 2018 г. Влияние температуры на сезонную и межгодовую изменчивость некоторых структурно-функциональных характеристик фитопланктона прибрежных вод Черного моря (район Севастополя)
Стельмах Л.В. Lyudmyla V. Stelmakh
Институт морских биологических исследований им. А.О. Ковалевского РАН
УДК 574.583:581.132
Исследована сезонная и межгодовая изменчивость скорости роста и биомассы фитопланктона в прибрежных водах Черного моря у Севастополя. Характер сезонной динамики и амплитуда этих параметров практически совпадают. Повышение среднегодовых значений температуры воды вызывает изменения в видовой структуре фитопланктона, ходе его сезонной сукцессии, а также снижение среднегодовых значений удельной скорости роста и биомассы фитопланктона приблизительно в 2 раза. Ключевые слова:скорость роста фитопланктона; биомасса; Черное море; температура.
Введение Известно, что в Черном море в течение года соотношение между основными таксономическими группами фитопланктона претерпевает регулярную временную и пространственную изменчивость (Георгиева, 1993; Stelmakh, Georgieva, 2014; Финенко и др., 2017; Mikaelyan et al., 2017). Как и в других районах Мирового океана, последняя обусловлена, вероятно, совместным действием абиотических факторов среды и биотическими взаимодействиями в планктоне. При изменении параметров среды, прежде всего таких, как температура, свет, количество питательных веществ, а также при изменении скорости выедания фитопланктона зоопланктоном происходит перестройка таксономической и размерной структуры фитопланктона. В результате этого меняются функциональные параметры фитопланктонного сообщества, среди которых важнейшее значение имеет удельная скорость роста. Данный параметр в значительной мере определяет суммарную биомассу фитопланктона. Цель настоящей работы заключалась в оценке влияния температуры воды на сезонную межгодовую изменчивость удельной скорости роста фитопланктона и его биомассы на примере прибрежных вод Черного моря в районе Севастополя.
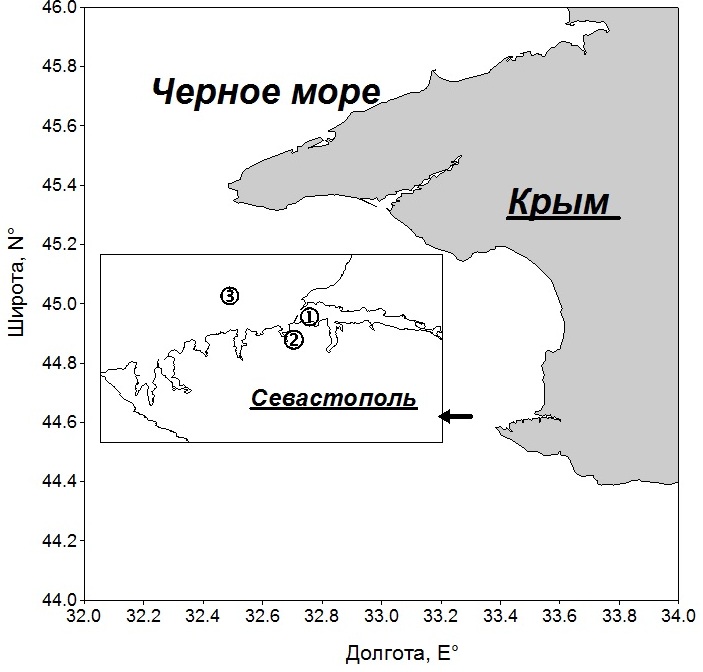
Материалы и методы Экспериментальные исследования были выполнены на трех станциях в прибрежных водах Черного моря в районе Севастополя в 2006–2007 и 2010 гг. (рис. 1). Общая глубина в большинстве случаев составляла 14–19 м. Только на станции 3 она достигла 50 м. Пробы воды объемом 14–15 л отбирали в поверхностном слое (0–1 м), как правило, один раз в месяц с 14 по17 число в утренние часы (8–10 ч).
Рис. 1. Схема станций: 1 – Севастопольская бухта, 2 – Карантинная бухта, 3 – открытое прибрежье Fig. 1. Station map: 1 – Sevastopol Bay, 2 – Quarantine Bay, 3 – open coastal area
Определение удельной скорости роста фитопланктона осуществляли с помощью метода разведения проб (Landry, Hassett, 1982). Метод основан на суточном приросте концентрации хлорофилла а в пробах с разным коэффициентом разведения. Для определения исходной концентрации хлорофилла часть исходной пробы (не более 2 л) фильтровали на стекловолокнистый фильтр марки GF/F (диаметр 25 мм) в двух повторностях, которые хранили в морозильной камере при -20ºС в течение 1–2 суток. Основную долю исходной воды (10–11 л) пропускали через нейлоновое сито с диаметром ячеи 200 мкм для удаления мезозоопланктона и делили на две части. С целью получения фильтрата, свободного от взвешенных частиц, первую часть исходной пробы (6–8 л) фильтровали на стекловолокнистый фильтр марки GF/F (диаметр 47 мм) при слабом давлении (≤ 0,05 атм.). Вторую часть исходной пробы разбавляли приготовленным фильтратом таким образом, чтобы получить серию проб с различным коэффициентом разведения (от 1,0 до 0,1) в двух повторностях. Подготовленную воду помещали в 1-литровые поликарбоновые бутыли, предварительно промытые 10%-ным раствором соляной кислоты и дистиллированной водой. Пробы экспонировали в течение суток в инкубаторе проточного типа, куда проникало 80% падающей солнечной радиации, что соответствовало световым условиям на глубине 0,5–1 м. Температура воды в инкубаторе отличалась от температуры воды в море не более, чем на 2°С. После экспозиции пробы фильтровали через стекловолокнистые фильтры Whatman GF/F или целлюлозные фильтры Sartorius с диаметром пор 0,45 мкм и площадью фильтра 47 мм. Полученные фильтры со взвесью хранили в морозильной камере при -20ºС в течение 1–2 суток. Для определения концентрации хлорофилла а во всех пробах фильтры помещали в раствор 90% ацетона. Экстрагирование пигментов осуществлялось в темноте при температуре 4ºС в течение 18 часов. После чего экстракты центрифугировали в течение 20 мин. Регистрацию флуоресценции ацетоновых экстрактов до и после подкисления 5%-ным раствором соляной кислоты осуществляли на лабораторном флуориметре, калибровку которого проводили по чистому хлорофиллу а фирмы Sigma Chemical Co. Концентрацию хлорофилла а рассчитывали по формуле, приведенной в (JGOFS Protocol, 1994), но с коэффициентом, рассчитанным для нашего флуориметра:
где Хл а – концентрация хлорофилла а, мг·м-3, Fo – флуоресценция ацетонового экстракта до подкисления, выраженная в вольтах (В), Fa – флуоресценция ацетонового экстракта после подкисления (В), Vol1 – объем ацетонового экстракта, мл, Vol2 – объем профильтрованной пробы, л. В экспериментах для каждого из шести разведений были выполнены расчеты удельной скорости роста фитопланктона, называемой условно в англоязычной литературе «видимой» скоростью роста (μв):
где Хл а0 – исходная концентрация хлорофилла а, мг·м-3, Хл аt –содержание хлорофилла через сутки. На основе полученных значений μв в каждом из выполненных экспериментов были рассчитаны уравнения линейной регрессии, отражающие зависимость μв от коэффициента разведения проб (КР):
где μ – «истинная» удельная скорость роста фитопланктона, сутки-1, g – удельная скорость выедания фитопланктона микрозоопланктоном, сутки-1. Во всех экспериментах коэффициент детерминации (R2) для этих зависимостей, отражающий степень их достоверности, был в диапазоне от 0,70 до 0,95, а F-критерий был выше критических значений при уровне значимости p ≤ 0,05. Стандартная ошибка коэффициентов уравнения (μ и g), была в диапазоне от ±5 до ±20%, а расчетные значения t-критерия Стьюдента были выше критических при уровне значимости p ≤ 0,05. Для определения видов водорослей в фитопланктоне пробы воды объемом 2–3 л сгущали в воронке обратной фильтрации на нуклеопоровых фильтрах с диаметром пор 1 мкм, как описано ранее (Стельмах и др., 2009). Пробы фиксировали 1% нейтрализованным формалином и приступали к обработке. Идентификацию видов водорослей, определение их численности и линейных размеров осуществляли в капле объемом 0,1 мл, помещенную в счетную камеру типа Нажотта, в 3-х повторностях под световым микроскопом ZEISS Primo Star. Средний объем клеток для отдельных видов водорослей определяли как отношение объема всех клеток к их численности. Подобным образом рассчитывали средний (средневзвешенный) объем клеток суммарного нано- и микрофитопланктона. Для перехода от сырой биомассы фитопланктона, именуемой в англоязычной литературе как «biovolume», выраженной в мг·м-3, к биомассе в углеродных единицах (мгС·м-3), использовали известные уравнения (Menden-Deuer, Lessard, 2000). Содержание нитратов измеряли путем восстановления их до нитритов омедненным кадмием с последующим определением единым «цветным реактивом», аммония – по Гроссгофу-Юхансену, фосфатов – по Морфи и Райли и силикатов – по голубому кремнемолибденовому комплексу (Сапожников, 1988). Суммарную за день солнечную радиацию рассчитывали на основе ее измерений каждый час в течение светлого времени суток с помощью люксметра Ю-116. Переходный коэффициент от освещенности в люксах к интенсивности солнечной радиации (ФАР) составлял 104 = 200 мкЭ·м-2·с-1 (Парсонс и др., 1982). При статистической обработке материалов применяли программу Exсel 2007 для Windows. Графики выполнялись с помощью программы Grapher 3.
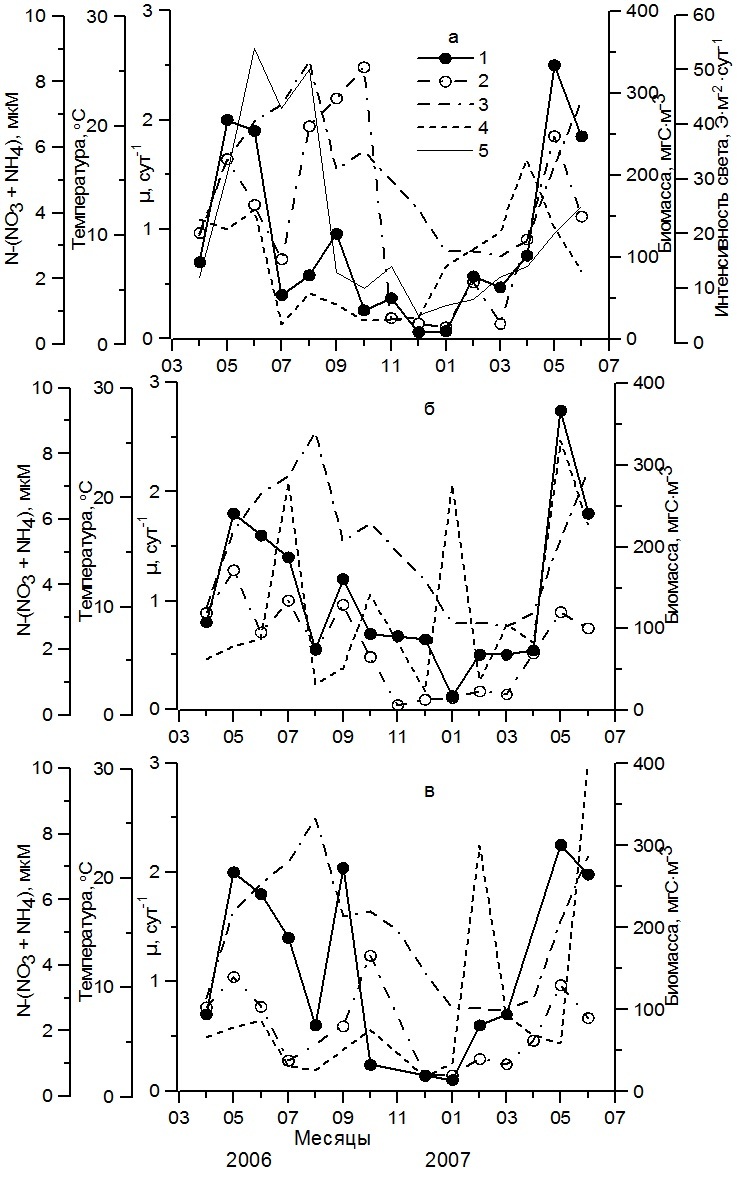
Результаты и обсуждение Исследования, выполненные в прибрежных водах Черного моря в районе Севастополя, показали, что «истинная» удельная скорость роста фитопланктона (далее удельная скорость роста фитопланктона) в поверхностном слое (0–1 м) подвержена четко выраженной сезонной изменчивости. Ее характер и амплитуда в разные годы были неодинаковы. Так, в 2006–2007 гг. сезонная динамика удельной скорости роста фитопланктона (µ) характеризовалась наличием двух четко выраженных максимумов (рис. 2). Первый максимум был отмечен в мае в период интенсивного развития диатомовых водорослей рода Chaetoceros при оптимальной для диатомовых водорослей температуре воды в поверхностном слое (16,3–17,0оС) и интенсивности солнечной радиации, достигающей поверхности моря, 35–40 Э·м-2·сутки-1. Содержание биогенных веществ, и прежде всего минеральных форм азота, было достаточно высоким, а поэтому не лимитировало рост водорослей (Стельмах и др., 2009). В это время на всех трех станциях значения µ фитопланктона различались слабо и составили в 2006 г. 1,80–2,00 сутки-1, а в 2007 г. достигли 2,30–2,75 сутки-1. Полученные значения скорости роста по времени совпадали с максимумами развития фитопланктона, в которых биомасса достигала на разных станциях 120–250 мгС·м-3. Наиболее высокие величины удельной скорости роста, полученные в мае 2007 г., обусловлены, вероятно, доминированием в фитопланктоне исключительно мелкого вида диатомовых водорослей Chaetoceros socialis H.S.Lauder. Этот вид имел объем клеток 150–250 мкм3 и создавал около 80% суммарной биомассы фитопланктона. Тогда как в мае 2006 г. его доля в суммарной биомассе водорослей составляла лишь 10%, а основную биомассу создавали более крупные виды водорослей рода Chaetoceros, у которых объем клеток был в 10–20 раз больше.
Рис. 2. Сезонная динамика удельной скорости роста фитопланктона (1), суммарной биомассы нано- и микрофитопланктона (2), температуры (3), суммарного содержания нитратов и аммония (4) в поверхностном слое вод, а также интенсивности солнечной радиации у поверхности моря (5) в Севастопольской бухте (ст. 1а), Карантинной бухте (ст. 2б) и в открытом прибрежье (ст. 3в) Fig. 2. Seasonal dynamics of specific phytoplankton growth rate (1), phytoplankton biomass (2), temperature (3), total content of nitrates and ammonium (4) in the surface layer of water, as well as the intensity of solar radiation at the sea surface (5 ) in the Sevastopol Bay (St. 1a), Quarantine Bay (St. 2б) and in the open coastal zone (St. 3в)
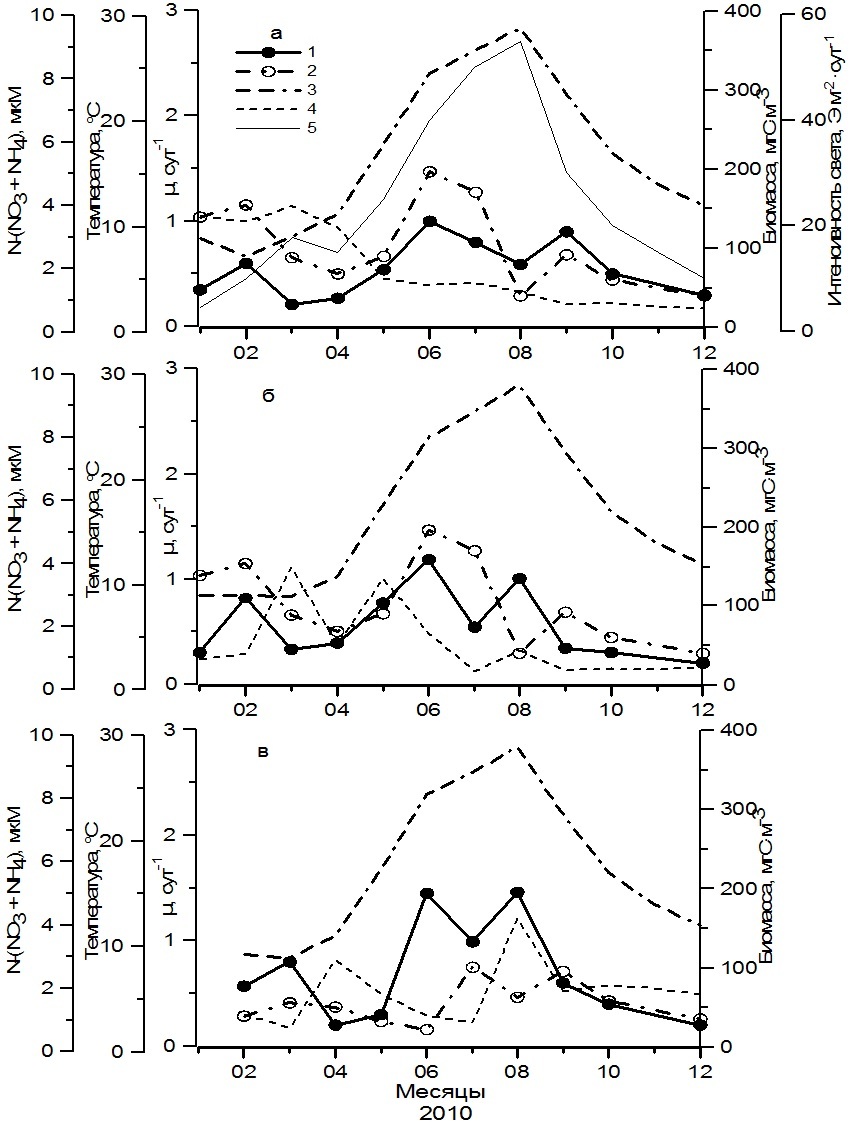
Начиная с июня 2006 г., когда температура воды достигла 20,4ºС, наблюдалась смена видов в фитопланктоне от весенних к летним, удельная скорость роста фитопланктона постепенно снижалась. В Севастопольской бухте она достигала минимума (0,40 сутки-1) в июле (рис. 2а). Тогда как в Карантинной бухте и в открытом прибрежье у Севастополя летний минимум (0,60 сутки-1) был зарегистрирован в августе (рис.2б). Снижение этого параметра сопровождалось падением биомассы водорослей до минимальных значений. В это время в фитопланктоне преобладали различные виды динофитовых водорослей и крупный вид диатомовых Coscinodiscus sp., а содержание биогенных веществ было существенно ниже, чем в мае. Так, суммарное содержание нитратов и аммония было ниже 0,9 мкМ (рис. 2). Концентрации фосфатов составляли менее 0,03 мкМ, тогда как концентрации кремния превышали 3 мкМ (Стельмах и др., 2009). Можно полагать, что летом недостаток азота или фосфора мог, вероятно, в некоторых случаях ограничивать рост водорослей. Второй максимум наблюдался в сентябре–октябре в сентябре–октябре 2006 г. и был связан с интенсивным развитием диатомовых водорослей рода Chaetoceros, а также Proboscia alata (Brightwell) Sundström, Pseudo-nitzschia delicatissima (Cleve) Heiden и Cerataulina pelagica (Cleve) Hendey. Температура воды составляла 16–17,7оС, интенсивность света у поверхности моря достигала 20–30 Э·м-2·сутки-1. Суммарное содержание нитратов и аммония в воде было выше 1,5 мкМ. Высокие значения отмечены для кремния (3–4 мкМ) и фосфатов (0,3–0,6 мкМ) (Стельмах и др., 2009). В Севастопольской и Карантинной бухтах (рис. 2а,б), где преобладали достаточно крупные виды P. alata и Dactyliosolen fragilissimus (Bergon) Hasle, удельная скорость роста в этот период достигала 1,00–1,20 сутки-1. Тогда как в открытом прибрежье, где доминировали более мелкие виды диатомовых водорослей P. delicatissima, Cerataulina pelagica (Cleve) Hendey и C. socialis, удельная скорость роста фитопланктона была приблизительно в 2 раза выше (рис. 2в). Как правило, максимумы удельной скорости роста совпадали с максимальными значениями биомассы фитопланктона, которые в наиболее изолированной от открытых вод Севастопольской бухте (ст. 1) достигали 330 мгС∙м-3. Тогда как в Карантинной бухте (ст. 2) и в открытом прибрежье (ст. 3), в большей мере подверженным сгонно-нагонным процессам водных масс, максимальные значения этого показателя не превышали 150–170 мгС∙м-3. Минимальные значения µ (0,10–0,20 сутки-1) были получены в декабре 2006 г. – январе 2007 г. Они наблюдались в период самых низких значений биомассы фитопланктона, в котором преобладали динофитовые водоросли Prorocentrum cordatum (Ostf.) Dodge, Prorocentrum micans Ehrenberg, Prorocentrum lima (Ehrenberg) Stein, Prorocentrum compressum (Bailey) Dodge и Scrippsiella trochoidea (Stein) Balech., а также некоторые виды диатомовых водорослей (Skeletonema costatum (Greville) Cleve, Chaetoceros curvisetus Cleve, C. socialis). В это время отмечены, как правило, нулевые концентрации нитратов и аммония, кремния и фосфатов в воде, а также самые низкие значения интенсивности солнечной радиации, достигающей поверхности моря (около 4 Э·м-2·сутки-1). Температура воды составляла около 10°С. В 2010 г., который отличался более высокими значениями температуры воды по сравнению с 2006–2007 гг., на всей исследованной акватории в фитопланктоне по биомассе преобладали в основном динофитовые виды водорослей, температурный оптимум у которых на несколько градусов выше, чем у диатомовых (Стельмах и др., 2014). Среди них, как правило, были представлены P. cordatum, P. micans, P. compressum, S. trochoidea, Gyrodiniym fusiforme Kofoid&Swezy, а также представители рода Gymnodinium. И только в феврале–марте на станциях, расположенных в районе Севастополя, от 50 до 95% биомассы фитопланктона создавали диатомовые водоросли, прежде всего S. costatum, а также C. socialis C. curvisetus, P. delicatissima. Доминирование динофитовых водорослей в фитопланктоне в течение большей части 2010 г. было, вероятно, одной из основных причин изменений в сезонной динамике удельной скорости роста. Эти изменения отразились на ее амплитуде, количестве максимумов в течение года и времени их наступления, а также на значениях удельной скорости роста в максимумах. Как видно, в 2010 г. удельная скорость роста фитопланктона в районе Севастополя достигала максимальных значений трижды (рис. 3). Первый максимум удельной скорости роста был достигнут в Севастопольской и Карантинной бухтах в феврале, а в открытом прибрежье – в марте. Он был связан с интенсивным развитием диатомовых водорослей, прежде всего S. costatum. Значения удельной скорости роста в первом максимуме в условиях зимней температуры (7–10ºС) составляли 0,60–0,80 сутки-1. Через месяц наблюдалось снижение этого показателя до минимальных значений, составивших 0,20–0,30 сутки-1. Уже в мае, когда температура воды прогрелась до 18ºС, что существенно выше, чем в предыдущий год, основную биомассу создавали динофитовые водоросли, скорость роста которых достигла максимума (1,00–1,40 сутки-1) лишь в июне при температуре 24,0–24,6ºС. Третий максимум (0,90–1,40 сутки-1) был зарегистрирован либо в августе, либо в сентябре при температуре воды 28,9ºС и 22,6ºС соответственно (рис. 3). В течение всего этого времени в фитопланктоне наблюдалось преобладание динофитовых водорослей, а полученные величины удельной скорости роста были близки к максимальным значениям, выявленным для динофитовых водорослей в культурах (Мансурова, 2013). На этом основании можно заключить, что в периоды наиболее интенсивного роста динофитовых водорослей в исследованных прибрежных водах биогены, вероятно, не лимитировали их развитие. В пользу такого заключения свидетельствуют достаточно высокие концентрации минеральных форм азота и фосфатов в воде в это время. Так, общее содержание нитратов и аммония составляло 1,1–3,5 мкМ (рис. 3), а фосфатов 0,2–0,6 мкМ (Стельмах и др., 2010). Однако более низкие значения удельной скорости роста динофитовых водорослей по сравнению с диатомовыми видами стали, вероятно, основной причиной снижения биомассы фитопланктона, которая даже в максимумах не превышала 200 мгС×м-3 в бухтах (ст. 1, 2) и 100 мгС×м-3 в открытом прибрежье (ст. 3). Минимальные значения µ (0,20–0,30 сутки-1) в 2010 г. наблюдались весной в марте – апреле, а также зимой в декабре. Весной содержание минеральных форм азота в воде было достаточно высоким и составляло более 2 мкМ. Достаточно высокие концентрации биогенных веществ в воде получены также и в декабре. Вероятно, что снижение удельной скорости роста фитопланктона в это время не связано с содержанием биогенных веществ, а обусловлено преобладанием в фитопланктоне динофитовых водорослей, которые в условиях низкой температуры не могли расти более интенсивно. Температура, при которой наблюдается максимальный рост в культурах динофитовых водорослей, выделенных из планктона Черного моря, составляет, как правило, 22–25ºС (Стельмах и др., 2014).
Рис. 3. Сезонная динамика удельной скорости роста фитопланктона (1), суммарной биомассы нано- и микрофитопланктона (2), температуры (3), суммарного содержания нитратов и аммония (4) в поверхностном слое вод, а также интенсивности солнечной радиации у поверхности моря (5) в Севастопольской бухте (ст. 1, а), Карантинной бухте (ст.2, б) и в открытом прибрежье (ст. 3, в) в 2010 г. Fig. 3. Seasonal dynamics of specific phytoplankton growth rate (1), phytoplankton biomass (2), temperature (3), total content of nitrates and ammonium (4) in the surface layer of water, as well as the intensity of solar radiation at the sea surface (5 ) in the Sevastopol Bay (St. 1, a), Quarantine Bay (St. 2, б) and in the open coastal zone (St. 3, в) in 2010
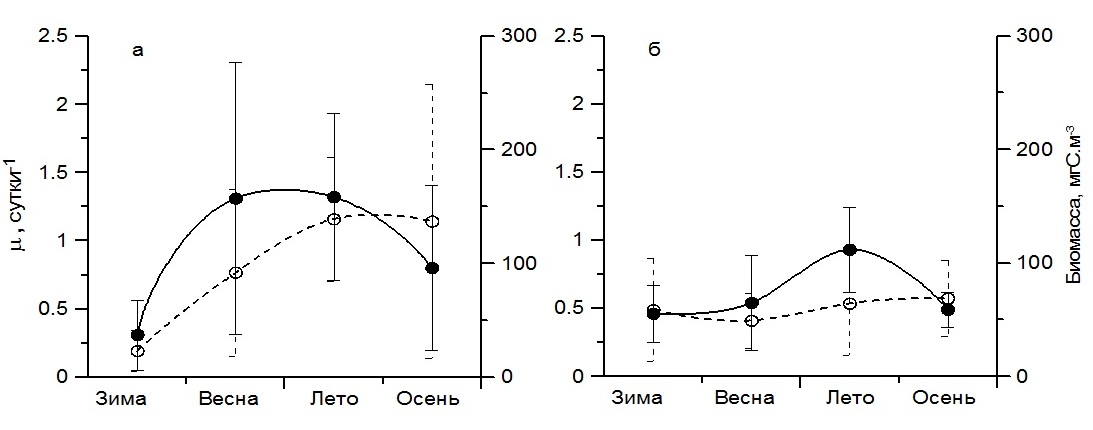
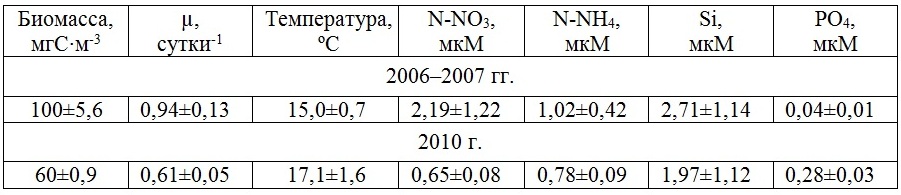
Сопоставление минимальных и максимальных значений удельной скорости роста фитопланктона, полученных в поверхностном слое моря в районе Севастополя, показало снижение амплитуды сезонной изменчивости данного параметра в 2010 г. Минимальные и максимальные значения µ различались в 4–7 раз. Тогда как в 2006–2007 гг., в период доминирования диатомовых видов водорослей, различия между минимальными и максимальными значениями достигали 20 раз. Выявлены различия и в средних для сезонов величинах данного параметра. Весной и летом 2006–2007 гг. они составили 1,31 (±1,00) сутки-1 и 1,32 (±0,60) сутки-1, а осенью – 0,80 (±0,60) сутки-1, тогда как в 2010 г. были приблизительно в 1,5–2,5 раза ниже (рис. 4). Это отразилось на величине суммарной биомассы фитопланктона, которая в 2006–2007 гг. для весеннего и летнего периодов составляла в среднем 150 мгС·м-3, а для осеннего – 100 мгС·м-3. В 2010 г. этот показатель снизился в 1,5–2 раза. В зимний период средние значения удельной скорости роста фитопланктона были минимальными, составив 0,31 (±0,26) сутки-1 в 2006–2007 гг. и 0,46 (±0,21) сутки-1 в 2010 г. Это явилось причиной низкой его биомассы, средние значения которой были равны 23 (±18) и 58 (±45) мгС·м-3 соответственно. Среднегодовое значение биомассы фитопланктона в 2006–2007 гг. составило 100 мгС·м-3, а удельной скорости роста – 0,94 сутки-1, тогда как в 2010 г. эти показатели были приблизительно в 1,6 раза ниже (табл. 1). Это обусловлено в основном преобладанием в фитопланктоне динофитовых водорослей в течение большей части года в результате повышения температуры воды. Ее среднегодовое значение в 2010 г. составило 17,1ºС, что на 2 градуса выше относительно 2006–2007 гг. Снижению биомассы фитопланктона в 2010 г. по сравнению с 2006–2007 гг. способствовали, вероятно, высокая степень стратификации водной толщи в теплый период года и в результате более низкие концентрации биогенных веществ в воде, прежде всего, азотных соединений. Так, среднегодовое содержание нитратов в 2006—2007 гг. составило 2,19 мкМ, а аммония – 0,69 мкМ. Тогда как в 2010 г. эти показатели были в 3,4 и в 1,3 раза ниже соответственно. Таким образом, полученные в исследованных прибрежных водах Черного моря результаты показали, что температура воды оказывает существенное влияние на ход сезонной сукцессии фитопланктона.
Рис. 4. Удельная скорость роста (сплошная линия) и суммарная биомасса фитопланктона (пунктир) в различные сезоны 2006–2007 гг. (а) и 2010 г. (б) в поверхностном слое прибрежных вод Черного моря; вертикальные линии на графиках – стандартное отклонение Fig. 4. Specific growth rate (solid line) and total phytoplankton biomass (dotted line) in different seasons of 2006–2007 (a) and 2010 (b) in the surface layer of the coastal waters of the Black Sea; vertical lines on the graphs – standard deviation
Таблица 1. Среднегодовые значения и стандартная ошибка биомассы, удельной скорости роста фитопланктона (µ) и некоторых абиотических параметров в прибрежных поверхностных водах Черного моря у Севастополя Table 1. Average annual values and standard error of biomass, specific growth rate of phytoplankton (µ) and some abiotic parameters in the coastal surface waters of the Black Sea near Sevastopol
Заключение Исследована сезонная и межгодовая изменчивость скорости роста и биомассы фитопланктона в прибрежных водах Черного моря у Севастополя. Характер сезонной динамики и амплитуда этих параметров в течение одного года практически совпадают. Повышение среднегодовых значений температуры воды вызывает усиление стратификации водной толщи в теплый период года, снижение содержания биогенных веществ в воде и изменения в видовой и таксономической структуре фитопланктона, которые проявляются в преобладании динофитовых водорослей в течение большей части года. Это приводит к изменению хода сезонной сукцессии фитопланктона, а также снижению его среднегодовых значений удельной скорости роста и биомассы приблизительно в 2 раза.
Благодарности. Автор выражает искреннюю благодарность Бабич И.М. и Родионовой Н.Ю. за помощь в выполнении работы. Автор заявляет об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена в рамках проекта РАН «Влияние физико-химических процессов на смену видового состава и продуктивность морского фитопланктона» (№ АААА-А18-118020790209-9) и государственного задания по направлению «Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом» (№ AAAA-A18-118021490093-4).
Список литературы
Статья поступила в редакцию 13.12.2018
Об авторе Стельмах Людмила Васильевна – Stelmakh Lyudmyla V. доктор биологических наук lustelm@mail.ru Корреспондентский адрес: 299011 г. Севастополь, пр. Нахимова, 2, Институт биологии южных морей им. А.О. Ковалевского; тел.: +7 (8692) 55-09-44.
ССЫЛКА НА СТАТЬЮ: Стельмах Л.В. Влияние температуры на сезонную и межгодовую изменчивость некоторых структурно-функциональных характеристик фитопланктона прибрежных вод Черного моря (район Севастополя) // Вопросы современной альгологии. 2019. № 1 (19). С. 46–56. URL: http://algology.ru/1426 DOI - https://doi.org/10.33624/2311-0147-2019-1(19)-46-56 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
The influence of temperature on seasonal and inter-annual variability of some structural and functional characteristics of the phytoplankton in coastal waters of the Black Sea (Sevastopol region) Lyudmyla V. Stelmakh Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia The seasonal and inter-annual variability of the phytoplankton growth rate and biomass in the coastal waters of the Black Sea near Sevastopol was studied. The nature of the seasonal dynamics and the amplitude of these parameters almost coincide. An increase in the average annual values of water temperature causes changes in the species structure of phytoplankton, its seasonal succession, and a decrease in the average annual values of the specific growth rate and phytoplankton biomass by about 2 times. Key words: phytoplankton growth rate; biomass; the Black Sea; temperature. References
Author Stelmakh Lyudmyla V. ORCID - https://orcid.org/0000-0003-2970-0281 Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia lustelm@mail.ru Stelmakh L.V. The influence of temperature on seasonal and inter-annual variability of some structural and functional characteristics of the phytoplankton in coastal waters of the Black Sea (Sevastopol region). Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 1 (19). P.46–56. URL: http://algology.ru/1426 DOI - https://doi.org/10.33624/2311-0147-2019-1(19)-46-56
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||||||||
|
| ||||||||