|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VIII Сабининские чтения 10 ноября 2019 - 29 февраля 2020 Макрофлора прибрежной акватории западной части Гераклейского полуострова и ее внутригодовая динамика (мыс Херсонес, Черное море)
Евстигнеева И.К., Танковская И.Н. Irina K. Evstigneeva, Irina N. Tankovskaya
Федеральный исследовательский центр
УДК 258.5 271/3+581.9(26)
Описаны видовой и экологический состав, встречаемость видов, количественные характеристики и особенности внутригодовой изменчивости макрофитобентоса в прибрежной акватории мыса Херсонес на западе Гераклейского полуострова. Выявлен 71 вид макроводорослей 46 родов Chlorophyta, Ochrophyta и Rhodophyta. Основой таксономического разнообразия являются Rhodophyta, а экологического – морские, ведущие, олигосапробные и однолетние виды. На основе изучения разногодичных состояний макрофитобентоса в 2004 и 2014 годах были определены его лабильные и константные черты. Ключевые слова: макрофитобентос; эколого-таксономический состав; встречаемость; фитомасса; доминанты; изменчивость; мыс Херсонес; Черное море
Введение Мыс Херсонес расположен на западе Гераклейского полуострова и является крайней западной точкой города Севастополя и южной части Крымского полуострова. В районе мыса берег абразионный, со скалистым бенчем и небольшими примкнувшими «карманными» пляжами, сложенными песком и галькой. Для этого района характерна высокая степень хозяйственной освоенности и незначительная роль рекреации (Игнатов и др., 2014). По спутниковым данным, в прибрежных водах между мысами Херсонес и Фиолент неоднократно отмечались поверхностные аномалии температуры и солености, а также пятна неизвестного происхождения, которые могли возникнуть под действием как природных (апвеллинг), так и антропогенных (сброс сточных вод) факторов. Это утверждение вполне обоснованно, поскольку в описываемом районе действуют выпуски стоков от близлежащих жилых массивов (механическая очистка) и в прилегающей бухте Голубая (неочищенные при поломке КОС «Южные») (Грузинов и др., 2019). Малая скорость в месте выпуска и отсутствие существенной стратификации могут обусловить подъем загрязненных вод на поверхность, в т. ч. вблизи берега. Существует мнение, что выход на поверхность загрязненных сточных вод может быть связан с особенностями формирования сезонного термоклина в исследуемой акватории, не следует исключать и возможность повреждения магистрали канализационного сброса сточных вод (Совга и др., 2017). Помимо этого, акватория, прилегающая к мысу Херсонес, подвержена влиянию чрезвычайно интенсивной ветро-волновой деятельности. Мыс выдается далеко в море, при этом сектор обзора открытого моря составляет 270º (Евстигнеев и др., 2017). Следует предположить, что выявленные аномалии ряда гидрохимических параметров, интенсивный ветро-волновой режим могут оказывать влияние на экологическое состояние прибрежной акватории мыса Херсонес и ее биоты. Важной составной частью такой биоты, существующей в сложившихся экологических условиях, являются сообщества макроводорослей, которые время от времени привлекали внимание морских гидроботаников. В результате их исследований была дана оценка современного состояния ресурсов донной растительности на четырех участках прибрежной зоны Гераклейского полуострова между мысами Херсонес и Балаклавский (Миронова и др., 2007; Мильчакова, 2003). При постановке цели работы были учтены следующие суждения. Во-первых, знания о бентосных водорослях некоторых регионов черноморского прибрежья до сих пор отсутствуют или недостаточны, чтобы делать широкие обобщения, касающиеся экосистемного, ландшафтного и промышленно-хозяйственного потенциалов прибрежных сообществ. В таком случае особо полезными могут оказаться многолетние регулярные наблюдения за состоянием макрофитобентоса на выбранном для исследований участке прибрежной зоны. Во-вторых, мы исходили из того, что экосистема и входящие в нее сообщества приспособлены к сезонным и внутригодовым изменениям внешней среды, а возникающие при этом флуктуации характеристик биосистемы относительно их средних значений могут отражать ее устойчивость (Алимов, 2017). Однако стрессовые воздействия на экосистемы, такие как антропогенное эвтрофирование или загрязнение среды, могут вызвать изменения, способные повлиять на устойчивость сообщества. Поэтому возникла необходимость проведения сравнительного анализа результатов круглогодичных наблюдений за состоянием макрофитобентоса в районе мыса Херсонес в 2004 и 2014 гг. Цель данной работы – изучить эколого-флористическое разнообразие фитобентоса и особенности количественного развития массовых видов, сапробных и галобных экологических групп в прибрежной акватории мыса Херсонес в разные годы.
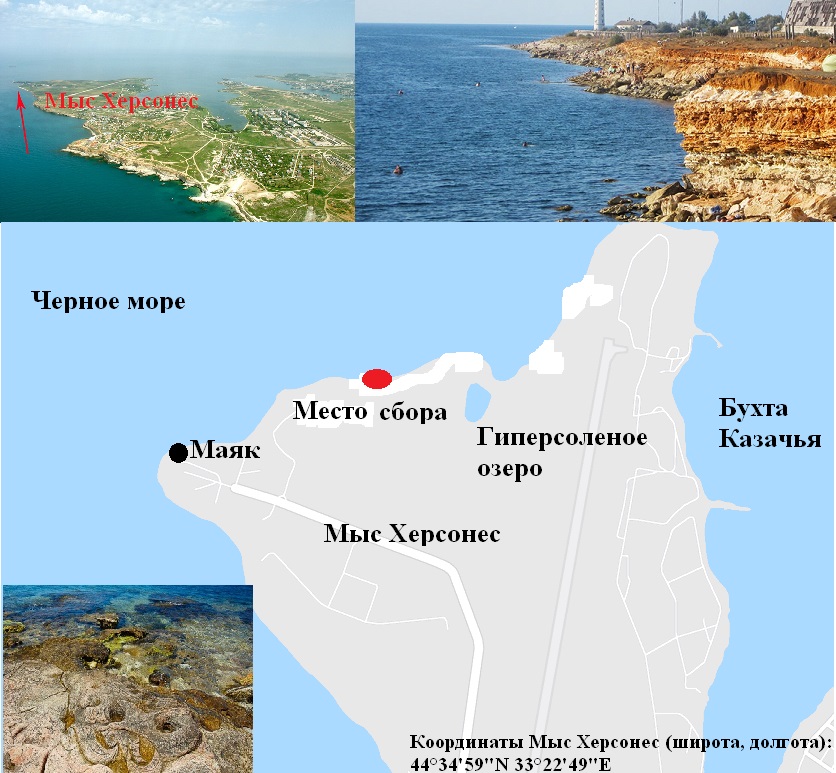
Материалы и методы Пробы фитобентоса отбирали в 2004 и 2014 гг. на глубине до 0,5 м на одном и том же участке берега у мыса Херсонес, раз в месяц, вручную, методом пробных площадок (Калугина-Гутник, 1969) (рис. 1). Для ограничения пробной площадки применяли квадратную металлическую рамку со стороной в 25 см. Каждый месяц отбирали по 4 количественных и 1 качественной пробе, общее число проб составило 120. При обработке материала определяли видовой состав макроводорослей с учетом последних номенклатурных изменений, а также экологический (Зинова, 1969; Калугина-Гутник, 1975; Guiry et Guiry, 2019). Для характеристики структуры сообщества применяли коэффициенты встречаемости видов (R, %) и флористического сходства по Жаккару (Kj, %), а также «пропорции флоры» (Толмачев, 1986; Миркин и др., 1989). Исходя из значений R, виды распределяли по группам постоянства (постоянная, добавочная, случайная) и ценотической активности (неактивные, мало-, средне-, высоко- и особо активные виды) (Dajor, 1972; Юрцев, 1968). На основе данных об индивидуальной фитомассе рассчитывали индекс Шеннона (Н) и доминирования видов (Dt, %), определяли группы доминантов и содоминантов, а для коррекции списка господствующих видов применяли шкалу Е.Л. Любарского, учитывающую величину относительной фитомассы и позволяющей выявить малозначимые, второстепенные, субдоминантные и доминантные компоненты системы продукционного доминирования (Wilhm, 1968; Баканов, 2005). Для описания структуры прибрежного сообщества применяли индексы гомотонности (J1 и J2) и Фельдманна, коэффициенты Чейни, Дрессшера и Марка (Feldmann, 1937; Cheney, 1977; Dressecher, Mark, 1980). Для выявления особенностей внутригодовой изменчивости видового состава экологических групп и их фитомассы применяли данные, полученные для сапробных и галобных групп как индикаторов органического загрязнения и распреснения водной среды.
Рис. 1. Район исследований и внешний облик участка морского берега Fig. 1. The research area and the appearance of the coastal area
Для определения степени изменчивости характеристик макрофитобентоса определяли лимиты и размах их вариации, а по шкале Г.Н. Зайцева, основанной на учете величины коэффициента вариации (Сv, %), оценивали тип изменчивости признаков («верхне»- и «нижненормальный», «значительный», «большой», «очень большой», «аномально высокий») (Зайцев, 1990). Помимо этого, для каждого из двух массивов данных альгологических съемок в 2004 и 2014 гг. были составлены отдельные выборки значений числа видов и фитомассы в сообществе и входящих в его состав отделов водорослей. Для этих выборок выполнили проверку статистической гипотезы о значимости различий между выборочными средними на основе стандартного t-критерия в предположении, что сравниваемые выборки извлечены из одной и той же генеральной совокупности с неизвестной дисперсией (Зверев, Зефиров, 2013).
Результаты и обсуждение В районе гидроботанических исследований в 2004 и 2014 гг. всего был обнаружен 71 вид макроводорослей 46 родов класса Ulvophyceae отдела Chlorophyta (Ch), класса Phaeophyceae отдела Ochrophyta (Och), классов Florideophyceae, Compsopogonophyceae и Bangiophyceae отдела Rhodophyta (Rh). 56% видов и примерно столько же родов приходилось на долю Rh, остальные отделы были представлены равной долей (таблица). Среди родов таксономически значимыми были Ulva, Cladophora, Vertebrata, Ceramium и Polysiphonia, объединившие в своем составе 23 вида, или треть видового состава. Такое локальное распределение видов по родам и отделам типично для всего черноморского фитобентоса (Калугина-Гутник, 1975). Количественное соотношение видов красных и бурых водорослей (индекс Фельдманна) численно равно 2,5, что свидетельствует о формировании в зоне исследований субтропической флоры. Таблица. Видовой состав и экологическая характеристика водорослей в акватории мыса Херсонес
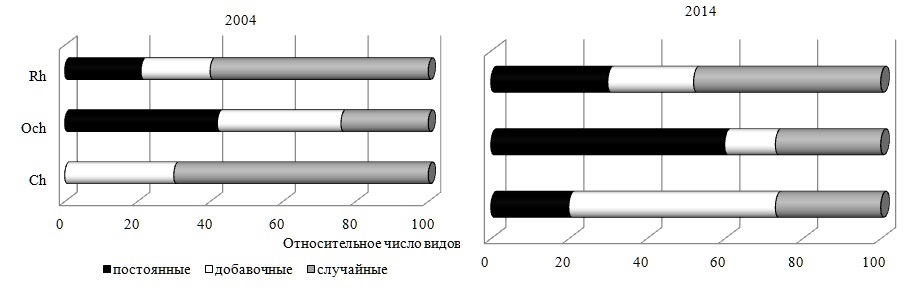
Макроводоросли прибрежной акватории мыса Херсонес относились к 12 экологическим группам из 13 известных для макрофитобентоса Черного моря. 46–64% таких видов входили в состав морской, ведущей, однолетней и олигосапробной групп. Выявленный локальный характер распределения видов между экогруппами соответствовал региональному, то есть в масштабах Черного моря. Каждый отдел проявлял отличие как на уровне комбинаций базовых экогрупп, так и по степени полночленности своих экоспектров. Экоспектр Ch включал виды всех идентифицированных групп, у Rh он был редуцирован за счет солоноватоводной группы, а у Och – однолетней. Наиболее сходными между собой были экоспектры бурых и красных водорослей. Отличительной особенностью Ch являлось господство солоноватоводно-морских и однолетних видов, примерно равное развитие всех сапробных групп и групп водорослей с разной продолжительностью жизни. Состояние макрофитобентоса и его внутригодовая динамика в 2004 г. В этот период макрофитобентос состоял из 58 видов 34 родов трех отделов. Высоким вкладом в видовое и родовое разнообразие отличался Rh. Другие отделы включали примерно равное число видов, однако разнообразие родов выводило Och на вторую позицию. Индекс Фельдманна достигал 2,75, что соответствовало субстропическому характеру прибрежной флоры. Спектр наиболее значимых родов включал Ulva, Cladophora, Vertebrata, Ceramium и Polysiphonia, объединивших в себе 38% всего видового состава в текущем году. Пропорция «вид : род» численно равнялась 1,7, а видовое соотношение отделов выглядело как 1 Ch : 1 Och : 3 Rh. В течение года бурые и красные водоросли неизменно входили в состав фитобентоса, зеленые же водоросли отсутствовали в апреле и декабре. Коэффициент встречаемости видов R варьировал широко (8–100%) с максимумом у Cystoseira crinita. Среднее значение встречаемости всех видов достигало 31%. В порядке уменьшения этого показателя отделы можно было расположить в следующем порядке: Och>Rh>Ch. Из всех видов, помимо цистозиры, восемь имели не максимальный, но достаточно высокий уровень встречаемости. Все они относились к бурым и красным водорослям. В зависимости от величины коэффициента R виды можно было разделить на постоянные, добавочные и случайные. Случайные виды, обладающие низкой встречаемостью, составляли 55%, виды же других категорий были представлены примерно поровну (рис. 2). Среди зеленых водорослей не было постоянных видов, а наибольшее развитие получали случайные. У красных водорослей постоянные и добавочные виды многократно уступали случайным. У бурых водорослей все группы были представлены примерно одинаково.
Рис. 2. Доля видов разных отделов в группах постоянства Fig. 2. The fraction of species of different departments in the groups of constancy
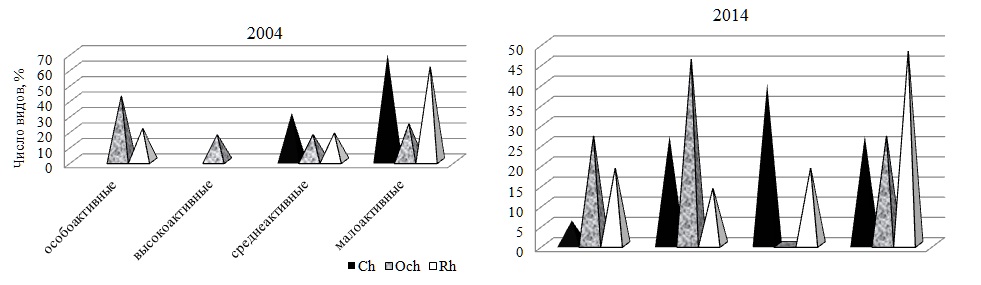
На основе данных о встречаемости видов в течение 2004 г. были рассчитаны индексы гомотонности структуры фитоценоза J1 и J2 . Их величины (0,9 и 1,6,) свидетельствовали о выраженной внутригодовой неоднородности изучаемого сообщества. Этот же показатель позволяет в той или иной мере судить о ценотической активности видов в прибрежных сообществах мыса. В соответствии со шкалой (Юрцев, 1968) фитобентос в районе исследований состоял из особо-, высоко-, средне- и преобладающих малоактивных видов (рис. 3). Виды, наиболее часто встречающиеся в течение 2004 г., составляли пятую часть общего состава. К особо активным видам (R равен или более 75%) относились Dictyota fasciola, Cystoseira barbata, C. crinita, Cladostephus spongiosus f. verticillatus, Sphacelaria cirrosa, Callithamnion corymbosum, Palisada perforatа, Ceramium virgatum, C. diaphanum, C. ciliatum, Vertebrata subulifera и Laurencia coronopus. Многие из них известны как руководящие черноморские виды морской и олигосапробной принадлежности. Каждый отдел характеризовался своим соотношением групп ценотической активности видов. Ch отличался преобладанием малоактивных видов и отсутствием видов с низкой и высокой встречаемостью. Среди Och, наоборот, господствовали особо активные виды и в равной мере были представлены высоко- и среднеактивные, свидетельствуя тем самым о малой подверженности видового состава отдела внутригодовым флуктуациям. Среди Rh было много малоактивных видов и не встречались высокоактивные.
Рис. 3. Доля видов разных отделов в группах активности Fig. 3. The fraction of species of different departments in the groups of activity
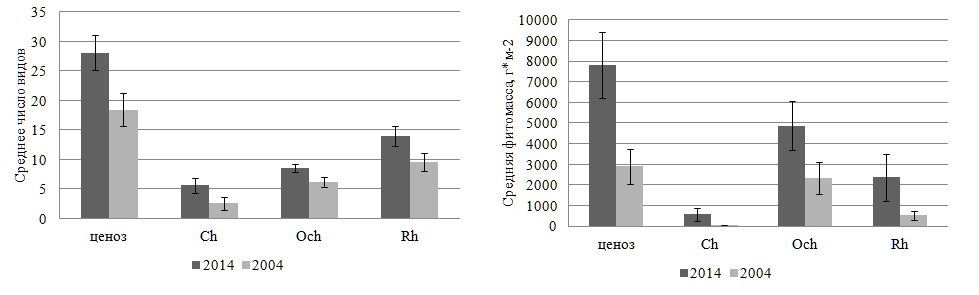
Общее число видов в фитоценозе в течение года колебалось от 11 в ноябре до 27 в апреле, составляя в среднем 18±3 (рис. 4). Кривая изменений абсолютного числа видов по месяцам была одновершинной, а сами вариации по шкале Г.Н. Зайцева не превышали биологическую «норму». Видовое преимущество красных водорослей сохранялось весь год, особенно в его первую половину и в последние два месяца. В остальное время отдел продолжал доминировать, но уже совместно с бурыми водорослями. Ход внутригодовой динамики абсолютного числа видов Rh и всего сообщества совпадал, что свидетельствовало о высокой роли красных водорослей в сложении таксономического состава прибрежного сообщества. Внутригодовые изменения видового состава Och происходили в менее интенсивной форме, чему соответствовало невысокое значение коэффициента вариации. Вначале Och и Ch испытывали изменения идентичной направленности, но уже в июле наблюдался положительный пик развития видовой структуры зеленых водорослей, в дальнейшем сменяющийся понижением числа видов вплоть до нуля в конце года.
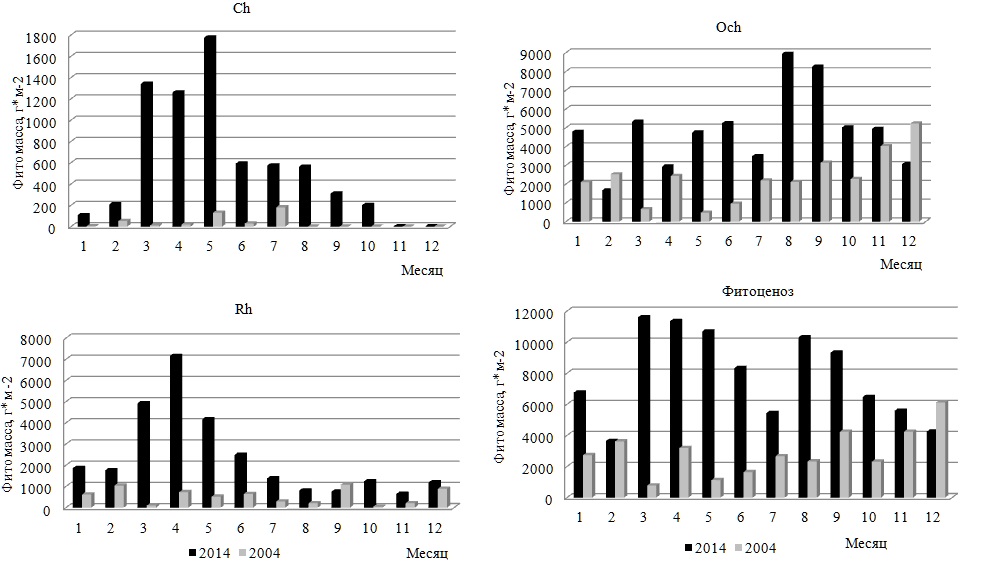
Рис. 4. Показатели внутригодовой изменчивости абсолютного числа видов и фитомассы Fig. 4. Indices of intra-annual variability of the absolute number of species and phytomass
Экологический анализ показал, что в состав макрофитобентоса в районе мыса Херсонес в 2004 г. входили виды 12 экогрупп. Более половины видов относились к морским, ведущим, однолетним и олигосапробным водорослям, вторая позиция принадлежала солоноватоводно-морским, редким, мезосапробным, многолетним и сезонным. Остальные группы объединяли 3–14% всех видов в текущем году. Экоспектры Och, Ch и всего фитоценоза были полночленными, а среди Rh отсутствовали представители солоноватоводной группы. Och и Rh проявляли высокое сходство перечня базовых групп, который у Ch, в отличие от этих отделов, вместо морской и олигосапробной групп содержал солоноватоводно-морскую и мезосапробную, а также все группы с разной продолжительностью жизни. Рассмотрим особенности внутригодовых изменений видового состава групп разной сапробности и галобности. В течение года в сапробной части экоспектра фитоценоза по абсолютному числу видов доминировала олигосапробная группа с максимумом показателя в августе и минимумом в декабре и январе. По шкале Г.Н. Зайцева внутригодовые преобразования в этой группе соответствовали «верхней» норме. Абсолютное число мезосапробионтов достигало максимума в марте и апреле, а его среднее значение было вдвое ниже, чем у олигосапробионтов. Видовой состав группы менялся по «значительному» типу. В такой же мере варьировало и абсолютное число полисапробных видов с достижением своего пика в конце зимы и в начале весны. В целом, временем проявления максимума видового разнообразия олигосапробионтов следует считать лето, а остальных групп – зимне-весенний период. Внутригодовая изменчивость числа видов доминирующей сапробной группы осуществлялась в пределах биологической «нормы», у других групп – с ее превышением. Среди галобных групп морская господствовала по числу видов большую часть года, кроме декабря, января и марта. В остальное время наряду с ней доминировали и солоноватоводно-морские водоросли. Обе группы проявляли 100%-ную встречаемость, тогда как у солоноватоводной она была вдвое ниже. Изменчивость числа видов в группах галобности соответствовала умеренным по силе «верхненормальному» и «значительному» типам. Среднее за год число видов морской группы было в несколько раз выше, чем у других групп. Максимум видового разнообразия галобных групп приходился на разные сезоны: у морской – на лето, у остальных – на середину весны. Суммарная фитомасса видов в прибрежном фитоценозе в течение 2004 г. варьировала в широких границах с максимумом в декабре и минимумом в марте (рис. 5). Внутригодовые изменения абсолютной фитомассы видов в сообществе и в отделах чаще носили колебательный характер без выраженных пиков. 80% среднемесячной фитомассы фитоценоза приходилось на долю бурых водорослей. Ежемесячно их вклад в продукционный процесс достигал 42–98%. Наблюдения показывают, что на мелководье к августу у большинства видов наблюдается массовое развитие особей ювенильной стадии, занимающих местообитание зрелых и уже частично поврежденных взрослых особей. Спустя месяц ценозообразующие виды бурых водорослей восстанавливают статус основных продуцентов прибрежного фитоценона.
Рис. 5. Внутригодовая динамика фитомассы макрофитобентоса в разные годы Fig. 5. Intra-annual dynamics of macrophytobenthos phytomass in different years
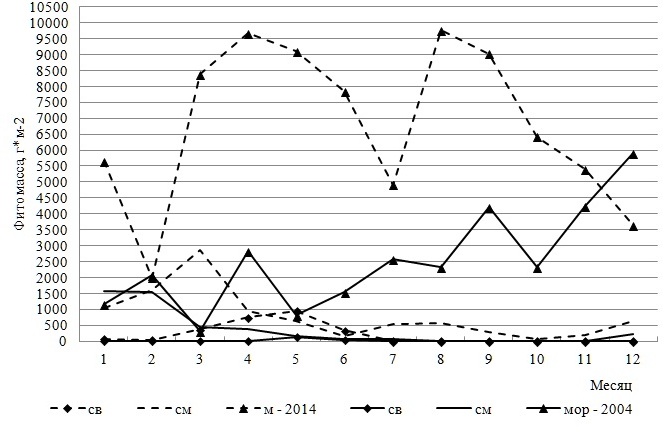
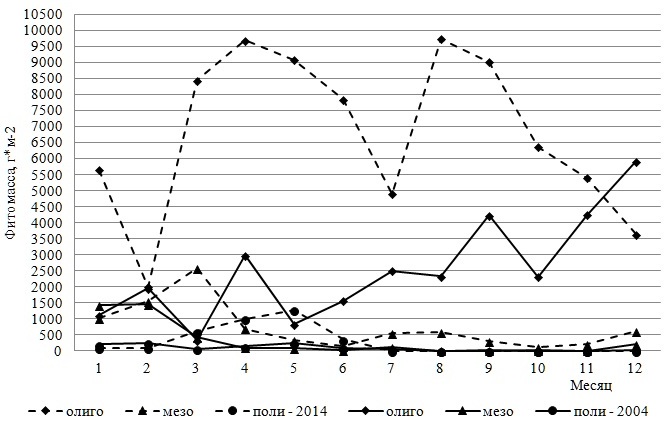
Кривые внутригодовых изменений абсолютной фитомассы Och и всего фитоценона соответствовали друг другу. Роль других отделов и особенно Ch в формировании первичной продукции была незначительной. Так, на долю фитомассы зеленых и красных водорослей в отдельные месяцы приходилось менее 1–2%. Все вариации абсолютной фитомассы отделов и сообщества в целом заметно превышали «норму» (Сv=54–166%). Видовой состав ключевых продуцентов в течение года менялся незначительно. Обычно он включал оба вида Cystoseira и только в первые три месяца такую роль выполняли два типичных сезонно-зимних вида Scytosiphon lomentaria и Ectocarpus siliculosus. В этот период оба вида образуют густые заросли у уреза воды. Они входят в состав формации Scytosiphoneta, ассоциации которой наибольшего развития достигают именно в марте (Калугина-Гутник, 1975). Позже их вегетация замедляется. Цистозировая ассоциация является самой распространенной в Черном море и занимает прибрежную полосу скал и валунов. Описываемые исследования были проведены в районе верхней границы этой ассоциации. Индекс продукционного доминирования C. crinita равнялся 58%, у C. barbata он был почти вдвое ниже. На долю первого вида приходилось 21–84% общей фитомассы, а второго – 40–88%. Вклад эктокарпуса и сцитосифона в первые два месяца достигал четверти общей фитомассы, а в марте – 48%. Группа содоминантов была вдвое разнообразнее доминантов и состояла из представителей бурых и красных водорослей. Сопоставление видового состава обеих групп позволило считать виды цистозиры и сцитосифон факультативными доминантами. Индекс Шеннона варьировал широко (от 0,79 в октябре до 3,37 в феврале) и в среднем составлял 2,2±0,5. В системе продукционного доминирования, базирующейся на учете относительной фитомассы, присутствовали малозначимые, второстепенные, субдоминантные и доминантные виды. Более половины видового состава относились к малозначимой группе, вторую позицию с большим отрывом занимали второстепенные виды. Субдоминанты были представлены одним, а доминанты двумя видами (оба вида цистозиры). Рис. 6 иллюстрирует ход внутригодовых изменений фитомассы видов, принадлежащих разным экологическим группам. Они происходили во многом одинаково, что, вероятно, было связано с особенностями сочетаний галобных и сапробных характеристик видов. Известно, что большая часть олигосапробионтов по отношению к солености среды являются морскими видами, а мезосапробность нередко сочетается с принадлежностью вида к солоноватоводно-морской группе. Солоноватоводные виды относятся к полисапробным компонентам фитобентоса. Безусловно, возможны и другие сочетания экологических характеристик, но они встречаются редко.
Рис. 6. Внутригодовая динамика фитомассы сапробных и галобных групп Fig. 6. IIntra-annual dynamics of phytomass of saprobic and galob groups
В течение года морские и олигосапробные виды преобладали по уровню абсолютной фитомассы, которая увеличивалась к концу года. Пик продуцирования солоноватоводно-морских и мезосапробных видов приходился на первые три месяца, когда в сообществе бурно развивались сезонно-зимние сцитосифон и эктокарпус, известные как индикаторы средней степени органического загрязнения и распреснения морской среды. Роль остальных групп была в несколько раз меньше.
Состояние макрофитобентоса и его внутригодовая динамика в 2014 г. Спустя 10 лет макрофитобентос прибрежной акватории мыса Херсонес состоял из 67 видов 45 родов трех отделов (таблица). По уровню видового и родового (55% всех видов и 54% всех родов в текущем году) разнообразия господствовал Rh. Соотношение отделов по числу видов не изменилось, а величина индекса Фельдманна все также свидетельствовала о субтропическом характере прибрежной флоры. Группа таксономически значимых родов включала те же виды, что и в начале исследований, мало отличалось и численное выражение пропорции «вид : род» (1,5). Встречаемость каждого отдела составляла 100%, тогда как у видов она варьировала от 8 до 100%. Восемь видов трех отделов с максимально высоким показателем R формировали константное ядро ценоза. Средний показатель встречаемости R для всего сообщества достигал 42%, у бурых водорослей он был выше всех, у остальных – в равной степени ниже. Среди групп постоянства незначительно преобладали постоянная и случайная. Поскольку видовая представленность добавочной группы мало отличалась от других групп, распределение видов по категориям постоянства можно было считать равномерным. Среди Rh было много случайных видов, у Ch – добавочных, у Och – постоянных. Значения индексов J1 и J2 свидетельствовали о том, что сообщество в 2014 г. характеризовалось еще более выраженной неоднородностью видового состава. Среди водорослей доминировали малоактивные виды, а вторую позицию занимали высокоактивные. Среди зеленых водорослей было много среднеактивных видов, которые отсутствовали у бурых, а наибольшее развитие получали высокоактивные виды. Половина видового состава Rh имела невысокую встречаемость и входила в малоактивную группу. Общее число видов в течение года варьировало от 22 в ноябре до 40 в марте, достигая в среднем 28±3 (рис. 4). Кривая изменений абсолютного числа видов была двухвершинной с более выраженным пиком в марте и менее – в июле. Внутригодовые изменения анализируемого параметра находились в пределах биологической «нормы». Уровень видового разнообразия красных водорослей позволял им ежемесячно занимать лидирующую позицию. Среднее значение абсолютного числа видов красных водорослей было в 1,5 и 2,5 раза выше, чем у бурых и зеленых водорослей соответственно. Без превышения «нормы» варьировало разнообразие Och с минимумом в январе и августе. Максимум их показателя приходился на февраль и, как у Rh и всего цистозирового фитоценоза, на март. В большинстве случаев бурые водоросли по абсолютному числу видов занимали в сообществе вторую позицию. Ch уступали Och и, прежде всего, осенью и в конце года. Изменчивость числа видов Ch была заметно выше, чем у других отделов, но и она оставалась в пределах «нормы» (Cv=40%). В 2014 г. макрофитобентос состоял из видов 12 экогрупп, среди которых 45–62% были представителями морской, ведущей, однолетней и олигосапробной групп. Вторая позиция принадлежала солоноватоводно-морским, редким, сопутствующим, мезосапробным, многолетним и сезонным видам. На остальные группы приходилось 3–9% всего видового состава в текущем году. Экоспектр Ch включал виды всех идентифицированных групп, в числе которых наибольшее развитие получали солоноватоводно-морские, однолетние, все группы сапробности и встречаемости в Черном море. Экоспектр Och был сложен видами 9 групп, среди которых преобладали морская, ведущая, олигосапробная и сезонная группы. Среди Rh отсутствовали солоноватоводные виды и было много олигосапробных, морских, ведущих и однолетних. За счет отсутствия части групп спектры красных и бурых водорослей относились к неполночленным и проявляли большое сходство своих ключевых групп. Для внутригодовой динамики видового состава сапробных и галобных групп было характерно ежемесячное доминирование олигосапробной и морской групп, за которыми с большим отрывом следовали мезосапробные и солоноватоводно-морские водоросли. С января по май, а также в ноябре и декабре 2014 г. ход кривых для видового состава этих групп был одинаковым, в остальное время – противофазным. Начало весны и середина лета оставались периодами наибольшего развития перечисленных групп, тогда как минимумы числа их видов были разобщены во времени. Полисапробионты и солоноватоводные виды в отдельные месяцы отсутствовали. В целом, периодом максимума видового разнообразия всех групп являлся март или для некоторых из них еще и летние месяцы. Изменения числа видов в базовых группах по шкале Г.Н. Зайцева соответствовали биологической «норме». Общая фитомасса видов в фитоценозе в течение 2014 г. изменялась так широко, что ее крайние значения отличались друг от друга в три раза. Максимум общей абсолютной фитомассы ценоза приходился на весенний период вегетации и на август, когда уровень развития многих массовых форм достигал своего апогея (рис. 5). Величина коэффициента вариации (36%) свидетельствовала об умеренности внутригодовых колебаний продукционного показателя, а соответствующая им кривая имела двухвершинный характер с первым максимумом весной (март–май) и вторым – в августе и сентябре. У отделов кривая помесячных изменений фитомассы была одновершинной: у Ch и Rh – весной, у Och – в августе – сентябре. При этом тенденция изменений показателя у фитоценоза и бурых водорослей во времени была одной и той же, что соответствовало высокой роли такого флористического элемента в продукционном процессе. Каждый месяц на их долю приходилось от 26 до 88% совокупной фитомассы всех видов. Их вклад был особенно весомым в августе, сентябре и ноябре. У бурых водорослей, как у наиболее стабильного флористического компонента макрофитобентоса акватории мыса, внутригодовая трансформация фитомассы не была интенсивной и соответствовала «верхненормальному» типу изменчивости признаков. У зеленых водорослей пик продуцирования приходился на период с марта по май, тогда как в ноябре и декабре доля их фитомассы не достигала 1%. Красные водоросли в качестве продуцентов в течение большей части года уступали бурым. Только в феврале и мае абсолютная фитомасса двух отделов была примерно одинаковой, а в апреле у красных водорослей она была выше в 2,5 раза. В отличие от 2004 г., в 2014 г. видовой состав ключевых продуцентов менялся значительно, особенно в период с января по август. Позже эта роль принадлежит одному виду (C. barbata). В целом, группа основных продуцентов сообщества 2014 г. была в несколько раз разнообразнее, чем в начале исследований и включала оба вида цистозиры, Padina pavonica, Palisada perforata, C. ciliatum, C. diaphanum. Индекс Dt у C. barbata достигал 84%, у C. crinita – 25%. У остальных доминантов он был ниже. На долю C. crinita приходилось 22–27% общей фитомассы, а C. barbata – 29–71%. Группа содоминантов по своему разнообразию не уступала доминантам. Все это указывало на увеличение степени полидоминантности анализируемого сообщества к концу десятилетия. В систему продукционного доминирования входили малозначимые, второстепенные, субдоминантные и доминантные виды. Субдоминанты были представлены тремя видами, а в качестве лидера сообщества выступала C. barbata. Величина индекса Шеннона варьировала от 1,5 в сентябре до 3,3 в феврале и марте, составляя в среднем 2,5±0,4. Время проявления крайних значений индекса и его среднее значение в 2004 и 2014 гг. во многом совпадали. Рис. 6 демонстрирует годовой ход изменений фитомассы галобных и сапробных групп в 2014 г. Эти изменения дублировали друг друга не только своей направленностью, но и интенсивностью, которая, тем не менее, всегда превышала «норму». На протяжении года с существенным отрывом лидировали морские и олигосапробные виды. Вклад других групп и особенно солоноватоводной и полисапробной в продукционный процесс был во много раз ниже. Кривая внутригодовых вариаций фитомассы лидирующих групп имела двухвершинный характер с максимумом в апреле и августе. В апреле с прогревом воды до 15°С начиналась массовая вегетация большинства макроводорослей, достигавшая к концу лета максимума. Солоноватоводная и полисапробная группы формировали наибольшую для себя фитомассу в мае, а мезосапробная и солоноватоводно-морская – в марте.
Сравнительный анализ структурно-функциональной организации макрофитобентоса в 2004 и 2014 гг. Подобный анализ позволяет судить о тех элементах системы, изменения которых носят скорее адаптивный характер и не являются критическими для ее функционирования. В соответствии с механизмом «конгенерического гомотаксиса» они должны способствовать сохранению стабильности экосистемы в изменчивых условиях прибрежной зоны моря путем реагирования только отдельных элементов системы на возмущающее воздействие извне (Уитеккер, 1980; Evstigneeva, Tankovskaya, 2019). В сравниваемые периоды наблюдений макрофитобентос обладал одной и той же видовой пропорцией отделов, отражающей видовое превосходство красных водорослей и равную долю участия Och и Ch, одинаковым перечнем таксономически значимых родов и численным значением пропорции «вид : род». Значения коэффициента Жаккара свидетельствовали о том, что видовой состав фитоценоза совпадал на 66%. Примерно столько же сходных видов было среди бурых и красных водорослей. Еще большую степень подобия в сопоставляемые годы проявлял видовой комплекс зеленых водорослей (Kj =80%). Коэффициент Жаккара для каждой пары одноименных месяцев, но в разные годы варьировал от 22% в ноябре до 56% в январе. Межсезонные величины Kj зимой, весной, летом были примерно одинаковыми (41–47%) и выше, чем осенью (35%). В 2004 и 2014 гг. бурые водоросли проявляли самую высокую встречаемость. Среди видов всегда господствовали случайные и малоактивные виды, неизменным оставался вклад группы особо активных элементов биосистемы. Все внутригодовые изменения абсолютного числа видов происходили без превышения биологической «нормы», при этом их направленность у Rh как лидера таксономического состава и у всего фитоценоза совпадала. Макрофитобентос в начале и конце исследований состоял из водорослей 12 экогрупп, среди которых высоким видовым разнообразием отличались морская, ведущая, однолетняя и олигосапробная. Большое качественное сходство проявляли экоспектры Rh и Och, особенно в своих базовых частях. Для видового состава сапробных групп, как и галобных, были характерны длительные периоды противофазных внутригодовых изменений, одинаковая временная локация крайних значений числа видов и «нормальный» тип его вариаций. Абсолютная фитомасса ценоза и Och как основного флористического компонента продукционного процесса в начале и конце десятилетия менялась сходным образом, во многом совпадали направленность и степень вариаций этого показателя у галобных и сапробных групп. Среди ключевых продуцентов неизменно присутствовали виды Cystoseira, а в общем составе преобладали малозначимые виды с очень низкой относительной фитомассой. Средняя величина индекса Шеннона в разные годы совпадала и свидетельствовала о формировании структуры сообщества, близкой к полидоминантной. Проявление крайних значений индекса приходилось на одни и те же сезоны. Вместе с тем, в конце десятилетия сообщество характеризовалось еще большим разнообразием видов, родов и константного ядра флоры, а вклад содоминантных видов в систему продукционного доминирования и величина общей фитомассы и фитомассы отделов были гораздо выше, чем в его начале. Расчеты показали, что среднее значение фитомассы фитоценоза в 2004 г. значимо (на уровне α=5%) отличалось от такового в 2014 г. Эта разница оказалась значимой и при сравнении фитомассы по отделам (Rh, Ch, Och). Более существенной оказалась разница между анализируемыми годами по числу видов. У отделов, так же как и у всего фитоценоза, различие в среднем числе видов оказалось значимым на уровне α=1%. Фитоценоз в акватории мыса в начале и конце наблюдений отличался разной продолжительностью противофазных изменений числа видов в сапробных группах, не совпадали размах крайних значений фитомассы ценоза и интенсивность ее внутригодовых изменений. В исследованный промежуток времени менялись степень доминирования C. crinita, вклад ее и близкородственного ей вида, а также второстепенных структурных элементов в общую фитомассу. Со временем усиливалась неоднородность видовой структуры, подтверждением чему была величина одного из индексов гомотонности (J2). Смена доминирующих видов происходила чаще, а полидоминантный характер сообщества проявлялся полнее, чем в начале десятилетия.
Заключение
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена по теме госзадания ФГБУН ИМБИ РАН «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» номер госрегистрации АААА-А18-118021350003-6.
Список литературы
Статья поступила в редакцию 24.12.2019
Об авторах Евстигнеева Ирина Константиновна - Evstigneeva Irina K. кандидат биологических наук ikevstigneeva@gmail.com Танковская Ирина Николаевна – Tankovskaya Irina N. младший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН», Севастополь, Россия (Kovalevsky Institute of Biology of the Southern Seas RAS, Sevastopol, Russia) itankovskay@gmail.com Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ РАН; тел. (8692)55-07-95.
ССЫЛКА НА СТАТЬЮ: Евстигнеева И.К., Танковская И.Н. Макрофлора прибрежной акватории западной части Гераклейского полуострова и ее внутригодовая динамика (мыс Херсонес, Черное море) // Вопросы современной альгологии. 2020. № 1 (22). С. 39–55. URL: http://algology.ru/1582 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-39-55 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Macroflora of the сoastal waters of the western part of the Heracles peninsula and its intra-annual dynamics (Khersonese cape, the Black Sea) Irina K. Evstigneeva, Irina N. Tankovskaya Kovalevsky Institute of Biology of the Southern Seas RAS, Sevastopol, Russia The species and ecological composition, species occurrence, quantitative characteristics and peculiarities of the intra-annual variability of macrophytobenthos in the coastal waters of Khersonese cape in the west of the Heracles Peninsula are described. 71 macroalgae species of 46 genera of Chlorophyta, Ochrophyta and Rhodophyta were revealed. The basis of taxonomic diversity is Rhodophyta, whereas ecological diversity is due to marine, leading, oligosaprobic, and annual species. Based on the study of heterogeneous states of macrophytobenthos in 2004 and 2014, its labile and constant features were determined. Key words: microphytobenthos; ecological-taxonomic composition; occurrence; phytomass; dominants; variability; the Khersonese cape; The Black Sea.
References
Authors Evstigneeva Irina K. Orcid ID – https://orcid.org/0000-0001-7473-251X Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia ikevstigneeva@gmail.com Tankovskaya Irina N. Orcid ID – https://orcid.org/0000-0002-4907-0179 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia itankovskay@gmail.com
ARTICLE LINK: Evstigneeva I.K., Tankovskaya I.N. Macroflora of the сoastal waters of the western part of the Heracles peninsula and its intra-annual dynamics (Khersonese cape, the Black Sea). Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 1 (22). P. 39–55. URL: http://algology.ru/1582 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-39-55 Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||