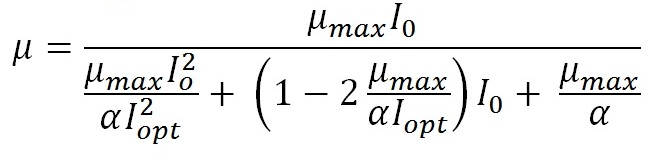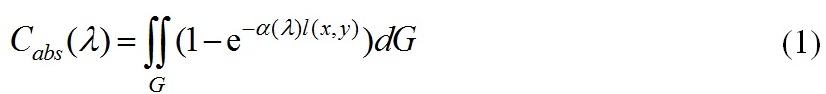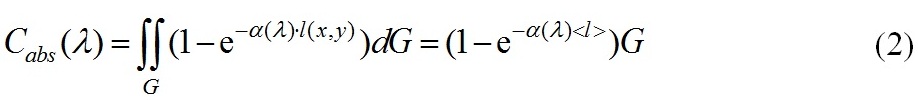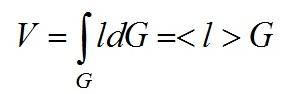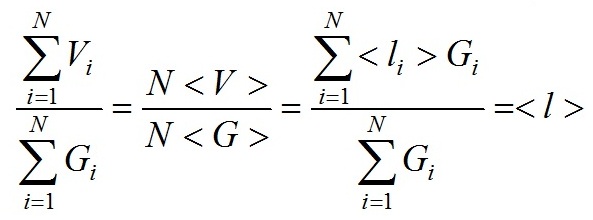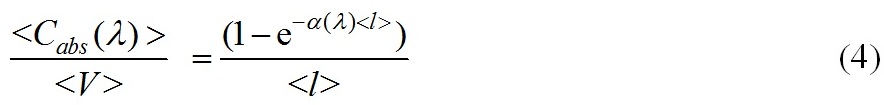|
|
|
Роль формы клетки диатомовых в конкуренции за энергию света
Федоров А.В., Парамонов Л.Е., Силкин В.А. Aleksey V. Fedorov, Leonid E. Paramonov, Vladimir A. Silkin
Институт океанологии им. П.П. Ширшова РАН, Южное отделение (Геленджик, Россия)
УДК 574.24
Предложен новый параметр, регулирующий распространение вида – среднесуточная поглощенная энергия ФАР единицей объема клеток фитопланктона, определяемый формой, размером и концентрацией пигментов. Параметр рассчитан для доминирующих видов диатомовых северо-восточной части Черного моря и нормирован по среднесуточной ФАР для периодов доминирования. Установлено, чтобы виды успешно конкурировали за экологическую нишу, данный параметр должен быть примерно на одном уровне в разные сезоны. Ключевые слова: фитопланктон; диатомовые; свет; сечение поглощения; скорость роста; форма клетки.
Введение Водные фотоавтотрофные микроорганизмы существуют в градиентных условиях обеспечения энергией света. Действительно с глубиной уменьшается количество световой энергии и изменяется его спектральный состав (Шифрин, 1983; Kirk, 2011). Энергетический фактор управляет фотосинтетическим процессом фиксации неорганического углерода и, очевидно, что ему уделяется значительное внимание. Описание зависимости продукционных процессов как функции световой энергии имеет длительную историю, начиная от простейшей модели Блэкмана. Предложено большое количество моделей (Smith, 1936; Steel, 1962; Vollenwieder, 1965; Bannister, 1974; Jassby, Platt, 1976; Eilers, Peeters 1988; Geider, 1998). В основу всех моделей положена гиперболическая зависимость скорости фотосинтеза (или роста) фотоавтотрофных микроорганизмов от интенсивности падающего света, и в простейшем случае они являются аналогом модели Моно, в которой имеются только две константы: максимальная удельная скорость роста (или фотосинтеза) и константа полунасыщения, равная интенсивности света при скорости роста в половину от максимальной. Более сложные модели учитывают эффект ингибирования в условиях высокой интенсивности. Они оперируют большим количеством констант. К примеру, рассмотрим модель (Schwaderer et al., 2011) удельной скорости роста μ как функции интенсивности падающего света I0:
Здесь уже как минимум три константы: μmax – максимальная удельная скорость роста; I2opt.– интенсивность света, при которой удельная скорость роста равна максимальной и α – параметр, характеризующий угол наклона световой кривой фотосинтеза при малых интенсивностях света. Очевидно, что определить эти три константы для доминирующих видов фитопланктона даже для какой-то конкретной части моря не представляется реальной задачей. Действительно, для этого необходимо получить чистые культуры этих видов, что представляет трудную самостоятельную задачу даже для небольшого числа видов. Далее, в длительных экспериментах с непрерывной культурой получить зависимости удельной скорости роста при различных световых потоках. К настоящему времени изучены экофизиологические свойства видов, которые составляют менее 1% существующих видов морского фитопланктона (Sommer et al., 2016). Одним из выходов является изучение экофизиологических свойств только доминирующих видов. Выяснилось, что способность клетки поглощать (или пропускать) световые волны существенно зависит от формы клетки (Morel, Bricaud. 1981; Finkel, Irwin, 2000; 2001). Поэтому для оценки констант модели, была сделана попытка найти их связь с морфологическими свойствами клеток (Schwaderer et al., 2011). Однако точность полученных соотношений не позволяет использовать эти характеристики в качестве экологического параметра, способного объяснить конкурентные отношения видов и закономерности сукцессионных процессов. В нашей работе сделана попытка рассчитать такой параметр как потенциальная возможность клетки поглощать энергию света. Для этого используется идея зависимости оптических спектров поглощения от размера и формы клеток. Ранее было показано, что принципиальным для оптических свойств являются объем и площадь проекции клеток на плоскость, перпендикулярную направлению падающего излучения (Парамонов, 1994, 1995, 2004) и разработан алгоритм расчета (Парамонов, 2015). В настоящей работе вводится энергетический параметр, основанный на оценке энергии, поглощенной единицей объема клеток фитопланктона, обсуждается его экологическое содержание.
Материалы и методы Теоретическим основанием являются результаты оценки спектров поглощения диатомовых водорослей в зависимости от размера, формы и пигментного состава клеток фитопланктона (Парамонов, 2015, 2018). В качестве основных объектов исследования были выбраны доминирующие виды диатомовых водорослей северо-восточной части Черного моря (Silkin et al., 2019). Оценки размеров клеток проводили как с использованием популяций природного фитопланктона северо-восточной части Черного моря, так и полученных в результате экспериментальных исследований фитопланктона. Методы культивирования природного фитопланктона приведены в работах (Silkin et al., 2014; Силкин и др., 2015).
Результаты и обсуждение
Способность клеток фитопланктона поглощать свет в области фотосинтетически активной радиации (ФАР) – видимом диапазоне длин волн 400 ≤ λ ≥ 700 (в нм) существенно зависит от формы клетки и пигментного состава. Для оценки сечений поглощения водных суспензий биологических клеток используем приближение аномальной дифракции (Ван де Хюлст, 1961). Пусть направление падающего излучения совпадает с осью Z, и обозначим через l=l(x,y) длину отрезка локального луча, прошедшего через частицу и точку (x,y)∈G. Центр частицы совпадает с началом координат. Сечение поглощения однородной одиночной частицы в приближении аномальной дифракции имеет вид (Ван де Хюлст, 1961; Парамонов, 2018)
здесь G рассматривается как площадь проекции частицы на плоскость xOy, ортогональную направлению падающего излучения, так и область интегрирования, α(λ)[м-1] – показатель поглощения клеточного вещества. С физической точки зрения сечение поглощения – мощность поглощенной энергии, нормированной на интенсивность падающего на частицу излучения, и имеет размерность м2 . Воспользуемся теоремой о среднем, чтобы оценить интеграл (1)
При приближенной оценке интеграла (2) величина < l > имеет простую физическую интерпретацию – средняя длина пути лучей прошедших через частицу и оценивается на основе
для взвеси N независимых частиц имеет место следующее соотношение
здесь скобки < > означают усреднение по ансамблю частиц. В дальнейшем, используем для сечения поглощения взвеси слабопреломляющих частиц формулу
Корректность применения формулы (3) для взвесей хаотически ориентированных эллипсоидальных, цилиндрических и полидисперсных сферических частиц продемонстрирована в (Парамонов, 2018). На основании (3), удельный коэффициент поглощения на единицу объема клетки имеет вид
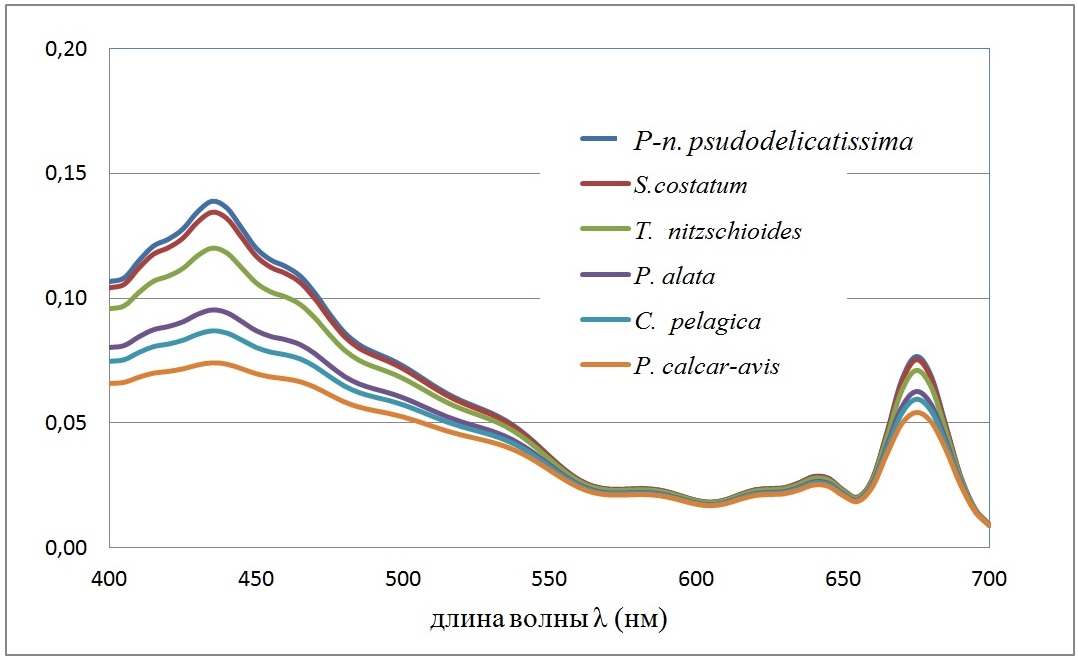
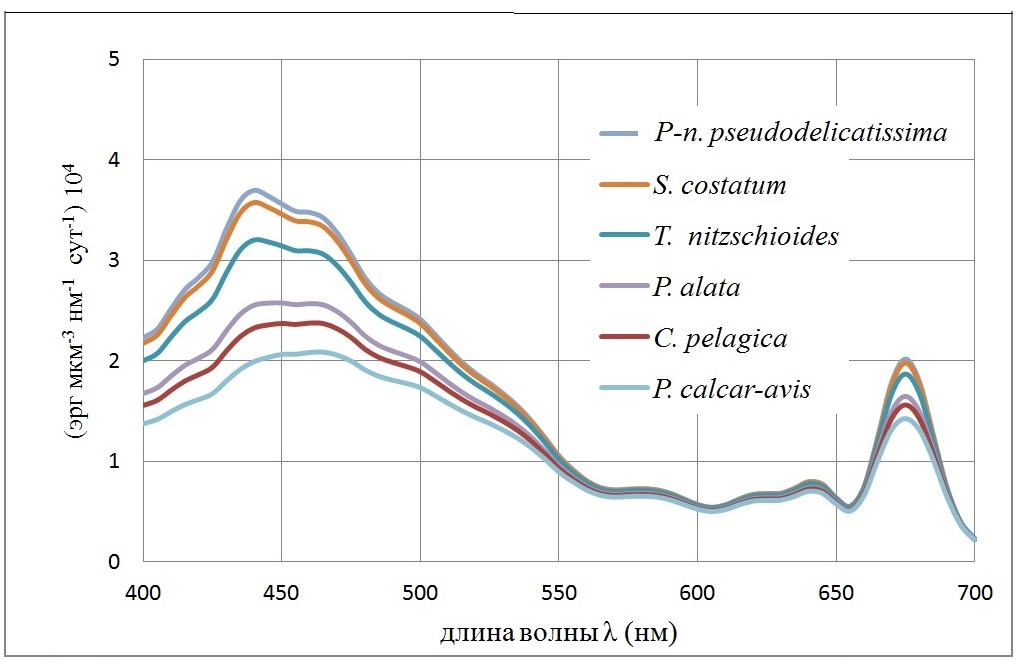
и характеризует эффективность поглощения единицей объема клетки (рис. 1).
Рис. 1. Спектральная зависимость удельных коэффициентов поглощения <Cabs(λ)>/<V> единицей объема клетки (мкм-1) для клеток доминирующих диатомовых водорослей. Внутриклеточная концентрация хлорофилла а полагалась 4 мг/мл Fig. 1. The spectral dependence of specific absorption coefficients <Cabs (λ)> / <V> by unit of cell volume (mkm-1) for cells of dominant diatoms. Intracellular chlorophyll a concentration was 4 mg/ml
Список диатомовых водорослей на рис. 1 приведен в порядке убывания <Cabs(λ)>/<V> – эффективности поглощения единицей объема клеток фитопланктона. Пусть E (z, λ) [Вт/м2нм-1] – спектральная плотность подводной облученности (интенсивности) света на глубине z. Подводная облученность E (z) [Вт/м2] в области ФАР имеет вид интеграла
спектральная плотность мощности поглощенной фитопланктоном энергии – Cabs (z, λ) E (z, λ), а мощность поглощенной клетками энергии ФАР равна
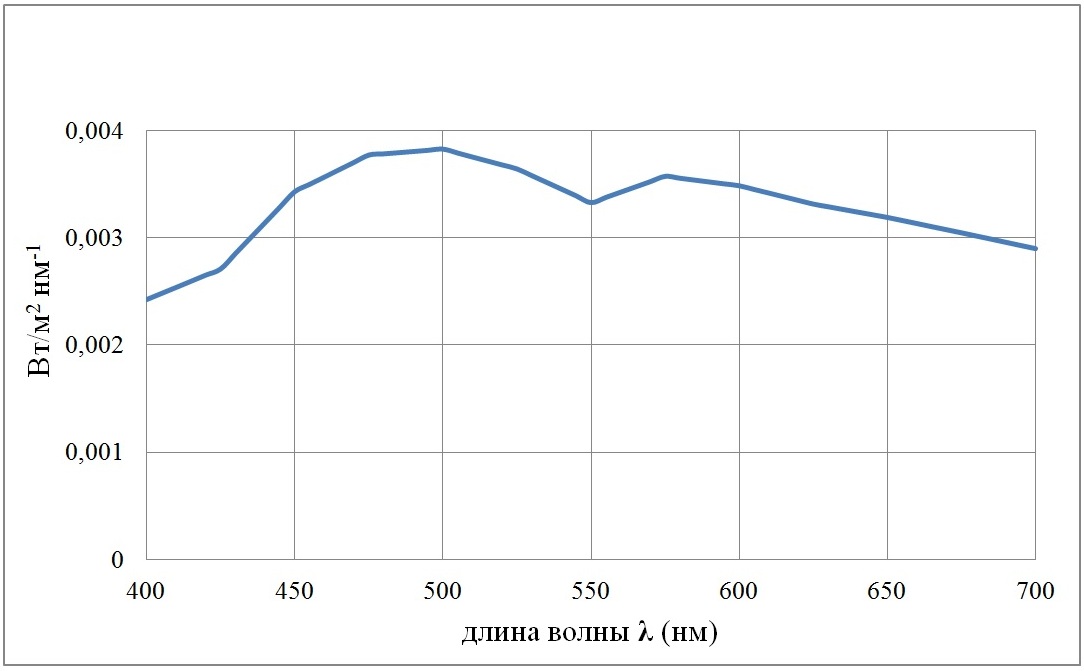
Как отмечается (Маньковский, Маньковская, 2013), спектральное распределение солнечной радиации, падающей на поверхность моря, слабо зависит от облачности и высоты Солнца. Исключение составляют высоты менее 15°. Для расчетов было взято типичное распределение энергии Солнца на поверхности моря, представленное в статье (Шифрин, 1978) для высоты Солнца 30°. На рис. 2 приведена спектральная плотность поверхностной облученности E(0, λ) при суммарной облученности E(0)·(5) в области ФАР 1 Вт/м2.
Рис. 2. Спектр плотности поверхностной облученности E(0, λ) для облученности в области ФАР, равной 1 Вт/м2 Fig. 2. Spectrum of surface irradiance density E(0, λ) for irradiance in the PAR range equal to 1 W/m2
На рис. 3 представлена среднесуточная спектральная плотность поглощенной энергии единицей объема клетками различных диатомовых водорослей (рис.1) при поверхностной облученности (данные рис. 2) –
Рис. 3. Среднесуточная спектральная плотность поглощенной энергии для доминирующих видов диатомовых водорослей. E(0) =1 Вт/м2 Fig. 3. Average daily spectral density of absorbed energy for the dominant species of diatoms.
Из рис. 3 следует, что существуют 2 группы водорослей, которые достаточно четко разделяются по спектральной плотности поглощенной энергии. Первая включает Pseudo-nitzschia pseudodelicatissima, Skeletonema costatum, Thalassionema nitzschioides. Эти виды объединяет одно свойство – они обладают малым объемом клеток (до 1000 мкм3) и, следовательно, их можно отнести к классу мелкоклеточных форм. Остальные диатомеи имеют объем клетки выше 5000 мкм3 и это крупноклеточные формы. Однако вид Proboscia alata обладает большой пластичностью в средних объёмах клетки, и, согласно наблюдениям, его клетки в период ограничения световых потоков могут иметь диаметр (от 1,5 мкм, объём клетки – около 700 мкм3), такой же, как и клетки Pseudo-nitzschia pseudodelicatissima. При этом Proboscia alata может конкурировать в летний период с крупноклеточной диатомовой водорослью Pseudosolenia calcar-avis. По результатам собственных измерений средний диаметр последней составил летом – 11 мкм, объём клетки – 38000 мкм3; а у Proboscia alata – 7 мкм и объём – 20000 мкм3.
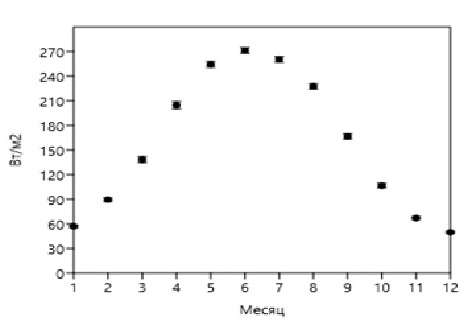
Fig. 4. Average daily irradiance of the sea surface E(0) in the region of Gelendzhik
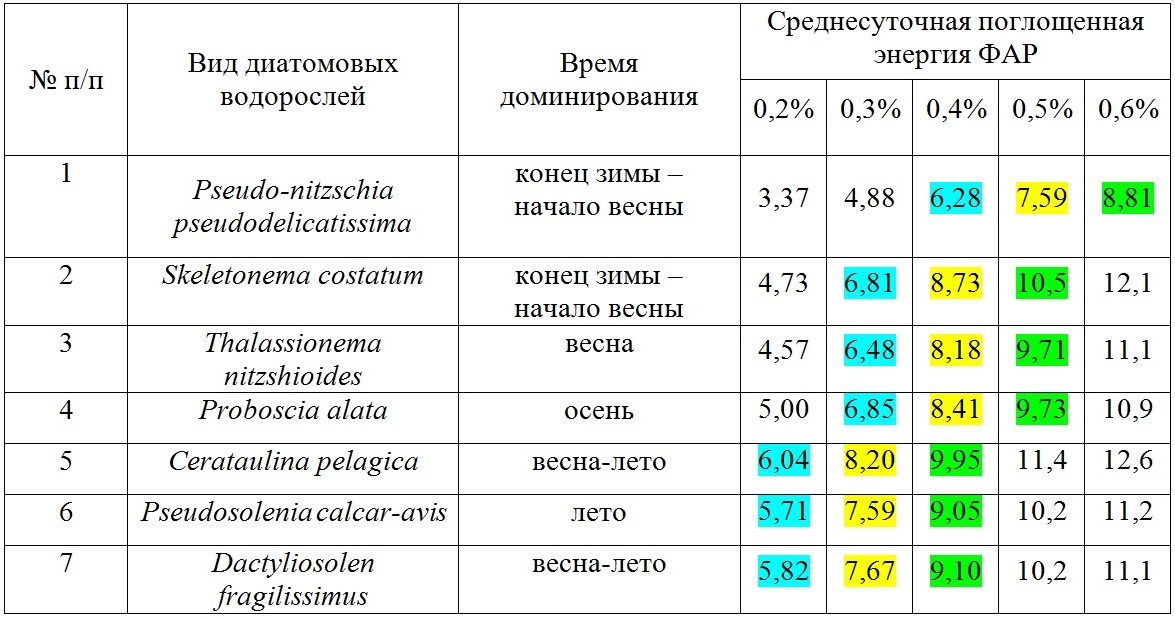
Данные, приведенные на рис. 1–3, нормированы на объем клеток фитопланктона, величину облученности (интенсивности), время и являются первичными для настоящего исследования. Учитывая, что облученность (интенсивность) зависит от времени суток и погодных условий, в расчетах используется среднесуточная облученность E(0) (рис. 4). В табл. 1 приведены значения среднесуточной поглощенной энергии ФАР единицей объема диатомовых водорослей различного размера, доминирующих в различные времена года при среднесуточной облученности E(0) (рис. 4). Данные приведены для различных внутриклеточных концентраций хлорофилла а – 0,2%, 0,3%, 0,4%, 0,5%, 0,6% от биомассы клеток фитопланктона. На основе анализа отечественной и зарубежной литературы в обзорной статье (Минеева, Щур, 2012) рассмотрены вопросы содержания хлорофилла a в единице биомассы фитопланктона в разных экологических условиях, что вызвано необходимостью получения переходных коэффициентов при оценке биомассы с использованием хлорофилла а. Приведенные в табл. 1 данные соответствуют внутриклеточным концентрациям хлорофилла а в олиготрофных, мезотрофных и эвтрофных водах.
Таблица 1. Среднесуточная поглощенная энергия ФАР единицей объема клетки фитопланктона (эрг·мкм-3), нормированная на среднесуточную облученность поверхности моря E(0) для сезона доминирования приведённых видов Table 1. Average daily absorbed PAR energy per unit of phytoplankton cell volume (erg·μm-3), normalized to the average daily irradiance of the sea surface E(0) for the season of dominance of species in the table
Известно, что интенсивность света контролирует содержание хлорофилла а у высших растений (Рабинович, 1953). При суточных и сезонных изменениях инсоляции одним из главных факторов, определяющих содержание пигментов в клетках водорослей, может быть свет. Внутриклеточная концентрация хлорофилла а возрастает при низкой облученности, как в культурах водорослей, так и в природном сообществе (Минеева, Щур, 2012). Сезонные изменения удельного содержания хлорофилла а в клетке должны отражать изменения поступающей радиации в течение года. В сезонном цикле максимальные значения внутриклеточной концентрации хлорофилла а в основном регистрируются поздней осенью или зимой, при летней инсоляции в результате светового ингибирования может наблюдаться снижение содержания хлорофилла а в клетках (Falkowski, Laroche, 1991). Увеличение внутриклеточной концентрации хлорофилла а часто отмечается с глубиной при снижении облученности, в том числе при «цветении», когда наблюдается эффект самозатенения. Пусть средняя внутриклеточная концентрация хлорофилла а в диатомовых водорослях достигает 0,3%, 0,4 %, 0,5% (3, 4, 5 мг мл-1 соответственно) в весенний и осенний периоды, в зимний период увеличивается на 0,1%, а летом уменьшается на 0,1%. Тогда среднесуточная поглощенная энергия ФАР единицей объема различными диатомовыми водорослями при трех вышеотмеченных концентрациях хлорофилла 0,3%, 0,4 %, 0,5% и предположениях обозначена соответственно синим, желтым и зеленым цветом. Вариации (% от максимального значения) в пределах каждого варианта не превышают соответственно 18%, 13%, 16%. Отсюда следует, что во время доминирования вида его способность поглощать энергию света должна быть максимальной. Причем, для всех видов она приблизительно равна и не зависит от сезона. Другими словами, для того, чтобы стать доминирующим видом должна реализоваться одна стратегия – среднесуточная поглощенная энергия на единицу объема (или массы) клетки должна быть максимальной. Так как среднесуточная энергия ФАР для ВКС меняется в течение года вместе с углом наклона солнца, продолжительностью светового дня и глубиной сезонного термоклина, разница между доступной ФАР летом и, например, в конце осени или ранней весной достигает величины порядков. Следовательно, отбор претендующих на доминирование видов в тех или иных условиях освещения идёт по сбалансированности количества поглощённой энергии на единицу объёма в сутки. При максимальных среднесуточных количествах ФАР растут виды с низким удельным коэффициентом поглощения, что достигается увеличением размеров клеток с одной стороны, и уменьшением внутриклеточной концентрации пигментов – с другой. И полностью противоположная картина наблюдается при низких среднесуточных облучённостях. Среднесуточная поглощенная энергия является важным экологическим параметром, который регулирует распространение видов как во времени, так и в пространстве. Именно способность клеток эффективно поглощать энергию света позволяет мелкоклеточным формам диатомей доминировать в конце зимы и начале весны при относительно низкой интенсивности солнечной радиации. Крупноклеточные формы, напротив, имеют возможность интенсивно развиваться только в летний период. Это свойство поглощать энергию света регулирует положение диатомовых в пространстве, прежде всего, по вертикальной составляющей. Так, в центральной части Каспийского моря в летний период крупноклеточные диатомеи имели максимумы численности в верхних близких к поверхности слоях, а мелкоклеточная диатомея Pseudo-nitzschia seriata располагалась на нижних (до 90 м глубины) горизонтах (Pautova et al., 2015). Таким образом, предложен новый параметр – среднесуточная поглощенная энергия ФАР единицей объема клеток фитопланктона, который определяется формой и размером клетки. Этот параметр рассчитан для доминирующих видов диатомового фитопланктона северо-восточной части Черного моря. Показано, что для доминирования вида значение его должно быть сбалансировано в зависимости от облучённости в конкретный сезон и на конкретных глубинах, и быть не ниже необходимого для обеспечения роста уровня, а максимальные значения данного параметра у разных видов примерно одинаковы. По степени эффективности поглощать световую энергию доминанты можно разделить на два размерных класса – мелкоклеточные и крупноклеточные формы, которые имеют разные экологические стратегии. При этом крупноклеточные формы обладают большей пластичностью в плане адаптационного потенциала к чрезмерным, ингибирующим уровням или относительно быстрым колебаниям облучённости за счёт большего диапазона внутриклеточных концентраций пигментов и их упаковки. Показано, что введенный параметр отображает важные экологические свойства, позволяющие регулировать положение вида во времени и пространстве.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Исследование проведено в рамках темы госзадания № 0149-2019-0014 ИО РАН.
Список литературы
Статья поступила в редакцию 23.03.2019
Об авторах Фёдоров Алексей Владимирович − Fedorov Aleksey V. младший научный сотрудник, Институт океанологии им.П.П.Ширшова РАН, Южное отделение, Геленджик, Россия (P.P. Shirshov Institute of Oceanology RAS, Southern branch, Russia, Gelendzhik)
Парамонов Леонид Евгеньевич − Paramonov Leonid E. доктор физико-математических наук lparamonov@yandex.ru Силкин Владимир Арсентьевич − Silkin Vladimir A. доктор биологических наук vsilkin@mail.ru Корреспондентский адрес: Россия, 353470, Краснодарский край, г. Геленджик, ул. Просторная 1-г. Телефон/факс 8-861-41-280-89.
ССЫЛКА НА СТАТЬЮ: Федоров А.В., Парамонов Л.Е., Силкин В.А. Роль формы клетки диатомовых в конкуренции за энергию света // Вопросы современной альгологии. 2019. № 3 (21). С. 37–47. URL: http://algology.ru/1568 DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-37-47
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
The role of the diatom cell form in the competition for light energy Aleksey V. Fedorov, Leonid E. Paramonov, Vladimir A. Silkin Shirshov Institute of Oceanology RAS, Southern Branch (Gelendzhik, Russia) We proposed a new parameter regulating distribution of the species – the daily average absorbed energy of PAR by a unit of phytoplankton cell volume, determined by the shape, size and concentration of pigments. We calculated this parameter for some dominant diatom species of the northeastern part of the Black Sea and normalize it by the average daily PAR for periods of dominance. We established that for species successfully compete for an ecological niche this parameter should be approximately at the same level in different seasons. Key words: phytoplankton; diatoms; light; absorption cross-section; growth rate; cell shape.
Authors Fedorov Aleksey V. ORCID - https://orcid.org/0000-0003-4673-6649 Shirshov Institute of Oceanology RAS, Southern Branch, Russia, Gelendzhik
Paramonov Leonid E. ORCID - https://orcid.org/0000-0002-8561-8197 Shirshov Institute of Oceanology RAS, Southern Branch, Russia, Gelendzhik lparamonov@yandex.ru Silkin Vladimir A. ORCID - https://orcid.org/0000-0003-0603-7229 Shirshov Institute of Oceanology RAS, Southern Branch, Russia, Gelendzhik vsilkin@mail.ru
References
ARTICLE LINK: Fedorov A.V., Paramonov L.E., Silkin V.A. The role of the diatom cell form in the competition for light energy. Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 3 (21). P. 37–47. URL: http://algology.ru/1568 DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-37-47
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||